Получение в промышленности серной кислоты: Страница не найдена — Портал Продуктов Группы РСС
Страница не найдена — Портал Продуктов Группы РСС
Сообщите нам свой адрес электронной почты, чтобы подписаться на рассылку новостного бюллетеня. Предоставление адреса электронной почты является добровольным, но, если Вы этого не сделаете, мы не сможем отправить Вам информационный бюллетень. Администратором Ваших персональных данных является Акционерное Общество PCC Rokita, находящееся в Бжег-Дольном (ул. Сенкевича 4, 56-120 Бжег-Дольный, Польша ). Вы можете связаться с нашим инспектором по защите личных данных по электронной почте: .
Мы обрабатываем Ваши данные для того, чтобы отправить Вам информационный бюллетень — основанием для обработки является реализация нашей законодательно обоснованной заинтересованности или законодательно обоснованная заинтересованность третьей стороны – непосредственный маркетинг наших продуктов / продуктов группы PCC .
Как правило, Ваши данные мы будем обрабатывать до окончания нашего с Вами общения или же до момента, пока Вы не выразите свои возражения, либо если правовые нормы будут обязывать нас продолжать обработку этих данных, либо мы будем сохранять их дольше в случае потенциальных претензий, до истечения срока их хранения, регулируемого законом, в частности Гражданским кодексом.
В любое время Вы имеете право:
- выразить возражение против обработки Ваших данных;
- иметь доступ к Вашим данным и востребовать их копии;
- запросить исправление, ограничение обработки или удаление Ваших данных;
- передать Ваши персональные данные, например другому администратору, за исключением тех случаев, если их обработка регулируется законом и находится в интересах администратора;
- подать жалобу Президенту Управления по защите личных данных.
Получателями Ваших данных могут быть компании, которые поддерживают нас в общении с Вами и помогают нам в ведении веб-сайта, внешние консалтинговые компании (такие как юридические, маркетинговые и бухгалтерские) или внешние специалисты в области IT, включая компанию Группы PCC .
Больше о том, как мы обрабатываем Ваши данные Вы можете узнать из нашего Полиса конфиденциальности.
Серная кислота. Получение серной кислоты. Сернистая кислота
Серная кислота
Концентрированная серная кислота
Серная кислота H2SO4 — одна из сильных двухосновных кислот.
Химические свойства серной кислоты
— химическая реакция с металлами:
H2SO4 + Fe → FeSO4 + H2;
2H2SO4 + Cu → CuSO4 + SO2 +2H2O — в этом случае кислота является концентрированной.
— химическая реакция с оксидами металлов:
H2SO4 + CuO → CuSO4 + H2O
Получающийся раствор синего цвета — CuSO4 — раствор медного купороса. Серную кислоту еще называют купоросным маслом, так как при реакциях с металлами и их оксидами образуются купоросы. Например, при химической реакции с железом (Fe) — образуется светло-зелёный раствор железного купороса.
— химическая реакция с основаниями и щелочами (или реакция нейтрализации)
H2
— химическая реакция с серой (кислота — концентрированная, реакция — при нагревании):
2H2SO4 + S → 3SO2 + 2H2O
— химическая реакция с солями (например, со стиральной содой Na2CO3):
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
Получение серной кислоты
Сернистый ангидридСерную кислоту
S + O2 → SO2
— сернистый газ — с удушливым запахом серы.
SO2 + O2 → SO3. Эта химическая реакция производится на катализаторе (оксиде ванадия V2O5). Вещество SO3 — сернистый ангидрид — очень гигроскопичное кристаллическое прозрачное вещество, жадно поглощающее воду с образованием
SO3 + H2O → H2SO4
Сернистая кислота
Сернистая кислота — или Н2SO3 — так называют водный раствор оксида серы (SO2) в воде. На самом деле такого химического вещества не существует, его используют лишь для удобства составления химических уравнений реакций.
Раствор SO2 в воде, имеет кислую среду. Такому раствору присущи все свойства кислот, в том числе реакция нейтрализации.
Сернистая кислота (или правильнее сказать — раствор сернистого газа в воде) образует два вида солей: сульфиты и гидросульфиты. Эти соли являются восстановителями.
Эти соли являются восстановителями.
Н2SO4 + NaOH → NaНSO3 + Н2O — такая реакция протекает при избытке сернистой кислоты
Н2SO4 + 2NaOH → Na2SO3 + 2Н2O — а эта реакция протекает при избытке едкого натра
Сернистая кислота обладает отбеливающим действием. Всем известно, что подобным действием обладает и хлорная вода. Но отличие заключается в том, что в отличии от хлора сернистый газ не разрушает красители, а образует с ними неокрашенные химические соединения!
Кроме основных свойств кислот сернистая кислота способна обесцвечивать раствор марганцовки по следующему уравнению:
5Н2SO3+2KMnO4 → 2 Н2SO4 +2MnSO4+K2SO4+Н2O
В этой реакции образуется бледно-розовый раствор, состоящий из сульфатов калия, марганца.
Сернистая кислота способна обесцветить бром
Н2SO3 + Br2 + Н2O → Н2SO4 + 2HBr
В этой реакции образуется раствор, состоящий сразу из 2-х сильных кислот: серной и бромной.
Если хранить сернистую кислоту при доступе воздуха, то этот раствор окисляется и превращается в серную кислоту
2Н2
Цех серной кислоты
На закономерный вопрос, почему предприятия цветной металлургии вкладываются в открытие сернокислотного производства нужно искать ответ в структуре перерабатываемого сырья. Дело в том, что природные минералы, содержащие медь, содержат значительное количество серы, которая в процессе плавки преобразуется в сернистый газ и выбрасываются в атмосферу. И для того, чтобы исключить максимальный выброс этих вредных веществ в окружающую среду медеплавильные заводы вынуждены строить цеха серной кислоты, где в результате переработки отходящих газов металлургического процесса получается серная кислота.
И для того, чтобы исключить максимальный выброс этих вредных веществ в окружающую среду медеплавильные заводы вынуждены строить цеха серной кислоты, где в результате переработки отходящих газов металлургического процесса получается серная кислота.
Первая и вторая линии сернокислотного производства на Медногорском медно-серном комбинате были введены в эксплуатацию в начале 60-х годов прошлого столетия. Спустя 42 года, после вхождения ММСК в состав УГМК на главном экологическом подразделении предприятия начинается новый виток реконструкции сернокислотного производства, чтобы наращивать объемы выпуска черновой меди без ущерба для экологии. К возведению нового цеха приступили в июле 2004 года, а в июне 2007 года состоялся его запуск в работу. В результате произошло уменьшение в 17 раз выбросов загрязняющих веществ в атмосферу.
В обновленном цехе серной кислоты были применены новые технические решения в области автоматизации производства. Благодаря внедрению автоматизированной системы управления технологическим процессом – АСУТП – техпроцесс стал более прозрачным, а за счет стабильного поддержания режимов работы оборудование стало функционировать более эффективно. Проведенные технические мероприятия положительно сказались на охране труда и культуре производства. То, что прежде аппаратчики выполняли в ручном режиме, происходит дистанционно, без непосредственного участия человека. За основу работы второй технологической системы взята классическая, или стационарная, схема получения серной кислоты, в которой используется сернистый газ более высокой концентрации. Ее производительность – 100 тысяч кубометров газа в час.
Благодаря внедрению автоматизированной системы управления технологическим процессом – АСУТП – техпроцесс стал более прозрачным, а за счет стабильного поддержания режимов работы оборудование стало функционировать более эффективно. Проведенные технические мероприятия положительно сказались на охране труда и культуре производства. То, что прежде аппаратчики выполняли в ручном режиме, происходит дистанционно, без непосредственного участия человека. За основу работы второй технологической системы взята классическая, или стационарная, схема получения серной кислоты, в которой используется сернистый газ более высокой концентрации. Ее производительность – 100 тысяч кубометров газа в час.
В 2015 году на ММСК начинается техническое перевооружение первой технологической линии с увеличением объема переработки отходящих газов до 50 тыс. Замена нестационарного способа окисления диоксида серы на стационарный приведет к увеличению объемов утилизации отходящих газов металлургического производства, повышению степени контактирования, абсорбции и как следствие – уменьшению выбросов диоксида серы в атмосферный воздух. Сдача объекта состоялась в четвертом квартале 2017 года.
Сдача объекта состоялась в четвертом квартале 2017 года.
Участки и назначение:
- промывное отделение – для охлаждения газа и очистки его от вредных примесей;
- сушильное отделение – для осушки газа от влаги;
- компрессорное отделение – для транспортировки газа по газоходной системе цеха;
- контактное отделение – для окисления сернистого ангидрида в серный;
- абсорбционное отделение – для поглощения образовавшегося серного ангидрида;
- склад кислоты – для хранения и отгрузки готовой продукции;
- станция нейтрализации – для нейтрализации кислой воды;
- станция промывки цистерн – для промывки цистерн и подготовки их к освидетельствованию;
- участок очистки промстоков от мышьяка – для очистки промывных кислот от вредных примесей.
Серная кислота используется в различных отраслях химической промышленности, где из нее делают удобрения для сельского хозяйства, а также полимеры. Производимая на ММСК серная кислота направляется на предприятия Новотроицка, Гая, Казахстана.
Производимая на ММСК серная кислота направляется на предприятия Новотроицка, Гая, Казахстана.
С первого августа цех переработки пыли вошел в состав цеха серной кислоты на правах участка. Назначение участка переработки пыли ЦСК в технологической цепочке химико-металлургического производства — переработка пыли медеплавильного производства с получением раствора цинка сернокислого. Гидроотделение ЦПП стало первым объектом, где в 2010 году было проведено техническое перевооружение. Доля ручного труда в техпроцессе снизилась до десяти процентов. Новое, более мощное оборудование позволило увеличить объем выпуска цинка сернокислого в растворе более чем в два раза. В 2011-ом гидроотделение стало экспериментальной площадкой, где проводились опытно-промышленные испытания по производству альтернативного связующего для брикетной фабрики – сульфата алюминия. В 2012 году произведено разделение технологических ниток по производству цинка сернокислого и сульфата алюминия, построено новое шихтовочное отделение и налажено промышленное производство собственного связующего.
К цинксодержащему сырью относятся:
- пыль медеплавильного производства;
- отходы ООО «Оренбургский радиатор»;
- свинцовый концентрат ОАО «СУМЗ».
Технология переработки цинксодержащего сырья с получением цинка сернокислого (водный раствор) разработана на основании результатов научно-исследовательских работ и опытно-промышленных испытаний, проведённых в исследовательском центре ОАО «Уралэлектромедь» и ООО «Медногорский медно-серный комбинат». Проектная мощность гидрометаллургического отделения по переработке пыли медеплавильного производства составляет 50 тонн в сутки.
Технологический процесс получения цинка сернокислого состоит из следующих стадий:
- приготовление пульпы из цинксодержащего сырья;
- выщелачивание цинксодержащего сырья в составе пульпы раствором серной кислоты;
- фильтрация кислой пульпы;
- очистка цинксодержащих растворов от примесей;
- фильтрация нейтральной пульпы;
- выпаривание цинксодержащих растворов.

Производимая продукция – цинк сернокислый (водный раствор) соответствует техническим условиям ТУ 2141-003-41848759-2008, предназначен для использования в качестве реагента-депрессора при флотации медно-цинковых руд и других технических целей. Химическая формула – ZnSO4. Цинк сернокислый использует Гайский ГОК для обогащения цинковых концентратов. Кек с медью возвращается на брикетную фабрику, где его добавляют в состав брикета
Регенерация отработанной серной кислоты — Нефтехимия и газохимия
Серная кислота — важнейший продукт химической промышленности по объему производства и по разнообразию областей применения.
Серная кислота — важнейший продукт химической промышленности по объему производства и по разнообразию областей применения.
Крупными потребителями серной кислоты являются химическая и нефтехимическая промышленность, металлургия, машиностроение, сельское хозяйство и другие отрасли промышленности.
Ежегодно порядка 10% от общего ее производства становится отработанной серной кислотой.
Необходимо утилизировать сотни тысяч т отработанной кислоты с целью экономного ресурсопользования и защиты окружающей среды.
Отходы, образующиеся при использовании серной кислоты, включают кроме отработанной серной кислоты травильные растворы, кислые гудроны и сточные воды, содержащие кислоту менее 10 % (по массе).
В России насчитывается более 200 видов отработанной серной кислоты, содержащих около ста видов примесей, в том числе аккумуляторная кислота из отработанных свинцовых аккумуляторов.
Обезвреживание и утилизацию отработанной серной кислоты производят следующими способами:
— нейтрализацией растворов или их огневым обезвреживанием без использования образующихся продуктов;
-использованием (возможно после предварительного упаривания) загрязненных растворов в других технологических процессах;
— регенерацией отходов с получением товарной серной кислоты.
Сточные воды с низкой концентрацией серной кислоты обычно нейтрализуют щелочами.
При содержании в сточных водах примесей нейтрализацию совмещают с огневым методом. Метод нейтрализации применяют при небольших количествах отходов и отсутствии в них органических примесей.
Непосредственное использование отходов кислоты в других процессах ограничено из-за наличия в них примесей.
Отработанную кислоту применяют после очистки и концентрирования в производстве сульфатных минеральных удобрений.
Основная масса отработанной серной кислоты и кислых гудронов подвергается регенерации.
Кислые гудроны — это высоковязкие смолообразные жидкости, содержащие серную кислоту и большое количество органических веществ. Содержание кислоты в них составляет 24-89 %.
В зависимости от состава отработанной кислоты применяют различные методы регенерации: термическое расщепление, экстрагирование органических примесей, адсорбцию, каталитическое окисление пероксидом водорода, коагулирование, выпаривание и тд.
Для концентрирования серной кислоты применяются 2 типа установок:
— с внешним обогревом;
— с непосредственным соприкосновением греющих газов с кислотой.
Установки внешнего обогрева — котлы, так называемые реторты, установки типа Бюшинга, Паулинга, Фришера, Майснера.
В них происходит обогрев кислоты через стенку в аппаратах колонного типа, установки вакуум- аппаратов и установки Дюпон пленочного типа.
Установки с непосредственным соприкосновением горячих газов с кислотой — установки Кесслера, аппараты типа Хемико, работающие в режиме барботирования газов через слой серной кислоты, аппараты Вентури трубного типа.
Суть процесса концентрирования в таких аппаратах заключается в дроблении кислоты на капли благодаря потоку горячего газа.
Оба вида технологий получения концентрированной серной кислоты имеют как положительные, так и отрицательные стороны.
Большим преимуществом установок с внешним обогревом является отсутствие или минимальное количество тумана серной кислоты, образующейся в результате работы концентраторов второго типа, а также получения серной кислоты с крепостью до 98%.
Из-за исключения необходимости очистки выхлопных газов от кислотного тумана дорогостоящих электрофильтрами, можно удешевить техпроцесс .
Но при концентрировании серной кислоты, например, в ретортах до 96% крепости и выше, происходит их быстрое изнашивание из-за высокой температуры кипения серной кислоты, которая достигает 300°С.
При высоких температурах увеличивается испарение и разложение серной кислоты, что ведет к потере количества и качества серной кислоты.
Эти недостатки устранены в установках Майснера, где концентрирование происходит под вакуумом.
Установки Майснера более компактны по сравнению с ретортными установками Паулинга.
Установки с колоннами Майснера занимают менее 40% площади, требующейся для установки реторт Паулинга.
Недостаток установки Майснера:
— малая производительность (выход составляет до 13-15 т/сут).
— растрескивание ферросилидовых царг, проявляющееся в процессе эксплуатации данной установки, а также нарушение уплотнения между царгами.
— необходимость строительства котельных для выработки водяного пара, применяемого в колоннах.
Установки Майснера могутт быть применены только в случаях необходимости концентрирования небольших количеств серной кислоты и для получения при этом серной кислоты высокой концентрации (до 98%).
Установки Дюпон решают проблема растрескивания ферросилидовых материалов и проблему появления неплотностей, путем применения нагревательных труб и метода стекающей пленки.
В установках Дюпон применено новое техническое решение в виде монтажа оборудования с учетом механических и термических напряжений ферросилида, на катках или на пружинных подвесках.
Преимущества: простота устройства, исполнения и обслуживания. Установки по производительности относятся к числу средних, достигая до 25 т/сутки.
Недостатки установок Дюпон:
— загрязнение внутренних поверхностей труб с течением времени, что приводит к снижению их теплопропускной способности,
— необходимость их периодической прочистки и промывки труб с применением большого количества воды.
В России сначала популярными были установки Дюпон, в связи ростом потребности в серной кислоте, более популярными стали установками 2го типа — с непосредственным соприкосновением греющих газов с кислотой.
Преимущества установок Кесслера:
— значительно облегчена передача тепла от топочных газов к серной кислоте,
— концентрируемая кислота не доводится до точки кипения, а большая, открытая поверхность контакта газа и кислоты максимизирует интенсивность процесса массопередачи и теплопередачи,
— возможность работать на любом местном виде топлива: газообразном, жидком, твердом, что значительно увеличивает сырьевые возможности безостановочного перехода с одного вида топлива в случае необходимости на другой.
Недостатки установок Кесслера:
— необходимость периодической чистки рекуператора с выгрузкой насадки,
— большая потеря СК с отходными газами, что составляет порядка 2-2,5%.
Эти установки имеют — 20 т/сутки.
Более перспективны концентраторы барабанного типа.
Преимущества:
— концентрирование производится путем барботажа горячих газов через упариваемую кислоту, как в слое кислоты, так и в зоне брызг, где на поверхности капель происходит хорошая теплопередача.
-лучшее использование тепла и переработка большого количества кислоты.
До настоящего времени они считались наиболее удобными, экономичными и практичными для концентрирования серной кислоты.
Работают на мазуте и газе.
Недостатки:
— необходимость в поддержании строгого температурного режима топочных газов, так как увеличение его даже на 10 °С довольно быстро разрушает барботажные трубы 1й камеры концентратора и увеличивают потери кислоты из-за ее термического разложения, которые составляют 10-15% от общего количества.
— образование паров и туманов СК, улов которых требует применение громоздких и дорогостоящих сооружений — электрофильтров, причем сами электрофильтры тоже имеют недостатки — они осуществляют неполный улов сернистых газов и окислов азота, которые выбрасываются в атмосферу; стоимость же их весьма велика и составляет до 30% затрат на всю установку.
Скоростные концентраторы, в которых потоком горячего газа жидкость преимущественно разбивается на мельчайшие капли. Для создания такого процесса концентрирования серной кислоты в капельном состоянии используют аппараты Вентури.
В России наибольшее распространение получила регенерация серной кислоты огневым методом, при котором происходит высокотемпературное расщепление кислоты.
Метод универсален и высокоэффективен.
При огневом методе используется концентрированная серная кислота, поэтому при необходимости предварительно проводят упаривание отработанной кислоты до необходимой концентрации.
Процесс термического расщепления кислоты и окисление органических. примесей проводят при 950-1200 °С, для чего в огневом реакторе сжигают топливо (рис 1).
Рис. 1. Схема установки для регенерации серной кислоты методом термического расщепления (В — воздух; Т- топливо)
Сернокислотные растворы с помощью форсунок распыляют в потоке продуктов сгорания топлива в огневом реакторе 1.
Туда же с помощью воздуходувки 2 подается воздух, предварительно пропущенный через воздухоподогреватель 4.
Органические примеси при этом окисляются с образованием С02 и Н20, а серная кислота расщепляется с образованием SО2
Сернистый газ из огневого реактора поступает в котел-утилизатор 5, а из него — в систему очистки 6, где очищается от пыли, сернокислотного тумана и подвергается осушке, после чего с помощью газодувки 7 подается в узел получения кислоты 8.
Насыщенный пар из котла — утилизатора 5 подается на пароперегреватель 3, а оттуда — потребителям.
Очищенные дымовые газы с помощью дымососа 9 выбрасываются в атмосферу через дымовую трубу 10.
Огневая регенерация серной кислоты из отходов позволяет одновременно с их обезвреживанием получать товарную продукцию высокого качества.
Это приводит к сокращению расходов природного сырья и снижению затрат на производство серной кислоты на 25-30 % по сравнению с ее производством из первичного сырья (элементарной серы).
Для рентабельной регенерации серной кислоты из рассматриваемых отходов необходимо их предварительное обезвоживание (концентрирование).
В связи с отсутствием в отходах летучих веществ концентрирование можно осуществить методом упаривания в контактных теплообменниках за счет теплоты отходящего из огневого реактора сернистого газа.
При этом одновременно происходит закалка газа.
Содержание воды в упаренном растворе зависит от температуры отходящих из огневого реактора газов и от содержания воды в исходном растворе.
Если в исходном растворе имеется 60-70 % воды, то после упаривания его отходящими газами с температурой 950-1000 °С содержание воды снижается до 35- 40 %.
При огневой переработке таких растворов концентрация S02 в сухом сернистом газе — не менее 7 %.
Сильно разбавленные растворы, содержащие более 80 % воды, после упаривания содержат ее не более 60 %. При огневой переработке таких растворов с целью получения сернистого газа с содержанием 802 не менее 6 % в качестве топлива используют серу или сероводород, а также обогащают кислородом дутьевой воздух.
Для более полного превращения S03 в S02 в огневом реакторе целесообразно 2-ступенчатое сжигание топлива.
В 1й ступени термическое расщепление серной кислоты и сульфатов осуществляется в восстановительной газовой среде (в продуктах неполного горения топлива), а во 2й ступени происходит дожигание продуктов неполного горения за счет подачи вторичного воздуха.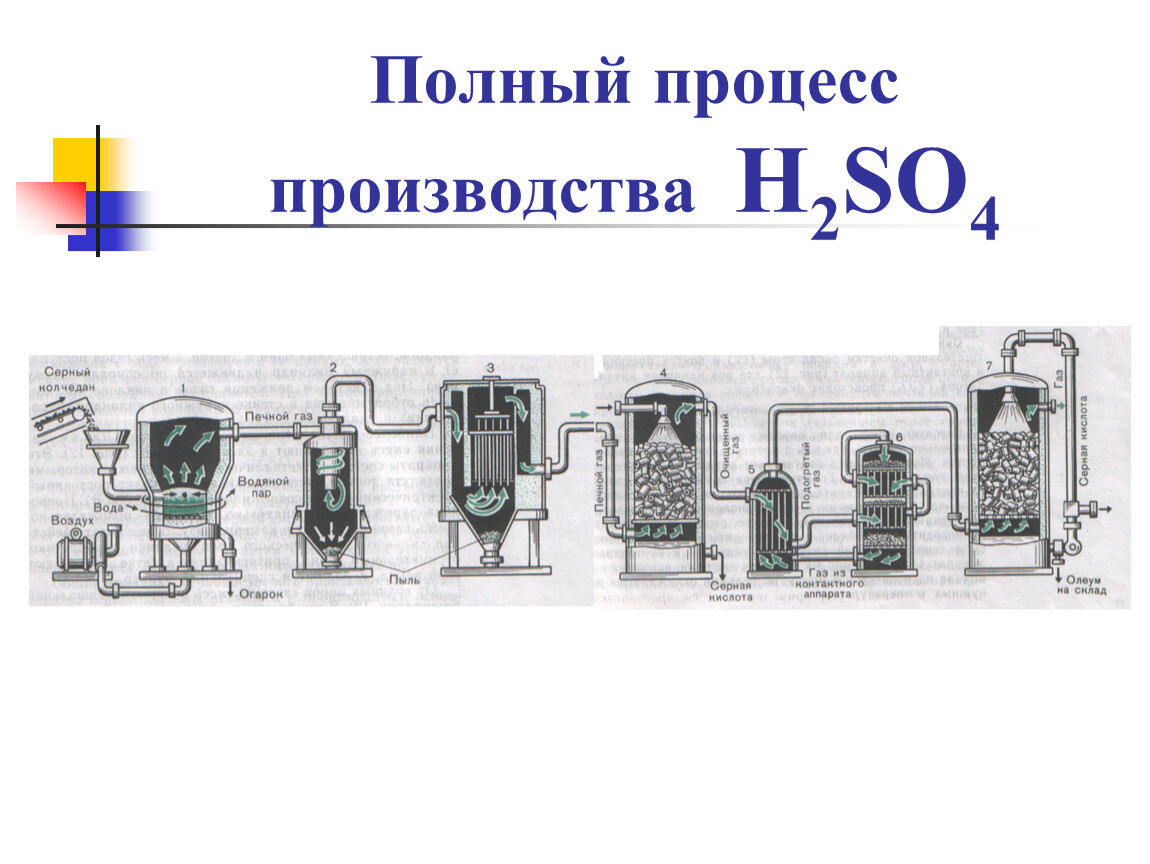
При огневой утилизации отработанных травильных растворов и гидролизной серной кислоты получают побочный продукт — порошкообразный оксид железа.
Если травильные растворы не загрязнены различными примесями, получаемый оксид железа применяется в производстве красителей, активных катодных масс, ферритных порошков, полирующих паст и т д.
Загрязненный оксид железа используется как металлургическое сырье.
В процессе регенерации травильных сернокислотных растворов образуется сульфат железа, который можно использовать непосредственно без дополнительной обработки как ядохимикат, а также для мелиорации почв и очистки сточных вод. Этот продукт может использоваться после соответствующей переработки как сырье для получения серы и оксида железа.
Существуют методы переработки сульфата железа в сернистый газ (а следовательно, в серную кислоту).
Разработана технология получения серной кислоты путем одновременного сжигания сульфата железа и серы в реакторе с кипящим слоем.
Процесс проводят при температуре 900-1000 °С. Образующиеся в процессе сжигания пульпы, состоящей из сульфата железа и серы, продукты сгорания (сернистый газ и вода) подвергаются очистке от пыли, охлаждаются до 290-300 °С и направляются на получение серной кислоты по классической схеме.
Высокопроизводительные центробежные воздуходувки заменяют компрессоры при производстве серной кислоты
Центробежные воздуходувки компании Piller Blowers & Compressors занимают лидирующую позицию с точки зрения повышения давления.
По конструкции они представляют собой центробежные вентиляторы, а по производительности сравнимы с одноступенчатыми центробежными турбокомпрессорами.
Более широкий рабочий диапазон, простота технического обслуживания, а также высокая эксплуатационная надежность являются отличительными особенностями воздуходувок по сравнению с турбокомпрессорами.
Они предназначены для многих процессов, в которых ранее традиционно использовались турбокомпрессоры, например, в технологии промышленного производства серной кислоты.
В настоящее время для промышленного производства серной кислоты h3SO4 чаще всего используют метод двойного контактирования. Первоначальным этапом производства является получение диоксида серы SO2, образующегося в процессе сжигания серы. Затем следует каталитическое окисление SO2 в SO3., и далее, в ходе последующих стадий технологического процесса результатом является конечный продукт — серная кислота.
Нагнетатель применяется на начальном этапе производства – в ходе получения диоксида серы SO2. Для обеспечения процесса горения жидкой серы необходим воздух, который предварительно осушается в сушильной башне при помощи концентрированной 93-98% серной кислоты.
Подготовленный осушенный воздух со следами серной кислоты с помощью нагнетателя подается в камеру сгорания. При этом необходимое повышение давления, создаваемое нагнетателем, в большинстве случаев превышает 50 кПа.
Такое использование в производстве серной кислоты является серьезным испытанием для каждого нагнетателя и требует высокого уровня знаний и опыта.
Обладая достаточным опытом и компетентностью, а также учитывая особенности технологии, были специально разработаны воздуходувки для производства серной кислоты. Это позволило предлагать заказчикам оптимальные решения в полном соответствии с техническими требованиями.
Специально разработанные воздуходувки с учетом их конструкции обладают значительными преимуществами перед компрессорами.
До настоящего времени при промышленном производстве серной кислоты традиционно использовались одноступенчатые турбокомпрессоры. Применение специально разработанных центробежных воздуходувок на одном из сернокислотных производств в Чехии показало, что они в любой момент могут взять на себя функции компрессоров, особенно, если речь идет о повышении давления и, кроме того, они обладают рядом дополнительных преимуществ.
Замена турбокомпрессора воздуходувкой в производстве серной кислоты
Ранее, в составе действующей на предприятии установке по производству серной кислоты использовались два турбокомпрессора. Один из них, выполняющий функцию резервного, представлял собой более устаревшую модель, что вызвало трудности при приобретении запчастей.
Один из них, выполняющий функцию резервного, представлял собой более устаревшую модель, что вызвало трудности при приобретении запчастей.
Эксплуатация второго, рабочего турбокомпрессора была проблематичной в связи с постоянно возникающими вибрациями, вызываемыми образованием отложений на рабочем колесе, что не обеспечивало эксплуатационной надежности.
Приобретение нового компрессора требовало больших инвестиций при длительном сроке изготовления.
Направляя запросы в адреса различных производителей оборудования, внимание заказчика привлекли высокопроизводительные воздуходувки, обеспечивающие высокое повышение давления, изготавливаемые в г.Моринген. Заказчиком было принято решение заменить устаревшую модель резервного компрессора новой, специально разработанной высокопроизводительной воздуходувкой, используя ее в качестве рабочей.
«Производителям серной кислоты, эксплуатирующим подобные установки, часто известны только компрессоры. Возможность использовать вместо них высокопроизводительные воздуходувки не рассматривается, так как многие заказчики считают, что воздуходувки не в состоянии обеспечить требуемое повышение давления», — высказал свое мнение руководитель по глобальным продажам.
Для успешной замены устаревшего компрессора к новому оборудованию, помимо других требований, особое внимание уделялось вопросу эксплуатационной надежности и сокращению времени простоя.
Причиной частого автоматического отключения турбокомпрессоров являлось сильное повышение вибраций. Проведенные заказчиком обследования показали, что вибрации были вызваны наличием отложений на рабочем колесе. Рост вибраций значительно усиливает нагрузку на подшипники приводов, что при определенных обстоятельствах может привести к выходу машины из строя.
Решение
Запатентованная подшипниковая опора с масляным амортизатором. Разработанная запатентованная система подшипников — масляный амортизатор — за счет своей технологии имеет большой, свободный от резонанса, рабочий диапазон и позволяет работать с определенным дисбалансом, имеющим место, например, при отложениях примесей. Система подшипников с масляным амортизатором обеспечивает легкий монтаж, абсолютно надежна и требует значительно меньших затрат на техническое обслуживание, чем система подшипников традиционных компрессоров.
Система впрыска воды
Высокопроизводительные воздуходувки могут быть дополнительно оснащены системой впрыска воды на стороне всаса, что позволяет избежать образования отложений на рабочем колесе. Эту возможность обычно используют в тех случаях, если производственный процесс протекает в условиях высокой влажности и перемещаемая среда содержит твердые примеси.
Учитывая особенности технологии производства серной кислоты, основанной на сжигании жидкой серы с подачей осушенного технологического воздуха, применение системы впрыска воды возможно для очистки рабочего колеса только в период проведения техобслуживания. В данном случае система впрыска воды облегчает проведение регламентных работ, сокращая ручной труд.
Воздуходувка, основанная на модульной конструкции.
В дополнение к перечисленным требованиям, замену компрессора необходимо было произвести в сильно сжатые сроки. Монтаж новой высокопроизводительной воздуходувки был реализован точно в срок, благодаря ее модульной конструкции, в которой используются стандартные компоненты, учитывающие при этом специфицированные технические требования заказчика. Данный концепт обеспечивает сокращение сроков поставки по сравнению с компрессорами и позволяет монтировать высокопроизводительные воздуходувки по принципцу «Plug and Play» (подключай и работай).
Данный концепт обеспечивает сокращение сроков поставки по сравнению с компрессорами и позволяет монтировать высокопроизводительные воздуходувки по принципцу «Plug and Play» (подключай и работай).
Эксплуатационная готовность машины (простота технического обслуживания)
«Выбирая воздуходувку PILLER, мы также учитывали затраты на ее техобслуживание», — говорит механик установки.
Конструкция специфицированных высокопроизводительных воздуходувок предлагает также ряд других решающих преимуществ, связанных с простотой техобслуживания и ремонта. Дополнительным плюсом является удобный доступ к отдельным компонентам. Так замена уплотнительных колец системы уплотнения вала может быть выполнена без демонтажа рабочего колеса. За счет использования двойного переключаемого масляного фильтра замена фильтровальных элементов проводиться во время работы, без останова воздуходувки. В случае, если при длительной эксплуатации все же появились признаки износа, то во время планового техобслуживания можно выполнить добалансировку рабочего колеса, а при необходимости, провести ремонт рабочего колеса или корпуса на месте с использованием сварки. Это значительно сокращает время простоя воздуходувок во время техобслуживания и повышает их эксплуатационную готовность. Решающую роль в итоге играют временные и затратные факторы, так как при покупке нового технологического оборудования рассмотрение вопросов выходит далеко за рамки чисто инвестиционных затрат. Техническое обслуживание, как фактор добавленной стоимости, приобретает все большее значение при принятии решений.
Это значительно сокращает время простоя воздуходувок во время техобслуживания и повышает их эксплуатационную готовность. Решающую роль в итоге играют временные и затратные факторы, так как при покупке нового технологического оборудования рассмотрение вопросов выходит далеко за рамки чисто инвестиционных затрат. Техническое обслуживание, как фактор добавленной стоимости, приобретает все большее значение при принятии решений.
Правильный расчет параметров повышает энергоэффективность
Применение заведомо больших параметров приводит к неоправданной трате энергии. Часто настоящими поглотителями энергии выступают воздуходувные или компрессорные системы слишком большого размера. В данном случае у PILLER совсем другой подход: здесь каждая воздуходувка проектируется в точном соответствии с заданными условиями эксплуатации. Значительная экономия энергии энергоэффективность может быть достигнута только при точном расчете оптимальных параметров воздуходувной системы. Поскольку эффективность нагнетателя напрямую зависит от рассчитанного оптимального положения рабочей точки и сильно варьируется с учетом конструктивных особенностей различных типов предлагаемого на рынке оборудования, следует учитывать данные критерии уже на этапе выбора оборудования.
«Наши высокопроизводительные воздуходувки способны заменить компрессоры не только в производстве серной кислоты. Мы получаем все больше заказов от предприятий других отраслей с различными технологическими процессами. Там, где раньше использовались компрессоры, сегодня работают воздуходувки, демонстрируя свои преимущества», — рассказал руководитель руководитель по глобальным продажам. В любом случае, проводить сравнительную оценку высокопроизводительных воздуходувок и компрессоров всегда полезно!
Серная кислота производство — Справочник химика 21
Хранение и разливка серной кислоты. Производство серной кислоты является непрерывным, поэтому готовая продукция — кислота поступает на хранение также непрерывно. Отгрузка же серной кислоты производится периодически, в связи с чем на каждом сернокислотном заводе имеется склад готовой продукции. [c.32] Такие важнейшие производственные процессы в области химической технологии, как синтез и окисление аммиака, контактное получение серной кислоты, производство этанола из природного газа, крекинг нефти, получение чугуна в доменных печах, производство алюминия и многие другие всецело основаны на результатах физико-химического исследования реакций, лежащих в основе этих процессов.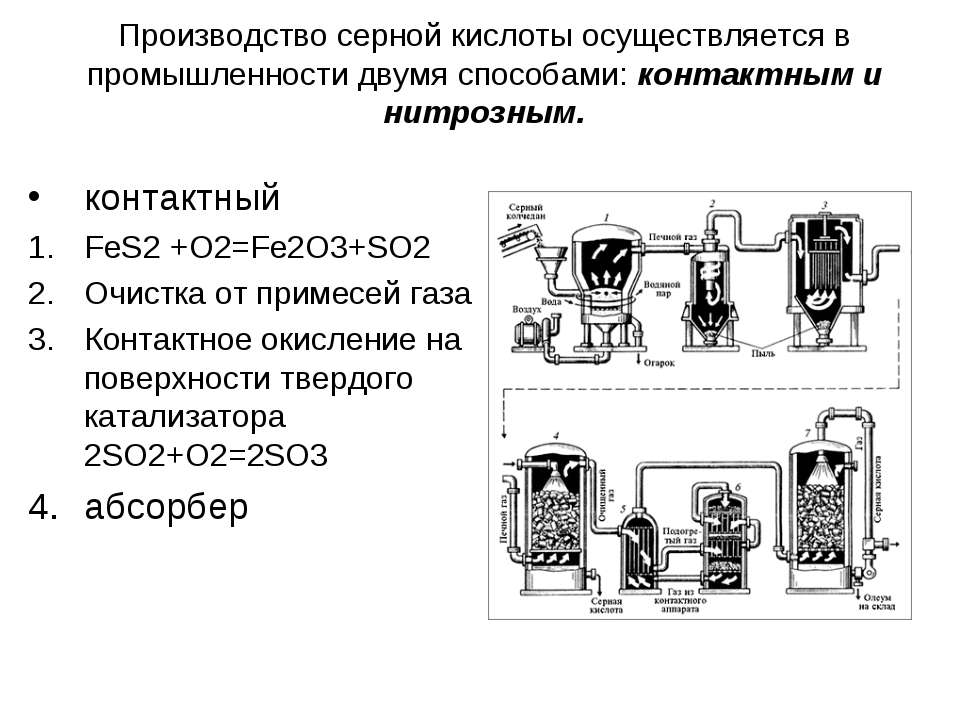 [c.6]
[c.6]
Помимо хлора и серной кислоты, производство широкого ассортимента красителей требовало и других разнообразных химикатов, в особенности дешевой соды. Старый леблановский способ получения соды был единственным способом, применявшимся в производстве до 1870 г. В 1863 г. бельгийский химик Э. Сольвей (1838—1922) на основе открытой еще в 1811 г. (физиком и химиком О. Ж- Френелем) реакции хлорида натрия с гидрокарбонатом аммония разработал аммиачный способ производства соды, оказавшийся более дешевым и дающим более чистый продукт. Промышленное производство соды по этому методу началось в 1873 г. Каустическая сода (едкий натр) также стала производиться по новому методу — электролизом хлорида натрия. Получавшийся при этом хлор частично использовался для производства соляной кислоты. [c.268]
Общая характеристика элементов главной подгруппы VI группы периодической системы. Сера. Сероводород, сулы )иды. Оксиды серы (IV) и (VI), получение, свойства. Сернистая и серная кислоты, их свойства. Соли сернистой и серной кислот. Производство серной кислоты. [c.503]
Оксиды серы (IV) и (VI), получение, свойства. Сернистая и серная кислоты, их свойства. Соли сернистой и серной кислот. Производство серной кислоты. [c.503]
Установлена возможность использования смесей моно- и дисульфокислот фенольных соединений, полученных сульфированием кубового остатка производства дифенилолпропана отработанной серной кислотой производства хлорамина-Б, в качестве сырья и полупродуктов для синтеза некоторых видов фенолоформальдегидных смол. [c.22]
Новые нефтехимические производства также являются крупными потребителями серной кислоты (производство спиртов), олеума или серного ангидрида (производство синтетических моюш,их веш еств, например сульфо-нолов). [c.536]
Так как гомологи этилена в общем лучше и полнее абсорбируются серной кислотой, производство, например, изопропилового спирта легче, чем синтез этанола. Кстати, первое промышленное получение изопропилового спирта было налажено в США [c. 264]
264]
Органические вещества, содержащиеся в отработанной серной кислоте производств бромэтила, метилметакрилата оказывают ингибирующее действие. [c.14]
При переработке книги авторы стремились не только осветить вопросы внедрения новой техники, методы интенсификации существующих и создания новых производств, но и, по возможности, показать перспективы дальнейшего развития основной химической промышленности на ближайшие годы. Наиболее существенно переработаны главы, посвященные технологии серы и серной кислоты, производству газов (азота, водорода, кислорода), технологии связанного азота, производству электролитического хлора и щелочей, переработке хлора, производству минеральных удобрений. Некоторые из этих разделов книги заново написаны или переработаны специалистами, дополнительно привлеченными в состав авторского коллектива. [c.9]
Максимальная утилизация производственных отходов с получением ценных продуктов, сводящая к минимуму образование сточных вод.
 Примером утилизации отходов является использование отработанной серной кислоты производства капролактама, содержащей органические примеси, для получения сульфата аммония натрия. До организации производства сульфата аммо- [c.258]
Примером утилизации отходов является использование отработанной серной кислоты производства капролактама, содержащей органические примеси, для получения сульфата аммония натрия. До организации производства сульфата аммо- [c.258]В этом случае использование кинофрагмента служит основой для более глубокого понимания сущности процессов и способствует уяснению вопросов промышленной переработки каменного угля. Кинофрагмент используют как источник новых знаний без предварительного изучения содержащихся в нем сведений на уроках, с последующим анализом и развитием полученных знаний. С таким назначением могут быть использованы фильмы Фтор и его соединения , Строение и свойства кристаллов , Стекло и цемент , Коррозия металлов (раздельно первая и вторая части), Применение кислорода в производстве стали телепередачи-экскурсии Водоочистительная станция , Производство серной кислоты , Производство алюминия и др. [c.143]
Несмотря на существенные преимущества контактного метода, башенная кислота сохраняет еще свое значение для производств, не требующих концентрированной и чистой серной кислоты (производство минеральных удобрений и др. ). В случае необходимости башенную кислоту концентрируют путем упаривания. [c.64]
). В случае необходимости башенную кислоту концентрируют путем упаривания. [c.64]
В качестве сульфирующего агента для синтеза сульфокислот предложено использовать отработанную серную кислоту производства хлорамина-Б, расположенного на одном с производством дифенилолропана предприятии (ОАО Уфахимпром ). Отработанная серная кислота содержит не менее 65% серной кислоты, до 12% бензол сульфокислоты и до 0,1% хлористого водорода, является крупнотоннажным промышленным отходом производства, который, по действующей технологии, после нейтрализации едким натром сбрасывается на биоочистные сооружения. [c.17]
Серная кислота производства диоксида титана, [c.95]
Проведенные исследования позволяют решить ряд практических вопросов. Так, использование НСО позволяет выделить h3 I OOH из отработанной серной кислоты производства молох лор уксусной кислоты. [c.51]
MOHO- и дисульфокислот фенольных соединений из кубового остатка производства дифенилолпропана и отработанной серной кислоты производства хло-рамина-Б.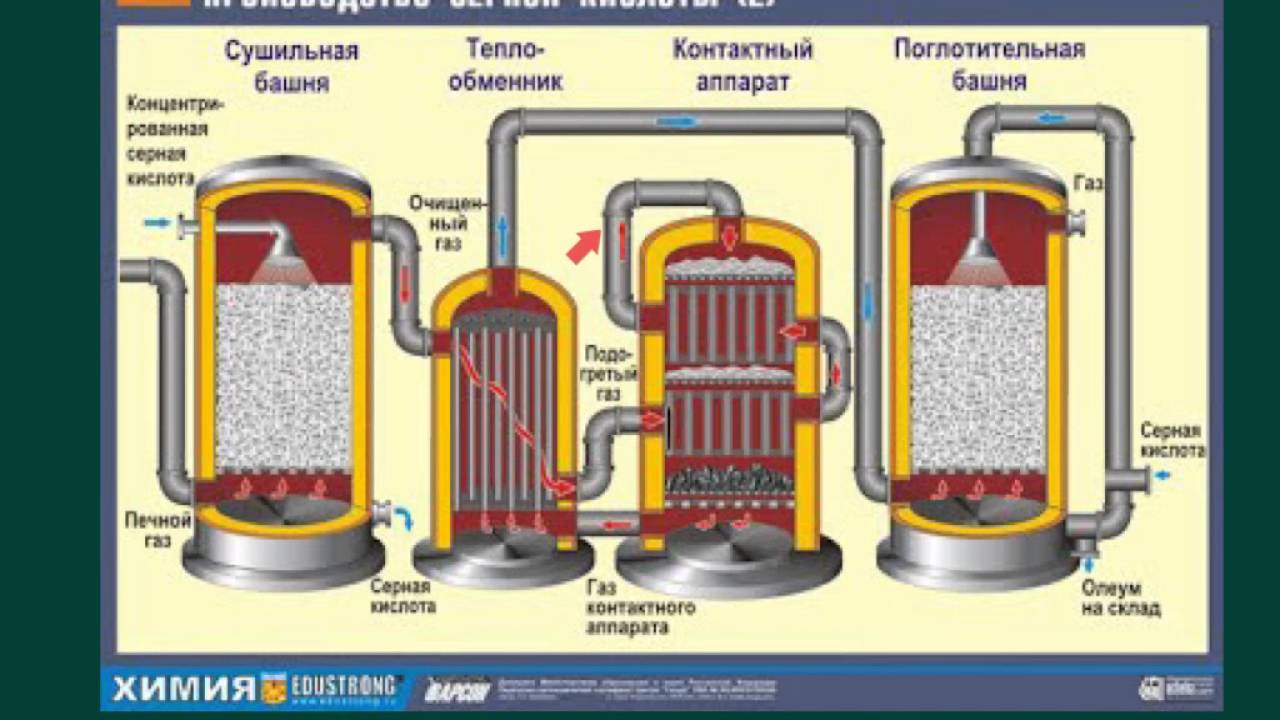 Разработанная технологическая схема сульфирования кубовых остатков производства дифенилолпропана отработанной серной кислотой производства хлорамина-Б (рис 4.3) была апробирована на опытнопромышленной установке на ОАО Уфахимпром . Сульфирование кубового остатка производства дифенилолпропана осуш,ествлялось в реакторе с мешалкой Р1, в который через мерники М1 и М2 загружалось необходимое сырье. Процесс сульфирования протекал в условиях, приведенных в табл. 4.1., при интенсивном перемешивания реакционной массы, которое обеспечивалось циркуляционным насосом Н1. Хлористый водород, выделяюш,ийся из отработанной серной кислоты в составе паров воды, нейтрализовывался в щелочной ловушке Л1 раствором гидроксида натрия. Партия смесей дисульфокислот, наработанная на этой установке успешно прошла опытно-промышленные испытания на ЗАО ТЗП в качестве заменителя дорогостоящей бензол-сульфокислоты при получении химически стойкой замазки Арзамит-5 . [c.20]
Разработанная технологическая схема сульфирования кубовых остатков производства дифенилолпропана отработанной серной кислотой производства хлорамина-Б (рис 4.3) была апробирована на опытнопромышленной установке на ОАО Уфахимпром . Сульфирование кубового остатка производства дифенилолпропана осуш,ествлялось в реакторе с мешалкой Р1, в который через мерники М1 и М2 загружалось необходимое сырье. Процесс сульфирования протекал в условиях, приведенных в табл. 4.1., при интенсивном перемешивания реакционной массы, которое обеспечивалось циркуляционным насосом Н1. Хлористый водород, выделяюш,ийся из отработанной серной кислоты в составе паров воды, нейтрализовывался в щелочной ловушке Л1 раствором гидроксида натрия. Партия смесей дисульфокислот, наработанная на этой установке успешно прошла опытно-промышленные испытания на ЗАО ТЗП в качестве заменителя дорогостоящей бензол-сульфокислоты при получении химически стойкой замазки Арзамит-5 . [c.20]
Впервые установлено, что сульфированный кубовый остаток производства дифенилолпропана может использоваться в качестве отвердителя фено-лоформальдегидных смол и сырья для синтеза водорастворимых полимеров. Разработаны основы технологии сульфирования кубового остатка производства дифенилолпропана отработанной серной кислотой производства хлорами-на-Б. [c.4]
Разработаны основы технологии сульфирования кубового остатка производства дифенилолпропана отработанной серной кислотой производства хлорами-на-Б. [c.4]
Фотоэлектрический колориметр АФК-3 предназначен для раздельного определения окислов азота (N0 и NOg) в выхлопных газах башенного производства серной кислоты, производства азотной кислоты, а также в других газовых смесях, если концентрация окислов азота не превышает 1 %. [c.475]
Для ОАО Уфахимпром разработаны и утверждены регламенты на получение опытно-промышленных партий смесей моно- и дисульфокислот на основе кубового остатка производства дифенилолпропана и отработанной серной кислоты производства хлорамина-Б. [c.5]
Существует много методов получения сульфата аммония из различного сырья, однако в азотной промышленности его производят только из аммиака и серной кислоты. Производство осуществляется по двум основным способам— мокрому и сухому . Химизм процесса в обоих способах одинаков, основное различие заключается в приемах осуществления реакции между аммиаком и кислотой. [c.142]
[c.142]
Серная кислота производства диоксида титана, титана диоксид, титана (III) оксид, [c.95]
Производители. уксусного эфира сами получают 80%-ную уксусную кислоту и продажного технического уксуаюкислого кальция и дешевой 60°-ной серной кислоты, производство которой описано 8 V отделе. Полученную таким образом [c.144]
Для травления металлов используют отработанную серную кислоту производства каустической соды, жидкого хлора, хлорофоса и бромэтила. Кислоты алкилирования поступают на производство контакта Петрова (нчк). Отработанная серная кислота производства спиртов, красителей и нитропродуктов после очистки от примесей концентрируется. и возвращается в основное производство. [c.59]
При общем абсолютном увеличении объема переработки каждого из видов серосодержащего сырья в серную кислоту, производство которой будет непрерывно возрастать, относительную долю серного колчедана, используемого для этих целей, в дальнейшем намечается постепенно сокращать (рис.
 2-1). [c.45]
2-1). [c.45]Описание гароязводства камерной серной кислоты Производство серной кислоты камерным способом сла- [c.163]
Смесь отработанной серной кислоты производства эфиров метакриловой акриловой кислот с купоросным масло м— от желтого до темно-коричневого цвета. Содержит бисульфат аммония. [c.95]
Теплоэнергетика и коммунальные котельные 6 Производство черных и цветных металлов Производство серной кислоты Производство содопродук-тов и хлора Производство фосфорнойкис-лоты и удобрений [c.31]
В 1969 г. на суперфосфатных заводах было использовано 400 тыс. т отработанной серной кислоты производства синтетического спирта, нитробензола, днфенилолпропана, красителей, бензосульфохлорида, ДДТ,. хлорофоса,. метиленхлорида, сульфоугля. [c.58]
В производстве сульфата аммония в 1969 г. использовано около 200 тыс. т отработанной серной кислоты коксохимических и химических предприятий. В коксохимической промышленности в основном используется отработанная серная кислота производства бензола, метилового эфира метакриловой кислоты, каустика, жидкого хлора. [c.59]
В коксохимической промышленности в основном используется отработанная серная кислота производства бензола, метилового эфира метакриловой кислоты, каустика, жидкого хлора. [c.59]
Учебник общей химии (1981) — [ c.228 , c.233 ]
Неорганическая химия (1981) — [ c.0 ]
Курс неорганической химии (1963) — [ c.759 ]
Неорганическая химия (1950) — [ c.149 ]
Общая химическая технология неорганических веществ 1964 (1964) — [ c.0 ]
Общая химическая технология неорганических веществ 1965 (1965) — [ c.0 ]
Неорганическая химия (1981) — [ c.0 ]
Технология минеральных удобрений и кислот (1971) — [
c. 0
]
0
]
Общая химия (1974) — [ c.246 ]
Утилизация и ликвидация отходов в технологии неорганических веществ (1984) — [ c.0 ]
Курс технологии минеральных веществ Издание 2 (1950) — [ c.0 ]
Справочник сернокислотчика Издание 2 1971 (1971) — [ c.0 ]
Общая химическая технология (1977) — [ c.0 ]
Технология серной кислоты (1985) — [ c.0 ]
Основы химической технологии (1986) — [ c.0 ]
Основы общей химии Т 1 (1965) — [ c.336 ]
Курс неорганической химии (1972) — [ c.679 ]
Технология серной кислоты (1950) — [
c. 0
]
0
]
Основы общей химии том №1 (1965) — [ c.336 ]
Печи химической промышленности Издание 2 (1975) — [ c.34 ]
Получение серной кислоты — Реферат
[pic 1]
МИНОБРНАУКИ РОССИИ |
Федеральное государственное бюджетное образовательное учреждение высшего образования «Московский технологический университет» МИРЭА |
Институт тонких химических технологий
Экономика предприятия
Студент | Анохин Евгений Валерьевич |
Направление подготовки | 18.03.01 Химическая технология |
Группа | ХЕБО-01-16 |
Москва 2018
Содержание
1. Основные разделы бизнес-плана продукта
2. Расчет себестоимости продукции
Расчет себестоимости продукции
2.1 Материалы, покупные изделия и полуфабрикаты
2.2 Амортизационные отчисления
2.3 Оплата труда
2.4 Дополнительная заработная плата
2.5 Страховые отчисления
2.6 Накладные расходы
3. Определение договорной цены
1. Основные разделы бизнес-плана продукта
1. Описание продукта
(Характеристики товаров)
Серная кислота сильная двухосновная кислота. Основными химическими свойствами серы являются следующие:
- выступает энергичным окислителем;
- хорошо поглощает пары воды;
- обладает низко летучестью.
2. Анализ рынок сбыта
(Кто будет выступать потребителями производимой продукции или услуг?)
Среди минеральных кислот, серная кислота является лидером по объему производства и потребления. Так, отмеченные выше химические свойства серной кислоты нашли широкое применение в промышленности. Приведем краткий перечень отраслей обрабатывающей промышленности потребляющих серную кислоту:
Химическая промышленность.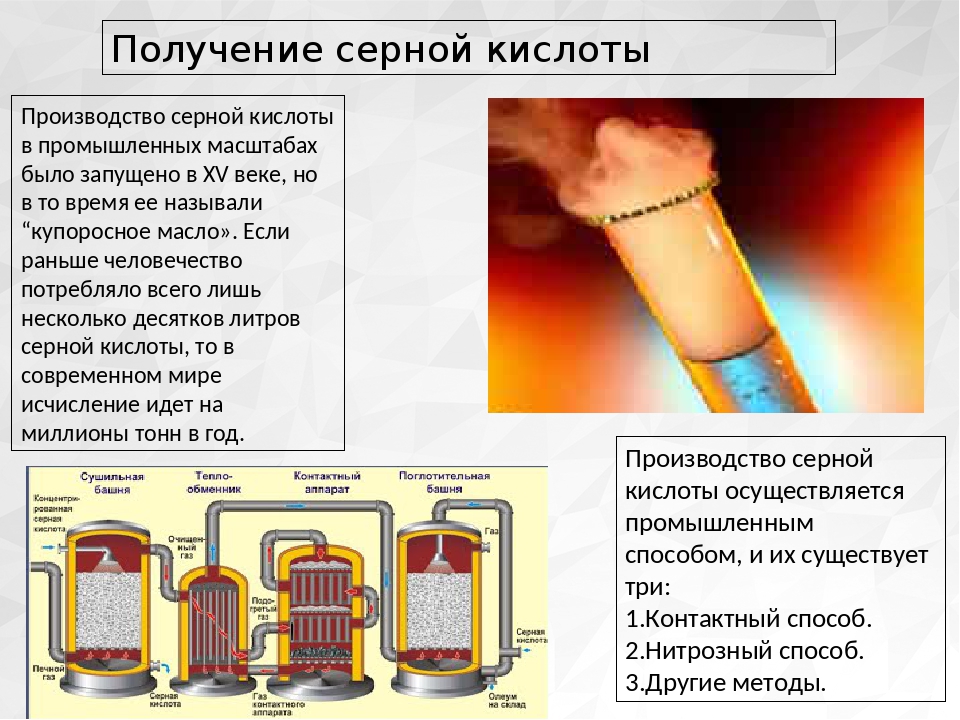 Производство минеральных удобрений, пластмасс, красителей, искусственных волокон, минеральных кислот и т.д.
Производство минеральных удобрений, пластмасс, красителей, искусственных волокон, минеральных кислот и т.д.
Нефтехимическая промышленность. Очистка нефти и получение парафинов.
Цветная металлургия. Применяется для получения цветных металлов (цинка, меди и т.д.).
Черная металлургия. Используется для травления металлов.
Пищевая промышленность. Востребована для производства крахмала, патоки.
3. Конкурентоспособность
(Определение экономичного способа изготовления продукции)
В промышленности для изготовления серной кислоты выделяются два способа производства: контактный и нитрозный.
Контактный способ. Окисление диоксида серы, полученного от сжигания серы или колчедана, до триоксида с последующим взаимодействием с водой.
Нитрозный способ. Окисление диоксида сери диоксидом азота в присутствии воды.
В настоящее время основным методом производства серной кислоты является контактный, т.к. этот метод имеет преимущества перед другими:
— получение продукта в виде чистой концентрированной кислоты, приемлемой для всех потребителей;
— уменьшение выбросов вредных веществ в атмосферу с выхлопными газами.
5. План производства
Количество сотрудников и их обязанности.
Запланированный объем выпуска серной кислоты – 400 000 т. Для производства потребуется 3 группы рабочих: инженерно-технологические работники, производственные рабочие, ремонтный персонал. Общее количество сотрудников 25 человек.
Процесс получения серной кислоты (h3SO4) из пирита (FeS2) протекает по следующим стадиям:
- 4FeS2 + 11O2 = 2Fe2O3 + 8SO2;
- 8SO2 + 4O2 = 8SO3;
- 8SO3 + 8h3O = 8h3SO4.
Запишем суммарное уравнение реакции:
4FeS2 + 15O2 + 8h3O = 2Fe2O3 + 8h3SO4
Рассчитаем молярные массы:
- FeS2 = 56 + 2*32 = 120 (г/моль)
- O2 = 2*16 = 32 (г/моль)
- Fe2O3 = 2*56 + 3*16 = 160 (г/моль)
- SO2 = 32 + 2*16 = 64 (г/моль)
- SO3 = 32 + 3*16 = 80 (г/моль)
- h3O = 2 + 16 = 18 (г/моль)
- h3SO4 = 2 + 32 + 4*16 = 98 (г/моль)
Рассчитаем необходимое количество сырья и материалов.
Серная кислота
Серная кислота является одним из наиболее важных соединений, производимых в химической промышленности. Он используется для производства буквально сотен соединений, необходимых почти в каждой отрасли.
Он используется для производства буквально сотен соединений, необходимых почти в каждой отрасли.
Использование серной кислоты
Безусловно, наибольшее количество серной кислоты используется для производства фосфорной кислоты, которая, в свою очередь, используется для производства фосфатных удобрений, дигидрофосфата кальция и фосфатов аммония. Он также используется для производства сульфата аммония, который является особенно важным удобрением в условиях дефицита серы.
Рисунок 1. Использование серной кислоты.
Он широко используется в металлообработке, например, при производстве меди и цинка, а также при очистке поверхности стального листа, известной как «травление», перед покрытием тонким слоем олова, используемым для изготовления банки для еды.
Используется также для получения капролактама, перерабатываемого в полиамид 6, и в производстве диоксида титана, используемого, например, в качестве пигмента.
Среди многих других его применений — производство плавиковой кислоты и фенола с пропаноном, которые используются во многих отраслях промышленности.
Годовое производство серной кислоты
| Мир | 231 млн тонн |
| Китай | 74 миллиона тонн |
| США | 37 миллионов тонн |
| Индия | 16 миллионов тонн |
| Россия | 14 миллионов тонн |
| Марокко | 7 млн тонн |
Данные получены из:
Merchant Research & Consulting Ltd.
Эти цифры относятся к 2011–2012 гг. Ожидалось, что к 2012 г. мировое производство превысит 250 млн тонн (mcgroup.com) и 260 млн тонн к 2018 г. (marketsandmarkets.com), а тенденция к росту прогнозируется как минимум до 2023 г. (transparencymarketresearch.com).
(transparencymarketresearch.com).
Производство серной кислоты
Процесс производства серной кислоты состоит из четырех стадий:
а) извлечение серы
б) конверсия серы в диоксид серы
в) конверсия диоксида серы в триоксид серы
г) конверсия триоксида серы в серную кислоту
(a) Добыча серы
Пожалуй, самым важным источником серы является ее извлечение из природного газа и нефти.Они содержат соединения серы, как органические, так и сероводород, которые необходимо удалить перед использованием в качестве топлива или химического сырья.
Другим важным источником серы является двуокись серы при рафинировании металлов. Многие металлические руды встречаются в виде сульфидов и обжигаются с образованием оксида и диоксида серы, например, при производстве свинца:
Другие металлы, произведенные из сульфидных руд, включают медь, никель и цинк.
Во всем мире около 35% серы получают в виде диоксида серы при обжиге сульфидной руды, и этот показатель увеличивается, поскольку предприятия, которые традиционно выпускали диоксид серы в атмосферу, извлекают его в виде серной кислоты. В частности, Китай производит большую часть своей серной кислоты из пирита, руды сульфида железа.
В частности, Китай производит большую часть своей серной кислоты из пирита, руды сульфида железа.
Серную кислоту также получают из сульфата аммония, побочного продукта при производстве поли(метил-2-метилпропеноата), а также извлекают из «отработанной» (т.е. использованной) серной кислоты.
(b) Преобразование серы в диоксид серы
Если сера является исходным сырьем, ее необходимо сначала преобразовать в диоксид серы. Расплавленную серу распыляют в печи и сжигают в потоке сухого воздуха при температуре около 1300 К.Сера горит характерным голубым пламенем:
Поскольку используется избыток воздуха, выходящий газ содержит около 10-12% диоксида серы и 10% кислорода по объему. Газы очень горячие и поэтому проходят через теплообменники (котлы-утилизаторы).
Газы охлаждаются примерно до 700 К, а вода в окружающих трубах котла превращается в пар. При производстве одной тонны серной кислоты также производится одна тонна пара высокого давления.
(c) Преобразование диоксида серы в триоксид серы (контактный процесс)
Типичная установка содержит один цилиндрический сосуд, который действует как реактор с неподвижным слоем катализатора с четырьмя отдельными слоями катализатора, известный как конвертер, нагретый до 700 К, через который проходят диоксид серы и воздух:
Катализатор, оксид ванадия(V) на кремнеземе, обычно находится в форме небольших гранул, к которым в качестве промотора добавлен сульфат цезия (рис. 2).Функция промотора состоит в том, чтобы понизить температуру плавления оксида ванадия(V), чтобы он плавился при 700 К.
| Рисунок 2. Катализатор на основе оксида ванадия(v), используемый для производства серной кислоты. В центре снимка виден газоподводящий канал. С любезного разрешения Haldor Topsøe. |
Рис. |
(d) Конверсия триоксида серы в серную кислоту
Триоксид серы, образованный из третьего слоя (и небольшое количество из четвертого слоя), теперь преобразуется в серную кислоту
.
Триоксид серы реагирует с водой, и реакция может быть выражена как:
Однако сама вода не может использоваться для абсорбции, так как происходит значительное повышение температуры и образуется сернокислотный туман, с которым трудно справиться.Вместо этого используется серная кислота с концентрацией около 98%. Эту концентрацию поддерживают добавлением воды и удалением кислоты при этой концентрации.
Для поддержания температуры около 400 К тепло отводится теплообменниками, рис. 4.
Рисунок 4. Линейная схема теплообменника, используемого при производстве триоксида серы.
Неабсорбированные газы содержат около 95 % азота, 5 % кислорода и следы диоксида серы. Поток газа фильтруется для удаления любых следов тумана серной кислоты и возвращается в атмосферу через высокую дымовую трубу.
Дата последнего изменения: 9 октября 2016 г.
Серная кислота – обзор
3.3.15 Серная кислота
Серная кислота (H 2 SO 4 ) (историческое название купоросное масло ) является неорганическим химическим веществом, обладающим высокой коррозионной активностью. представляет собой остро-эфирную, бесцветную или слегка желтоватую вязкую жидкость, растворимую в воде при любых концентрациях. Иногда кислота может продаваться в виде темно-коричневой жидкости (краситель добавляется во время производства), чтобы предупредить покупателей об опасностях обращения с этой кислотой.
представляет собой остро-эфирную, бесцветную или слегка желтоватую вязкую жидкость, растворимую в воде при любых концентрациях. Иногда кислота может продаваться в виде темно-коричневой жидкости (краситель добавляется во время производства), чтобы предупредить покупателей об опасностях обращения с этой кислотой.
Серная кислота производится в больших количествах в мировом масштабе, при этом производство химического вещества часто связано со стадией развития страны из-за большого количества процессов преобразования, в которых она используется. Серная кислота (H 2 SO 4 ) является основным сырьем, используемым в широком диапазоне промышленных процессов и производственных операций. Большая часть произведенной серной кислоты используется в производстве фосфатных удобрений, а другие области применения включают выщелачивание меди, производство неорганических пигментов, переработку нефти, производство бумаги и промышленное производство органических химикатов.
Серная кислота производится из элементарной серы в трехстадийном процессе:
S+O2→SO2
2SO2+O2→2SO3
SO3+h3O→h3SO4
Поскольку реакция серы с сухим воздухом является экзотермической, диоксид серы необходимо охладить, чтобы удалить избыточное тепло и избежать обращения реакции.
Сжигание элементарной серы является основным источником диоксида серы, используемого для производства серной кислоты. В качестве источников диоксида серы используют также сжигание сероводорода из отходящих газов, термическое разложение отработанной серной кислоты или других серосодержащих материалов, обжиг пирита.Серная кислота может производиться в промышленных масштабах либо с помощью процесса со свинцовой камерой , либо с помощью контактного процесса с современным уклоном в сторону контактного процесса.
В контактном процессе технологические установки обычно характеризуются в зависимости от загружаемого в них сырья: (1) сжигание элементарной серы, (2) сжигание отработанной серной кислоты и сероводорода и (3) сжигание сульфида металла сжигание руды и плавильного газа. Более конкретно, контактный процесс включает в себя три основные операции, каждая из которых соответствует отдельной химической реакции.Сначала сера в сырье окисляется (сжигается) до диоксида серы:
S+O2→SO2
Полученный диоксид серы подается на технологическую установку (часто называемую конвертером ), где он каталитически окисляется до триоксида серы:
2SO+2O2→2SO3
Наконец, триоксид серы поглощают раствором сильной серной кислоты (98%):
SO3+h3O→h3SO4
В процессе Фраша элементарная сера плавится, фильтруется для удаления золы и распыляется под давлением в камеру сгорания, где сера сжигается в чистом воздухе, который осушается путем очистки серной кислотой 93–99% (об. /об.).Газы из камеры сгорания охлаждаются, проходя через котел-утилизатор, а затем поступают в конвертер катализатора (пентоксид ванадия, V 2 O 5 ). Обычно 95–98% (об./об.) диоксида серы из камеры сгорания преобразуется в триоксид серы с сопутствующим выделением большого количества тепла. После охлаждения, опять же за счет образования пара, отходящий газ конвертера поступает в абсорбционную колонну. Абсорбционная колонна представляет собой насадочную колонну, в которой сверху распыляется кислота, а снизу поступает триоксид серы.Триоксид серы поглощается серной кислотой с концентрацией 98–99% (об./об.), где триоксид серы соединяется с водой в кислоте и образует больше серной кислоты. Если производится олеум (раствор несвязанного триоксида серы, растворенного в серной кислоте), триоксид серы из конвертера сначала направляется в олеумную колонну, в которую из абсорбционной системы подается 98% (об./об.) кислота. Затем газы из олеумной колонны перекачиваются в абсорбционную колонну, где удаляют остаточный триоксид серы.
/об.).Газы из камеры сгорания охлаждаются, проходя через котел-утилизатор, а затем поступают в конвертер катализатора (пентоксид ванадия, V 2 O 5 ). Обычно 95–98% (об./об.) диоксида серы из камеры сгорания преобразуется в триоксид серы с сопутствующим выделением большого количества тепла. После охлаждения, опять же за счет образования пара, отходящий газ конвертера поступает в абсорбционную колонну. Абсорбционная колонна представляет собой насадочную колонну, в которой сверху распыляется кислота, а снизу поступает триоксид серы.Триоксид серы поглощается серной кислотой с концентрацией 98–99% (об./об.), где триоксид серы соединяется с водой в кислоте и образует больше серной кислоты. Если производится олеум (раствор несвязанного триоксида серы, растворенного в серной кислоте), триоксид серы из конвертера сначала направляется в олеумную колонну, в которую из абсорбционной системы подается 98% (об./об.) кислота. Затем газы из олеумной колонны перекачиваются в абсорбционную колонну, где удаляют остаточный триоксид серы.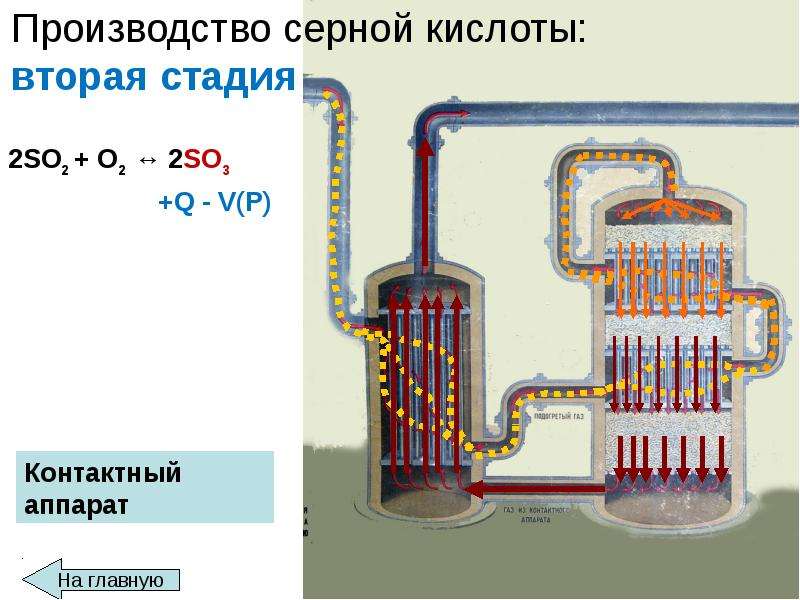 В процессе одинарной абсорбции используется только один абсорбер, как следует из названия, но на многих заводах установлена ступень двойной абсорбции.
В процессе одинарной абсорбции используется только один абсорбер, как следует из названия, но на многих заводах установлена ступень двойной абсорбции.
На стадии двойной абсорбции газообразный триоксид серы, образующийся на ступенях первичного конвертера, направляется в промежуточный абсорбер, где большая часть триоксида серы удаляется с образованием серной кислоты. Оставшийся непрореагировавший диоксид серы направляется на конечные ступени конвертера для удаления большей части оставшегося диоксида серы путем окисления до триоксида серы, откуда он направляется в конечный абсорбер для удаления оставшегося триоксида серы.
Если производится олеум (дымящаяся серная кислота, обозначаемая просто как H 2 SO 4 · SO 3 ) (смесь избытка триоксида серы и серной кислоты), триоксид серы из конвертера направляется в олеум колонна, в которую подается 98% (об./об.) кислота из абсорберов.Затем газы из этой башни перекачиваются в абсорбционную колонну, где удаляют триоксид серы. Могут быть получены различные концентрации олеума. Обычные включают 20% олеума (20%, объем триоксида серы в 80%, объем/объем серной кислоты, без воды), 40% олеума и 60% олеума.
Могут быть получены различные концентрации олеума. Обычные включают 20% олеума (20%, объем триоксида серы в 80%, объем/объем серной кислоты, без воды), 40% олеума и 60% олеума.
Двуокись серы является основным выбросом при производстве серной кислоты и содержится главным образом в отходящих дымовых газах. Преобразование диоксида серы в триоксид серы также происходит не полностью, что приводит к выбросам.Двойная абсорбция считается наилучшей доступной технологией контроля (BACT) для соблюдения NSPS для диоксида серы. Кроме дымовых газов небольшие количества диоксида серы выделяются из хранилищ и вентиляционных отверстий автоцистерн при погрузке, из концентраторов серной кислоты и из негерметичного технологического оборудования.
Кислотные туманы могут также выделяться дымовыми газами абсорбера при производстве серной кислоты. Очень стабильный кислотный туман образуется, когда триоксид серы реагирует с водяным паром ниже точки росы триоксида серы.Типичные устройства управления включают вертикальную трубу, вертикальную панель и горизонтальные каплеуловители с двумя пластинами.
При производстве серной кислоты образуется шлам в установке удаления диоксида углерода, используемой для поглощения газа-растворителя. В установке используется углеводородный растворитель, который в процессе распадается на углеводородный шлам. Этот шлам обычно сжигают на другой стадии процесса. При производстве серной кислоты также образуются твердые отходы, содержащие тяжелый металл ванадий, когда катализатор конвертера регенерируется или просеивается.Эти отходы отправляются на переработку сторонним поставщикам. Дополнительные твердые отходы производства серной кислоты могут содержать как ванадий, так и мышьяк, в зависимости от используемого сырья, и необходимо соблюдать осторожность, чтобы надлежащим образом утилизировать их на свалках.
10 основных промышленных применений серной кислоты — WorldOfChemicals
Серная кислота называется универсальным химическим веществом, королем химических веществ из-за многочисленных применений серной кислоты в качестве сырья или технологического агента. Серная кислота является наиболее часто используемым химическим веществом в мире и используется почти во всех отраслях промышленности, таких как
Серная кислота является наиболее часто используемым химическим веществом в мире и используется почти во всех отраслях промышленности, таких как
- Удобрения
- Фармацевтика
- Бензин
- Автомобильные аккумуляторы
- Отбеливание бумаги
- Сахарное отбеливание
- Очистка воды
- Сульфирующие агенты
- Целлюлозные волокна
- Производство стали
- Красители
- Промежуточные соединения аминокислот
- Регенерация ионообменных смол
Серная кислота – важный промышленный химикат, который используется в процессах производства многих товаров в самых разных областях.Серная кислота, используемая в целлюлозно-бумажной промышленности для производства диоксида хлора, расщепления таллового масла и регулирования pH. Только в Великобритании ежегодно производится более миллиона тонн серной кислоты, а в США производится еще 40 миллионов тонн. Ежегодное мировое производство серной кислоты составляет около 180 миллионов тонн.
Серная кислота — это сильнокислотная маслянистая жидкость, которая может быть прозрачной или мутной. Концентрированная серная кислота действует как окислитель и осушитель.Серная кислота доступна во многих сортах, начиная от класса электролита (33 весовых процента) для аккумуляторов до 93 весовых процентов (66 градусов Боме), 98 весовых процентов и 20-22 весовых процента дымящегося олеума, содержащего избыток растворенного триоксида серы. Наиболее часто отгружаемый сорт составляет 93 весовых процента.
В окружающей среде серная кислота является составной частью кислотных дождей, поскольку она образуется при окислении двуокиси серы в атмосфере в присутствии воды. Атмосферный диоксид серы образуется при сжигании серосодержащих ископаемых видов топлива, таких как уголь и нефть.
Серная кислота когда-то была известна как купоросное масло, придуманное арабским алхимиком 8-го века Джабиром ибн Хайяном. Он был приготовлен Иоганном Ван Гельмонтом в 1600-х годах путем деструктивной перегонки зеленого купороса (сульфата железа) и сжигания серы. Обжигание серы с селитрой (нитратом калия) впервые было использовано для получения серной кислоты в 17 веке.
Обжигание серы с селитрой (нитратом калия) впервые было использовано для получения серной кислоты в 17 веке.
К середине 17 века Джон Робак изобрел процесс со свинцовой камерой, в котором в качестве окислителя использовались оксиды азота.Контактный процесс, при котором окисление диоксида серы в триоксид серы осуществляется кислородом (воздухом) над катализатором, был первоначально разработан около 1830 года Перегрином Филлипсом в Англии.
В дискреционном производстве добыча серы или серосодержащих полезных ископаемых (пиритов) является единственной целью, основанной на добровольной разработке отдельных месторождений для получения максимальной экономической выгоды. В недискреционном производстве сера или серная кислота извлекаются как вынужденный побочный продукт, количество которого зависит от спроса только на первичный продукт.
В настоящее время свинцово-камерный процесс почти полностью вытеснен контактным процессом в промышленном производстве серной кислоты. Большая часть серной кислоты, производимой в процессе со свинцовой камерой, используется при изготовлении удобрений, поскольку кислота является относительно разбавленной. Напротив, в контактном процессе можно получить кислоту любой желаемой концентрации.
Большая часть серной кислоты, производимой в процессе со свинцовой камерой, используется при изготовлении удобрений, поскольку кислота является относительно разбавленной. Напротив, в контактном процессе можно получить кислоту любой желаемой концентрации.
Серная кислота является очень важным товарным химическим продуктом, и действительно, производство серной кислоты в стране было достаточно хорошим показателем ее промышленной мощи за последнее столетие или около того.
Вот некоторые из растущего числа конечных пользователей и приложений, использующих серную кислоту
Химическое производство
Как очень важное химическое соединение, серная кислота используется в процессе производства ряда хорошо известных химикатов, включая соляную кислоту, азотную кислоту, фосфорную кислоту и многие другие промышленные химикаты.
Переработка нефти Процесс очистки сырой нефти требует использования кислоты в качестве катализатора, и для этой цели часто используется серная кислота. Он используется в SAAU или установке алкилирования серной кислотой.
Он используется в SAAU или установке алкилирования серной кислотой.
«Травление» — это термин, используемый для описания обработки металлов для удаления загрязнений, ржавчины или окалины с поверхности, например, при производстве стали. В настоящее время использование серной кислоты для этой цели несколько сократилось, поскольку в настоящее время промышленность отдает предпочтение использованию соляной кислоты. Хотя соляная кислота более дорогая, чем серная кислота, она дает результаты быстрее и сводит к минимуму потери основного металла в процессе травления.
Производство вискозы Текстильный вискоза изготовлен из целлюлозных волокон, полученных из древесины. Их растворяют в растворе тетраамина меди (II) с образованием густой синей жидкости, которую затем вводят в серную кислоту для формирования волокон искусственного шелка. Вискоза считается хорошей полусинтетической тканью и может соперничать с шелком по драпировке и блеску. Действительно, его иногда называют «художественным шелком».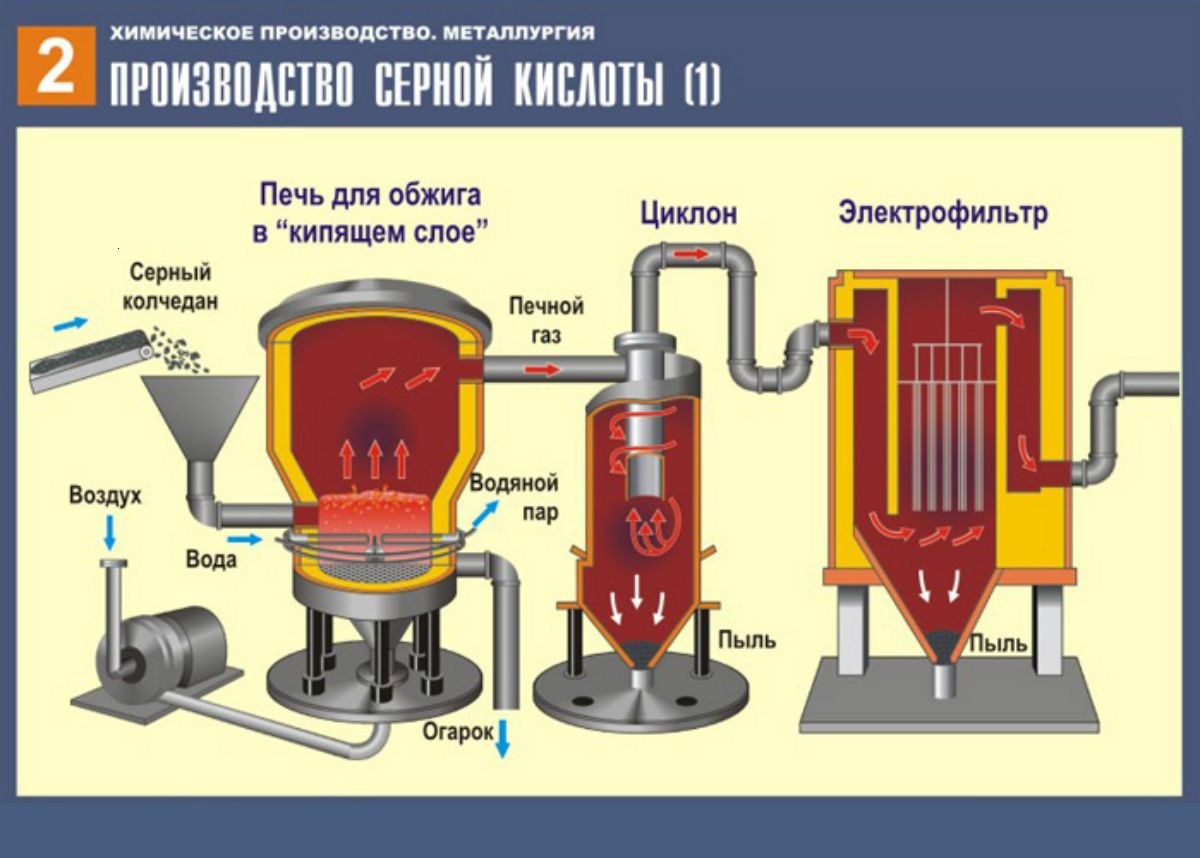 Он легко окрашивается, а ткань мягкая, прохладная и гладкая. Однако, в отличие от шелка, вискоза не изолирует тепло тела, поэтому идеально подходит для использования во влажных и жарких странах.
Он легко окрашивается, а ткань мягкая, прохладная и гладкая. Однако, в отличие от шелка, вискоза не изолирует тепло тела, поэтому идеально подходит для использования во влажных и жарких странах.
в герметичном корпусе используются в автомобильной промышленности для легковых и грузовых автомобилей. Герметичные аккумуляторы свинцово-кислотного типа были изобретены в 1859 году французом Гастоном Плантом. Серная кислота используется в разбавленной форме в качестве электролита, обеспечивающего поток электронов между пластинами в батарее. Серная кислота, используемая таким образом, обычно называется аккумуляторной кислотой. Он может варьироваться по силе в зависимости от производителя батареи, но обычно составляет от 28 до 32 процентов или от 4.от 2 до 5 молярных.
Сбор картофеля Фермеры, выращивающие картофель , нанимают специалистов-подрядчиков для опрыскивания своих полей картофеля перед сбором урожая, чтобы зеленая ботва отмирала и чернела в течение дня или двух. Это помогает высушить стебель и предотвращает его запутывание в уборочном оборудовании. Обычный метод опрыскивания ботвы картофеля – раствором серной кислоты.
Это помогает высушить стебель и предотвращает его запутывание в уборочном оборудовании. Обычный метод опрыскивания ботвы картофеля – раствором серной кислоты.
Химиотерапевтические препараты используются для лечения различных видов рака.Раковые клетки более чувствительны к повреждению ДНК, чем нормальные клетки, поэтому при химиотерапевтическом лечении раковые клетки разрушаются, повреждая их ДНК. Этот процесс известен как алкилирование ДНК, и используются лекарства, известные как алкилирующие противоопухолевые агенты. Серная кислота используется в процессе изготовления таких лекарств
Для связи с автором почта: [email protected]
© WOC Статья
Серная кислота была основой промышленной революции
Англичанин Джон Джордж Хей (1909–1949) известен в криминальных кругах как «убийца, принимающий кислотные ванны».Между 1944 и 1949 годами он убил шесть человек и избавился от их останков, растворив их в больших чанах с концентрированной серной кислотой.
Хей ошибочно полагал, что если бы не было тела, его нельзя было бы осудить за убийство. Но его извращенное использование агрессивных свойств серной кислоты не помогло скрыть его преступление. 10 августа 1949 года он погиб на виселице.
Но серная кислота (H 2 SO 4 ) имеет гораздо больше менее ужасных применений и фактически является основой современной химической промышленности и наиболее часто используемой из всех кислот.
О сульфатных минералах железа и меди люди знали с древних времен, когда их называли купоросом.
Вулканы Иджен в Индонезии включают крупнейшее в мире сернокислотное озеро. (Фото: Shutterstock)
Наши предки использовали купорос в металлургических и медицинских целях, но гораздо позже узнали, что купорос можно использовать и для получения сильной кислоты. Открытие часто приписывают мусульманскому алхимику Джабиру ибн Хайяну (ок.с 721 по 815 г. н.э.), который стал известен как Гебер и чьи сочинения были известны около 1300 г. н.э.
н.э.
Подробнее: Средневековая медеплавильная находка — старейшая в Норвегии
Серная кислота для окрашивания одежды
Средневековые алхимики разработали метод сочетания зеленого купороса (сульфата железа, FeSO 4 , 7H 2 O) с селитрой и водой при нагревании в стеклянном или каменном горшке. Результат был назван купоросным маслом из-за его маслянистой консистенции.
Наш язык сохраняет эти старые связи между купоросом и серной кислотой: мы до сих пор ссылаемся на язвительную сатиру, имея в виду язвительную или разъедающую форму комедии.
Часть химического завода BASF в Лювигсхафене, Германия. BASF был пионером современного производства серной кислоты. (Фото: Google+)
Спрос на серную кислоту оставался низким до середины 1700-х годов. До этого он ограничивался производством глауберовой соли или декагидрата сульфата натрия, который продавался в аптеках в качестве чистящего средства и был назван в честь немецкого химика Иоганна Глаубера (1604–1670) и до сих пор продается в магазинах здоровья.
Производство увеличилось примерно с 1760 года, когда он стал использоваться в качестве красителя для ткани вместо традиционной техники отбеливания с использованием простокваши.
Кислота использовалась для получения растворимой формы синего растительного красителя индиго в форме, которую можно растворить в воде. В качестве отбеливающего агента серная кислота очень быстро была заменена более эффективным хлором, но это не уменьшило значения серной кислоты. Напротив.
Подробнее: Этот камень мгновенно меняет цвет
Решающая роль в промышленной революции
Первая фотография сернокислой поверхности и атмосферы Венеры, сделанная 22 октября 1975 года российским космическим зондом.(Фото: спускаемый аппарат «Венера-9», Российское космическое агентство)
Успех отбеливания хлором привел к увеличению спроса на серную кислоту. Хлор в основном производится из соляной кислоты (HCl) путем объединения серной кислоты и поваренной соли (H 2 SO 4 + 2NaCl → 2HCl + Na 2 SO 4 ).
Рост спроса привел к появлению так называемого свинцово-камерного процесса, который доминировал в сернокислотной промышленности до начала 20 го века.
Впервые он был введен английским изобретателем Джоном Робаком (1718–1794), который был одним из ведущих деятелей промышленной революции и работал с Джеймсом Уаттом (1736–1819) над созданием паровой машины.
Первоначальный вариант свинцово-камерного процесса состоял из вулканической серы или пирита (FeS 2 ), сжигаемых в присутствии селитры (KNO 3 ) в больших камерах из свинца, который не подвергается коррозии серной кислотой, в отличие от других металлы.
Затем постепенно добавляют воду или пар для получения серной кислоты с концентрацией около 60 процентов.Его можно дополнительно сконцентрировать путем нагревания в платиновых котлах.
В химическом отношении процесс описывается следующим образом:
Диоксид серы образуется при сжигании серы: S + O 2 → SO 2 .
Затем используется для получения серной кислоты: SO 2 + O + H 2 O → H 2 SO 4 .
Нитр используется для передачи атома кислорода (O), который превращает газообразный диоксид серы в серную кислоту. В 1700-х годах они, вероятно, не понимали химических механизмов, стоящих за этими реакциями, но это не помешало прогрессу производства серной кислоты.
Подробнее: 1750 скелетов рассказывают истории о жизни во время промышленной революции
Производство серной кислоты в Дании
Ряд технических разработок 1800-х годов привел к созданию более крупных и эффективных заводов по производству кислоты с концентрацией до 80 процентов по всей Европе и Северной Америке.
Дания произвела небольшое количество серной кислоты с открытием завода Fredens Mølle в Амагере (южный Копенгаген) в 1834 году британо-датским торговцем Джозефом Оуэном (1789–1862).
Серная кислота заняла видное место в технологической и промышленной истории из-за ее использования в ряде химических продуктов, включая соляную кислоту, водород, суперфосфат, отбеливатель и соду.
Кислота играла такую же решающую роль в химической промышленности, как и паровой двигатель в машиностроении, а кремнезем — в современных информационных технологиях.
В своей популярной книге «Химические письма» выдающийся немецкий химик Юстус фон Либих (1803–1873) писал:
«Мы можем точно оценить химическую промышленность страны по количеству потребляемой ею серной кислоты.
Во время парламентских дебатов премьер-министр Великобритании Бенджамин Дизраэли (1804–1881) охарактеризовал производство серной кислоты как барометр степени индустриализации страны. Его собственная страна была высокоразвитой промышленностью, производившей к 1870 году 600 000 тонн серной кислоты — больше, чем любая другая страна. В то время Дания производила 3500 тонн.
Подробнее: Третья промышленная революция в Норвегии?
Две тонны серной кислоты для надувания воздушного шара
Серная кислота даже сыграла свою роль в полете на воздушном шаре. Воздушные шары с водородом были представлены в 1783 году французским физиком Жаком Шарлем (1746–1823) и его помощником, которые использовали для путешествия воздушный шар, наполненный горючим газом. Это дало воздушному шару подъемную силу, необходимую для полета.
Воздушные шары с водородом были представлены в 1783 году французским физиком Жаком Шарлем (1746–1823) и его помощником, которые использовали для путешествия воздушный шар, наполненный горючим газом. Это дало воздушному шару подъемную силу, необходимую для полета.
Для получения газообразного водорода (H 2 ) они использовали железные наполнители, облитые большим количеством серной кислоты (Fe + H 2 SO 4 → FeSO 4 + H 2 ). Но для создания большого водородного баллона требовалось около двух тонн серной кислоты и соответствующее количество железа, что делало этот процесс дорогим и трудоемким.
Однако более важной была роль серной кислоты в производстве формы суперфосфата, который с середины 1800-х годов в больших количествах использовался в качестве удобрения.
Встречающиеся в природе минеральные фосфаты, такие как фосфат кальция, плохо растворимы. Он должен быть превращен в растворимый кислый фосфат, прежде чем его можно будет использовать в качестве удобрения на земле. Как показал Либих в 1841 году, этого можно добиться с помощью серной кислоты.
Как показал Либих в 1841 году, этого можно добиться с помощью серной кислоты.
Открытие Либиха положило начало процветающей отрасли, в которой минеральный фосфат сочетается с серной кислотой.При этом образуется кислый фосфат кальция (CaHPO 4 ), который растворим в воде и поэтому может усваиваться растениями.
Большой спрос на суперфосфат в сельском хозяйстве Европы привел к большому спросу на серную кислоту. Сегодня более половины мирового производства серной кислоты используется для производства суперфосфата и других питательных веществ.
Подробнее: Маленькая долина — гигантская батарея?
Рост спроса приводит к сильной конкуренции
Первоначальная сернокислотная промышленность в значительной степени основывалась на рецептах, разработанных самими мастерами, но к концу 19 века важную роль стали играть химические исследования.
К тому времени некогда доминирующий процесс со свинцовой камерой конкурировал с новым методом, известным как контактный процесс.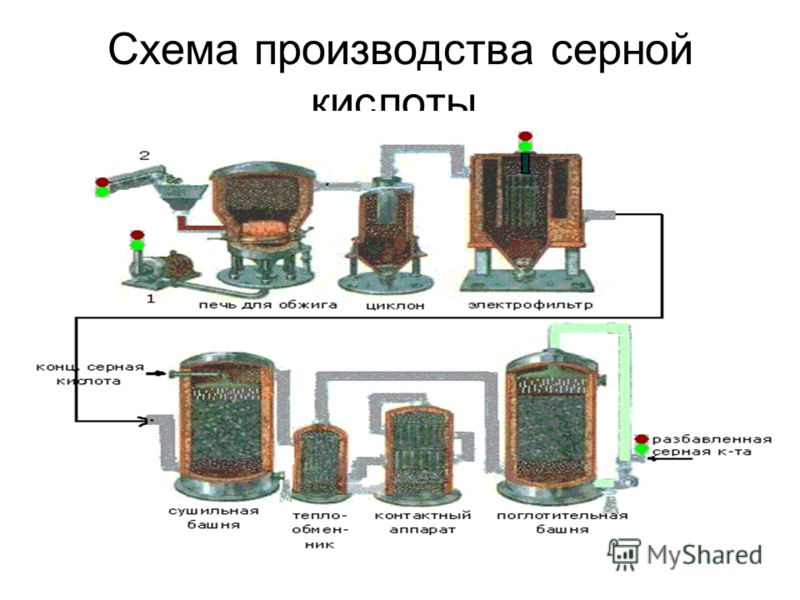 К концу Первой мировой войны контактный процесс захватил мировые рынки, и большая часть серной кислоты сегодня производится именно таким способом.
К концу Первой мировой войны контактный процесс захватил мировые рынки, и большая часть серной кислоты сегодня производится именно таким способом.
Новый метод производил более чистую форму серной кислоты — до 98 процентов — которая требовалась новым рынкам ализарина, индиго и других синтетических пигментов, используемых в текстильной промышленности.
Подробнее: Разногласия в ЕС задерживают регулирование вредных химических веществ
Немецкие исследования сделали новую технику глобальной
Было одно техническое препятствие, которое грозило снизить прибыль новой отрасли производства текстильных пигментов.
Проблема была решена в рамках комплексной исследовательской программы, реализованной крупной немецкой промышленной группой BASF (Badische Anilin und Soda Fabrikation) под руководством химика-промышленника Рудольфа Книтча (1854–1906) в 1880-х годах.
В нормальных условиях продукты сгорания серной кислоты, диоксид серы (SO 2 ), не связываются с кислородом воздуха. Но немецкий химик показал, что этого можно добиться при контакте с подходящим катализатором, например оксидом платины или ванадия (V 2 O 5 ).
Но немецкий химик показал, что этого можно добиться при контакте с подходящим катализатором, например оксидом платины или ванадия (V 2 O 5 ).
Это создает триоксид серы (SO 3 ), который, в свою очередь, создает серную кислоту, поскольку он спонтанно реагирует с водой (SO 3 + H 2 O → H 2 SO 4 ).
BASF и еще один немецкий производитель, Hoechst, в середине 1890-х создали первое промышленное предприятие, использующее контактный процесс. И не случайно эти две фирмы были крупнейшими в мире производителями синтетических красителей. BASF также стал крупнейшим в мире производителем серной кислоты.
Подробнее: Плохая химия: химические компании не соблюдают правила ЕС
Товар не для дома
Серная кислота, вероятно, не является обычным бытовым продуктом. Вероятно, она наиболее известна как аккумуляторная кислота, которая вместе с дистиллированной водой используется в автомобильных аккумуляторах. Но это не меняет того факта, что наше общество зависит от него.
Но это не меняет того факта, что наше общество зависит от него.
Серная кислота — неизмеримо важное химическое вещество, но не стоит подходить слишком близко.Мы можем радоваться, что живем не на Венере, где не только температура поверхности составляет 470 градусов по Цельсию, но и атмосфера состоит из углекислого газа и серной кислоты.
В то время как облака на Земле проливают воду, на Венере проливается дождь из концентрированной серной кислоты.
—————
Прочтите эту статью на английском языке на ForskerZonen, части Videnskab.dk
Перевод: Кэтрин Jex
Внешние ссылки
Похожие материалы
Вулканы, связанные с культурными переворотами со времен раннего Рима
Новое исследование показывает, что крупные извержения вулканов многократно охлаждали глобальный климат за последние 2500 лет и совпали с разрушительным голодом по всей Европе.
Третья промышленная революция для Норвегии?
Богатство и процветание Норвегии за последние четыре десятилетия были основаны на нефти, но будет ли Норвегия теперь двигаться к более экологичному будущему, основанному на возобновляемых источниках энергии, общем транспорте и сверхэффективном жилье?
Промышленные загрязнители меняют микробиоту гренландского льда
Бактерии на ледяном щите Гренландии приспосабливаются к загрязняющим веществам, осевшим на льду.Эти же бактерии могут быть ключом к удалению части этого загрязнения до того, как оно попадет в местную пищевую цепочку.
Современная индустриализация убила охлаждение океана
Температура океана снижалась в течение почти двух тысячелетий, но затем пришла индустриализация человечества.
Худые песцы больше страдают от техногенных загрязнителей
Арктика может быть далеко от промышленного мира, но вредные химические вещества попадают на север и там концентрируются в организме животных.Исследователи обнаружили тревожную тенденцию: концентрация одного вредного химического семейства у худых песцов выше, чем у их более упитанных собратьев.
Процесс производства серной кислоты — Мир химического машиностроения
Процесс производства серной кислотыПроцесс производства серной кислоты
Серная кислота является наиболее производимым химическим веществом в мире из-за ее широкого использования не только в химической, металлургической, технологической, нефтехимической промышленности, промышленности по производству удобрений, но также в электротехнической и электронной, полупроводниковой промышленности, а также в различных лабораториях по всему миру. Наиболее важное применение в фосфатной промышленности, а также в металлургической промышленности. Они также находят важное применение в производстве красок и пигментов, взрывчатых веществ, моющих средств, пластмасс и синтетических волокон.
Наиболее важное применение в фосфатной промышленности, а также в металлургической промышленности. Они также находят важное применение в производстве красок и пигментов, взрывчатых веществ, моющих средств, пластмасс и синтетических волокон.
Серная кислота представляет собой бесцветную жидкость, по внешнему виду похожую на воду. Он имеет молекулярную массу около 98. Он тяжелее воды. Серную кислоту можно разбавлять водой, чтобы получить кислоты разной концентрации для разных целей. В процессе перемешивания в воду следует добавлять серную кислоту.
Причина в том, что поскольку серная кислота тяжелее воды, она будет перемещаться на дно под действием силы тяжести, и перемешивание будет более равномерным. Если мы добавим воду в серную кислоту, так как вода легче серной кислоты, она останется наверху.
Следовательно, у нас будет вода в верхнем слое и серная кислота в нижнем слое. На границе раздела серная кислота будет поглощать воду и выделять тепло. Это выделяющееся тепло будет испарять часть воды вблизи границы раздела. Он превратит его в пар. Пар расширится, и смесь разлетится во все стороны взрывным образом.
Он превратит его в пар. Пар расширится, и смесь разлетится во все стороны взрывным образом.
Почти вся серная кислота в мире производится по контактному процессу.
Сырье, используемое в контактном процессе
Серная кислота состоит из серы, кислорода и водорода. Поэтому, естественно, для производства серной кислоты выбираются источники, богатые этими составами элементов. Используемым сырьем может быть сама по себе элементарная сера, диоксид серы или пирит.Также используются воздух и вода.
Серу можно найти в шахтах, серу и диоксид серы можно найти в дымовых газах, получаемых в угольной или нефтяной промышленности. Сера или сероводород могут быть получены путем десульфурации нефти. Диоксид серы можно получить при плавке силицидных руд металлов или выделить из пирита.
Процесс производства серной кислоты
- Производство газообразного диоксида серы (SO2)
- Производство газообразного триоксида серы (SO3)
- Производство серной кислоты (h3SO4)
Этапы производственного процесса серной кислоты
Процесс производства серной кислоты Процесс контакта включает три основных этапа. Первый этап – окисление серы до диоксида серы. Второй этап — каталитическое окисление диоксида серы до триоксида серы. Третий этап — гидратация триоксида серы с образованием серной кислоты.
Первый этап – окисление серы до диоксида серы. Второй этап — каталитическое окисление диоксида серы до триоксида серы. Третий этап — гидратация триоксида серы с образованием серной кислоты.
Сера, полученная из любого источника, сжигается с образованием газообразного диоксида серы. На этом этапе необходимо соблюдать осторожность, чтобы воздух, подаваемый для процесса горения, был сухим. Любые следы воды приведут к образованию кислоты и вызовут коррозию в оборудовании для сжигания.Также, если сера содержит углеродсодержащие примеси, ее необходимо фильтровать. Если газ не фильтруется от примесей, то они будут переноситься через оборудование, а если попадут на катализаторы, то будут деактивировать его. Окисление серы до двуокиси серы является крайне необратимым процессом.
Процесс производства серной кислоты Второй этап : Производство газообразного триоксида серы (SO3) Катализатор, используемый для каталитического окисления диоксида серы в триоксид серы, представляет собой пятиокись ванадия.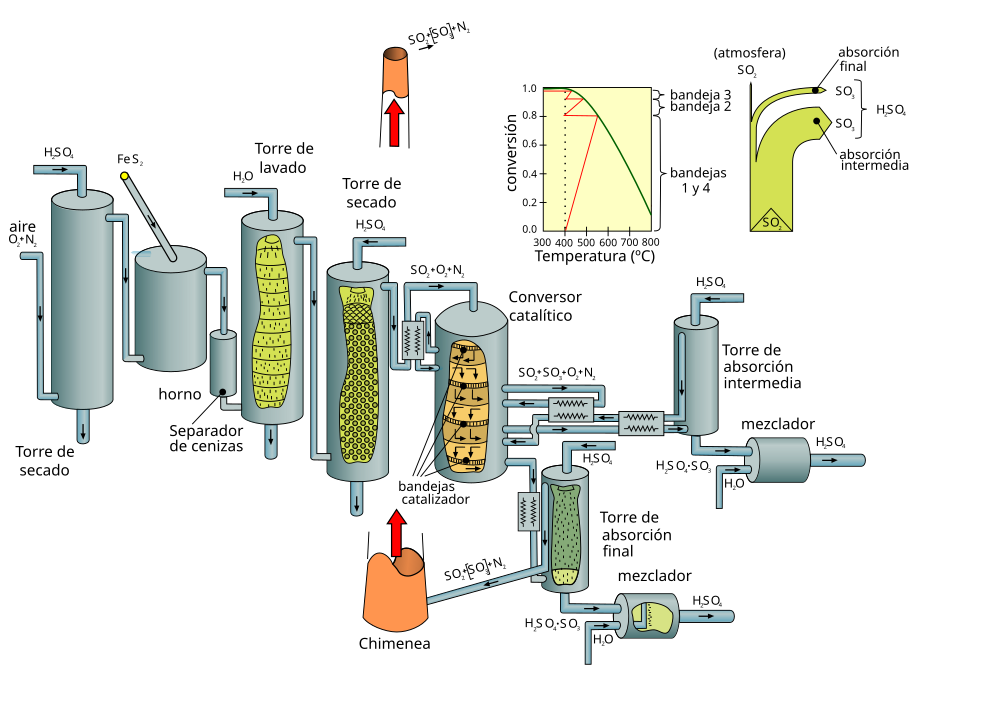 Перед отправкой диоксида серы в реактор газ предварительно обрабатывается для удаления любых примесей, если они присутствуют, с помощью мокрой очистки, а если присутствуют какие-либо мелкие частицы, газ пропускается через электростатический осадитель. Окисление диоксида серы в триоксид серы является обратимым процессом. Давление поддерживают на уровне 1,2-1,5 атм и температуру на уровне 410-430°С.
Перед отправкой диоксида серы в реактор газ предварительно обрабатывается для удаления любых примесей, если они присутствуют, с помощью мокрой очистки, а если присутствуют какие-либо мелкие частицы, газ пропускается через электростатический осадитель. Окисление диоксида серы в триоксид серы является обратимым процессом. Давление поддерживают на уровне 1,2-1,5 атм и температуру на уровне 410-430°С.
Если температура поднимается выше 430°C, равновесие смещается от триоксида серы, поэтому очень важно, чтобы рабочая температура поддерживалась в этом диапазоне.Обычно каталитический реактор конструируется как реактор с четырехступенчатым слоем. Когда газ проходит через один слой катализатора, его температура повышается с 410-430°C до примерно 600°C, следовательно, после каждого этапа газ должен снова охлаждаться до оптимальной температуры, прежде чем поступать на следующий этап.
Процесс производства серной кислоты Важно предотвратить утечку диоксида серы в атмосферу, так как он не только загрязняет воздух, но и является основной причиной кислотных дождей. Двойная абсорбция помогает обеспечить превращение большего количества диоксида серы в триоксид серы, а также в целом это полезно для процесса с точки зрения чистоты. После трех стадий чистота становится 97-98%, а после четырех стадий чистота становится 99,5-99,8%.
Двойная абсорбция помогает обеспечить превращение большего количества диоксида серы в триоксид серы, а также в целом это полезно для процесса с точки зрения чистоты. После трех стадий чистота становится 97-98%, а после четырех стадий чистота становится 99,5-99,8%.
Триоксид серы гидратируется путем абсорбции в колонне с насадкой, заполненной серной кислотой определенного диапазона. Этот конкретный диапазон составляет 98-99%.Если эта концентрация оказывается ниже, то триоксид серы не поглощается должным образом и образует неприятный туман. Если концентрация оказывается на более высокой стороне, то пары внутри колонны становятся очень значительными. Следовательно, важно поддерживать хорошую рабочую концентрацию. Результирующую силу кислоты можно регулировать, контролируя расход триоксида серы и воды. Результирующая сила кислоты может варьироваться от 91 до примерно 100% серной кислоты.
Процесс производства серной кислотыСсылка/Изображение: — Youtube
youtube.com/embed/CKIa8P4TBa8?feature=oembed&wmode=opaque» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера на прием файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.

- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только та информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Производство серной кислоты – 2-е издание
Предисловие
1.Обзор
1.1 Каталитическое окисление SO 2 до SO 3
31,2 H 2 SO 4 Производство
1.3 Промышленная флористическая листа
1.4 жжение серы
1. 5 Metallurgical Offgas
5 Metallurgical Offgas
1.6.
1.7 Продукт серной кислоты
1.8 Последние разработки
1.9 Альтернативные процессы
1.10 Резюме
Ссылки
Предлагаемая литература
2.Производство и потребление
2.1 использует
2.2 Кислотные растения Растения
2.3 Цена
2.4 Сводка
Рекомендации
Предлагаемые чтения
Regized Review
3. Задачи серы
3.1 Задачи
3.2 80003
3.3. 3.4 Распылители серы и печи для сжигания серы
3.5 Продуктовый газ
3.6 Котел-утилизатор
3.7 Резюме
Ссылки
Рекомендуемое чтение
4.Охлаждение и очистка отходящих газов металлургии
4.1 Начальная и конечная концентрации SO 2
4.2 Начальная и конечная концентрации пыли
4.3 Охлаждение отходящих газов и рекуперация тепла
4.4 Электростатический сбор пыли
4.5
4,6 H 2 Удаление O(g) из отходящих газов скруббера (таблицы 4. 5 и 4.6)
5 и 4.6)
4.7 Резюме
Ссылки
Рекомендуемое чтение
5.Регенерация отработанной серной кислоты
5.1. Производимые кислотные композиции.
5.2 Отрасленные кислоты, обработанные
5.3 Разложение
5.4 Разложение Печь
5.4 Разложения Продукт
5.5 Оптимальное разложение Печи Условия эксплуатации
5.6 Подготовка OFFGAS для SO 2 Окисление и H 2 SO 4 Изготовление
5.7 Резюме
Ссылки
Рекомендуемая литература
6. Осушка воздуха и газов концентрированной серной кислотой
6.1 Глава Задачи
6.2 Обезвоживание с сильной серной кислотой
6.3 Обезвоживание реакции
6,3 6.4 Residence Times
6.5 Последние достижения
6.6 Резюме
6.6 Сводка
70002 Ссылки
7. Каталитическое окисление SO 2 до SO 3
7.1 Цели
7.2 Промышленный SO 2 окисление
7. 3 Необходимость катализатора
3 Необходимость катализатора
7.4 SO 2 путь окисления «нагрев» (глава 11)
905 Промышленный многокаталитический кровать так 2 Окисление (таблицы 7,2-7,7)7.6 Промышленная работа (Таблица 7.2)
7.7 Последние достижения
7.7 Сводка
Ссылки
8. Ссылки
2 Catalyst и катализатор катализатора8.1 Каталитические реакции
8.2 Максимальная и минимальная рабочие температуры катализатора
8.3 Состав и производство
8.4 Выбор размера и формы
8.5 Толщина и диаметр слоя катализатора
8.6 Resident Resident Resident
8.7 Температура слоя катализатора
8.8 Катализаторное обслуживание
8.9 Сводка
Ссылки
Ссылки
Предлагаемое чтение
9. Производство H 2 SO 4 (ℓ) от SO 3 g)
9.1 Цели
9.2 Серная кислота вместо воды
9.3 Механизм реакции абсорбции
9. 4 Промышленный H 2 SO 4 изготовление (таблицы 9.9.3–9.03) 905 Выбор входных и выходных кислотных композиций
4 Промышленный H 2 SO 4 изготовление (таблицы 9.9.3–9.03) 905 Выбор входных и выходных кислотных композиций
9,6 кислотная температура
9,7 температура газа
9,7 Эксплуатация и управление
9.9 Двойной контакт
9.9 Двойной контакт H 2 SO 4 Создание (таблицы 19.3 и 23.2)
9.10 Промежуточное H 2 SO 4 Создание
9.11 Сводка
9.11 Сводка
Ссылки на
Предлагаемое чтение
Breake
10. Окисление SO 2 до SO 3 — Одновременные кривые
10.1 каталитическое окисление
10.2 Уравнение равновесия
10.3 K E в зависимости от температуры
10.4 K E с точки зрения % SO 2 Окисленные
10.5 равновесие % SO 2 Окисленные как функция температуры
10.6 Обсуждение
10.7 Резюме
10.8 Проблемы
Ссылка
11. SO 2 пути нагрева окисления
SO 2 пути нагрева окисления
11.1 Paths Heatup
11.2 Задача
11.2 Приготовление нагрева нагрева — первая точка
11.4 Допущения
11.5 Допущений
11.5 Анадельный пример
11.6 Счетность расчета
11.7 Ввод SO 2 , O 2 , и N 2 количества
11.8 Молярные балансы серы, кислорода и азота
11.9 Баланс энтальпий
11.10 Расчет уровня L количества
11.11 Расчет матрицы
11.12 Подготовка нагрева HaterUp
11.13 Подача газа SO SO 2 Else Effect
11.14 Эффект температуры подачи газа
11.15 Значение положения и наклона обогрева
11.16 Сводка
11.17 Проблемы
12. Максимум так 2 окисление: точка пересечения кривой равновесия пути нагрева
12.1 Исходные спецификации
12.2 % SO 2 окисленный -температурные точки вблизи точки пересечения
12. 3 Обсуждение
3 Обсуждение
12.4 Влияние температуры подачи газа на перехват
12.5 неадекватных на % SO 2 окисленные в первом слое катализатора
12,6 эффект подачи газа SO SO 2 прочность на перехват
12.7 Незначительное влияние-равновесие давление
12,8 Незначительное влияние — O 2 прочность в исходном газе
12,9 Незначительное влияние — CO 2 в исходном газе
12,10 Разложение катализатора, SO 2 прочность и температура исходного газа 2 11 Максимальный подаваемый газ SO SO 2 SICK
12.12 Выходная газа Композиция ≡ Композиция перехвата Газовый состав
12.13 Сводка
12.14 Сводка
12.14 Сводка
13. Охлаждение первого катализатора Catalyst Code Exit Gas
13.1 Первый катализатор Сводка
13.2 Путь
13.3 Состав газа ниже равновесной кривой
13.4 Резюме
13.5 Проблема
Подсказки
14. Второй путь нагрева слоя катализатора
Второй путь нагрева слоя катализатора
14.1 Задача
14.2 % SO 2 Окисленные 2 Окисленные Оснащенные
14.3 Второй катализатор Круг нагрева Уайт
14.4 Определенный путь нагрева
14,5 вторым катализатором. 14.7 Баланс энтальпии12 Сводка
14.13 Проблема
14.13 Проблема
15. Максимальный SO 2 Окисление во втором слой катализатора
15.1 Вторым катализатором кроватей равновесие кривое уравнение
15,2 вторым катализатором кровати. Вычисление
15.3 Две кровать так 2 Эффективность окисления
15.4 Резюме
15.5 Проблемы
Подсказки
16. Третий слой катализатора SO 2 окисление
16.1 2-3 Путь охлаждения
16.2 PATH TOOTUP
16.3 HATHUP PATH-EVALIBIUM CURVE CRIVECT
16.4 Графическое представление
16.5 Summary
16.5 Summary
17. Так что 3 и CO 2 в подаче газовые
17. 1, так что 3
1, так что 3
17.2 SO 3 Эффекты
17.3 CO 2
217.4 CO 2 Эффекты
17.5 Сводка
17.6 Проблемы
17.6 Проблемы
18. Три катализатора кроваво-кислотный завод
18.1 Спецификации расчета
18.2 Пример расчета
18.3 Расчет результатов
18.3 Результаты расчетов
18.4 Три катализаторы Графики кроватей
18.5 Незначительный эффект — SO 3 в подаче газовый 40003
18.6 Minor Effect-CO 2 в Feed Gas
18,7 Малый воздействие — пластовое давление
18,8 Незначительное влияние — SO 2 прочность исходного газа
18,9 Незначительное влияние — O 2 прочность исходного газа
18,10 Краткое описание незначительных воздействий
18.11 Основные эффектные-катализаторы-кровати входные газа температуры
18.12 Обсуждение допущений книги
18013
Ссылка
19. После-H 2 SO 4 —
После-H 2 SO 4 —
19.1
19.2 Цели
19.3 After-H 2 SO 4 — выполнение расчетов
19.4 Расчет кривой равновесия
19.5 Расчет пути нагрева
Расчапляемая кривая обогрева-равновесие. % SO
2 окисленный после всех слоев катализатора20,2 Четыре слоя катализатора
20,3 Повышенная эффективность с пятью слоями катализатора
20.4 Входной температуру входного газа Эффект
20,5 Лучшая кровать для CS Catalyst
20,6 Трехместный контактный кислотный завод
20,7 Сводка
Ссылка
21. Энтальпии и энтальпии
21.1 Enthalpy Entalpies
21,2 H 2 SO 4 энтальпия входного газа
21.3 Теплопередача
21.4 Скорость теплопередачи
21.5 Резюме
21.6 Проблемы
22. Контроль температуры газа в обход 901 Обход принцип
22.2 Объектив
22.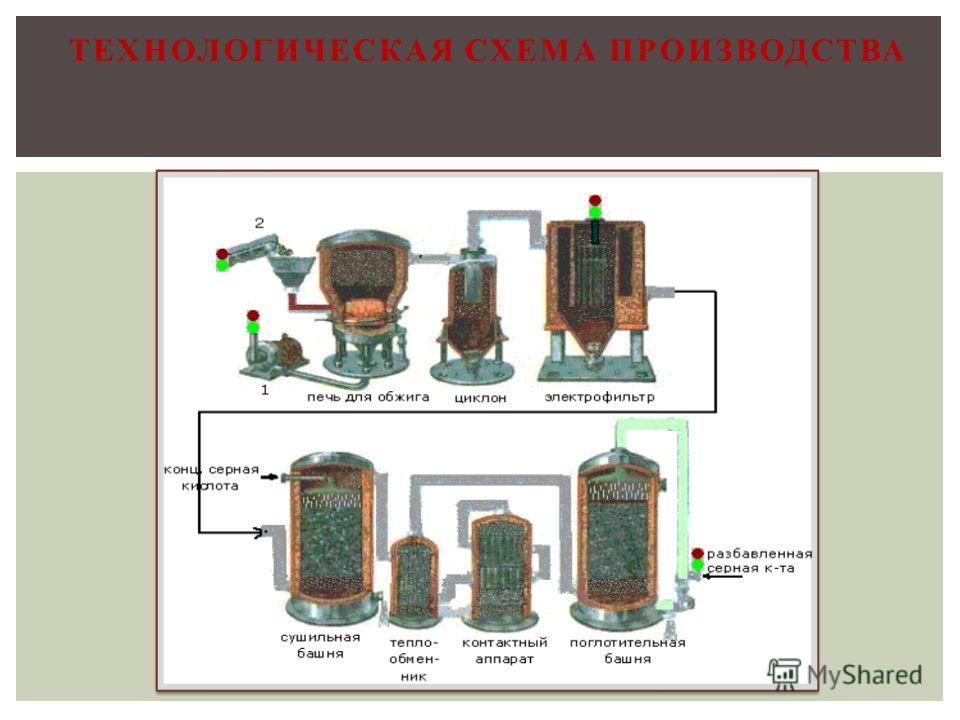 2 ГАЗ ДЛЯ ГОСУДАРСТВЕННОГО ТЕХНОГО ТЕХНОГО ТЕХНОГО ТЕХКОЛЯ
2 ГАЗ ДЛЯ ГОСУДАРСТВЕННОГО ТЕХНОГО ТЕХНОГО ТЕХНОГО ТЕХКОЛЯ
22.4 Требование теплопередачи для 480 К Экономэлизатор Выходной газ
22,5 Изменение тепловой передачи путем обхода
22,6 460 K Economizer Выходной газ
22.7 Обход для 460, Выходной газ экономайзера 470 и 480 К
22,8 Байпас для выходного газа экономайзера 470 К при изменении температуры входного газа
22,9 Промышленный байпас
22.10 Сводка
22.11 Проблемы
23. H 2 23. H
2 SO 4 Charting
29.1 Задачи
23.2 Органы массовых балансов
23.3.3. Исто за
5 3 входной массы23.4 H 2 O (G) ввод влажный кислотный газ на входе
23.5 Вода для полученной кислоты
23.6 Расчет массы воды на входе и массы кислоты на выходе
23.7 Интерпретации
23.8 Резюме
23.9 Задача
24.Контроль температуры кислотного температуры и рекуперации тепла
24. 1 Задачи
1 Задачи
24.2 Расчет выходной кислоты Температура
24.3. Эффектность ввода кислота Температура
24,4 Эффект от ввода ГАЗА Температура
24,5 Эффект входного газа SO 3 Концентрация по температуре кислоты на выходе
24.6 Регулировка температуры кислоты на выходе
24.7 Охлаждение кислоты
24.8 Целевая температура кислоты
24.9 Восстановление кислотного тепла в виде пара
24.10 Принципы производства пара
24.11 Башня двойной упакованной поглощения
24.12 Seam Injection
24.13 Разумная эффективность рекуперации тепла
24.14 Материалы строительства
24.15 Сводка
24.16 Проблемы
Ссылки
25. Производство серной кислоты из влажного исходного газа
25.1 Цели главы
25.2 Исходный газ WSA
25.3 Технологическая схема WSA
25.4 кроватей катализатора реакции
25.5. Подготовка окисленного газа для H 2 SO 4 (ℓ) конденсация
4 (ℓ) конденсация 4 (ℓ) Condensation25,6 H 2 SO 4 (ℓ) Condenser
25. 7 кислоты продукта
7 кислоты продукта
25.8 Сравнение с традиционное кислотное производство
25.9 Оценка
25.10 Альтернативы
25.11 Резюме
Ссылки
Рекомендуемое чтение
1 Процесс мокрого газа серной кислоты SO 2 Окисление
26.2 Инъекция наночастиц в процессу охлажденного газа
26.3 Серновая кислота Condensation
26.4 Выбор температуры конденсатора
26,5 Конденсаторная композиция вверх по стеклянной трубе
26.6 повторное испарение of H 2 O(ℓ)
26.7 Производительность конденсатора по кислоте
26.8 Оценка конденсатора
26.9 Резюме
Ссылки
Рекомендуемое чтение
SO 3 Рециркуляция газа для высоких 5165 2 Концентрационная обработка газа
27.1 Задачи
27.2 Вычисления
27.3 Влияние утилизации
27.3 Влияние рециркулирующей степени
27,4 Влияние температуры рециркуляции на требование у рециркуляции
27,5 эффект рециркуляции газа на первом катализатор SO 2 эффективность окисления
27,6 Влияние первой рециркуляции отходящего газа катализатора на общую производительность кислотной установки
27,7 Требования к оборудованию для рециркуляции
27. 8 Оценка
8 Оценка
27.9 Промышленные так 3 Рециркуляция газа
27.10 Альтернативы на рециркуляцию газа
27.11 Сводка
ссылки
28.
Серновые отведения
28. Серна из Удаления хвоста Газа
28.1 Задачи
28,3 Кислотные растения характеристики хвостовых газов
28.4 Методы очистки хвостовых газов промышленных кислотных установок
28.5 Выбор технологии (по Hay et al., 2003)
28.6 Капитал и эксплуатационные расходы
28.7 Сводка
Ссылки
29. Минимизация выбросов серы
29.1 промышленные каталитики SO 2 + 0,5O 2 → SO 3 Окисление
29.2 Методы для снижения выбросов серы
29.3 Резюме
Ссылки
Рекомендуемая литература
30. Материалы конструкции
30.1 Цели главы
30.2 Коэффициенты скорости коррозии для оборудования завода по производству серной кислоты
30.3 Сернослотные растительные материалы строительства
30.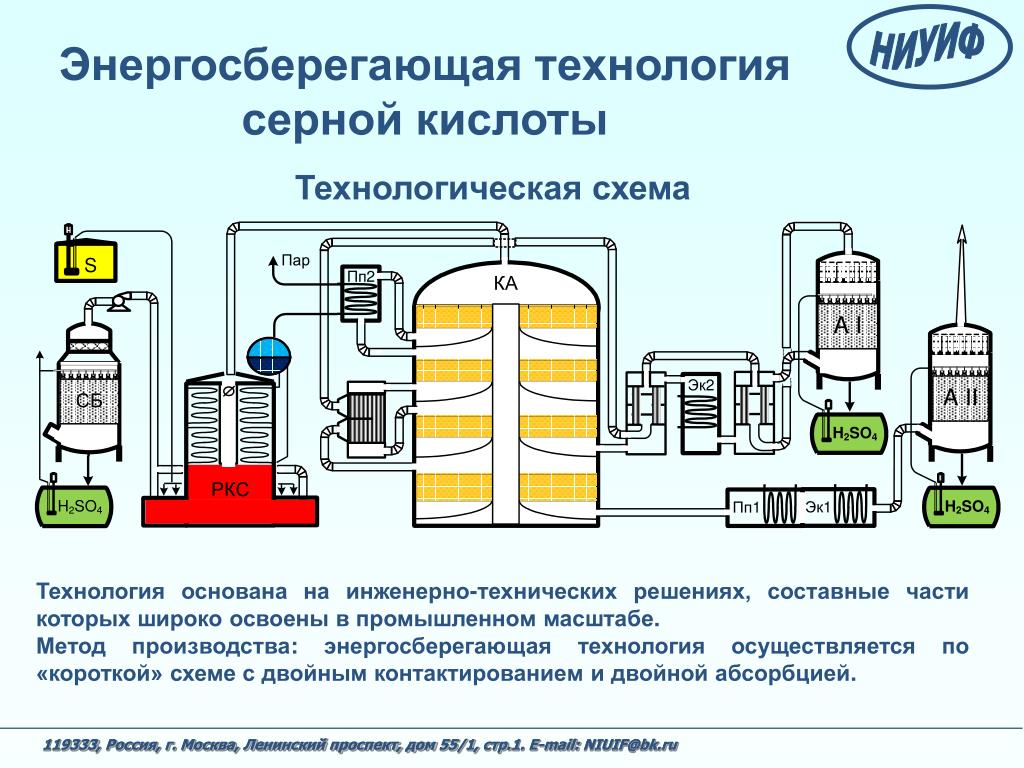 4 Сводка
4 Сводка
30.4 Сведения
31. Затраты
31. Затраты на производство серной кислоты
31.1 Инвестиционные затраты
31.2 Расходы на производство
31.3 Сводка
Ссылки
Приложение A. Свойства серной кислоты
А.1 Удельный вес серной кислоты при постоянной температуре
А.2 Удельный вес серной кислоты при повышенных температурах
А.3 Точки замерзания серной кислоты
А.4 Удельный вес олеума
А.5 Электропроводность серной кислоты
А.6 Абсолютная вязкость серной кислоты
Приложение Б. Вывод уравнения равновесия (10.12)
Б.1 Модифицированное уравнение равновесия
Б.2 Моль доли определены
B.3 Молярные количества сырья и окисленного газа
B.4 Мольные доли в окисленном газе
B.5 Применимость уравнения
B.6 Уравнение равновесия
B.7 Константа равновесия и молярные количества 9000
.8 Равновесие и Φ E Приложение C. Уравнения свободной энергии для расчета кривой равновесия
Уравнения свободной энергии для расчета кривой равновесия
C.1 Получение SO 3 (г) из SO 2 (г) и O 2 (г)
C.2 Получение H 2 SO 4 (г) из SO 3 (г) и H 2 O(г)
Приложение D. Подготовка кривой равновесия на рис. 10.2
D.1 Целочисленные расчеты температуры
D.2 Кривые равновесия второго и третьего слоев катализатора
Приложение E.Доказательство того, что объемный % = мольный % (для идеальных газов)
E.1 Определения
E.2 Характеристика парциальных объемов
E.3 Равенство объемного % и молярного %
Приложение F. Влияние CO 2 и Ar по уравнениям равновесия ( нет )
F.1 CO 2
F.2 Ar
F.3 Выводы
Приложение G. Уравнения энтальпии для расчета пути нагрева
G.1 Пример — Энтальпия SO 3 (г) при 600 К
Г.2 Составление уравнений
Литература
Приложение H. Решение матриц с использованием таблиц 11.2 и 14.2 в качестве примеров
Решение матриц с использованием таблиц 11.2 и 14.2 в качестве примеров
Приложение I. Уравнения энтальпии в ячейках матрицы пути нагрева
I.1 Примеры результатов
Приложение J. Кривая равновесия пути нагрева : Расчеты перехвата
J.1 Стратегия расчета
J.2 Рабочий лист
J.3 Инструкции по подготовке рабочего листа перехвата
J.4 Инструкции поиска цели
J.5 Другой пример. расчеты
M.1 Стратегия расчета
M.2 Спецификации (рис. 14.2)
M.3 Рабочий лист
M.4 Цель Поиск инструкций
Приложение N. Рабочий лист пути нагрева третьего слоя катализатора
Приложение O.Рабочий лист третьего слоя катализатора
Приложение P. Влияние исходного газа SO 3 на рис. 10.1 на уравнения равновесия
P.1 Молярные балансы
P.2 Всего кг моль окисленного газа
P.3 Мольные доли в окисленном газе
P.4 Новое уравнение равновесия
P.5 % SO 2 окислено в уравнении равновесия
P.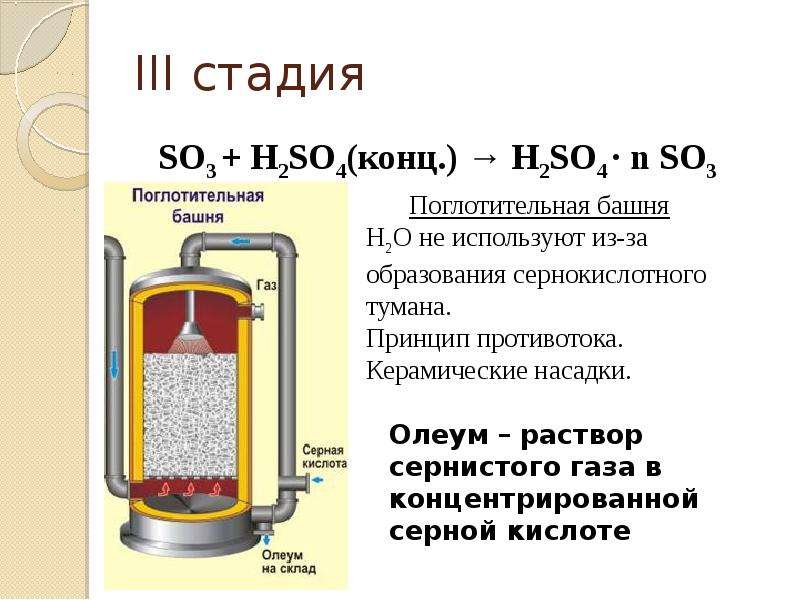 6 Равновесие % SO 2 окислено 900 Приложение В.SO 3 — таблица перехвата входного газа
6 Равновесие % SO 2 окислено 900 Приложение В.SO 3 — таблица перехвата входного газа
Приложение R. CO 2 — и SO 3 — таблица перехвата входного газа
Приложение S. Расчеты «конвертера» с тремя слоями катализатора
S.1 Расчеты первого слоя катализатора (ячейки с A1 по M47)
S.2 Расчеты второго слоя катализатора (ячейки с AA1 по AM47)
S.3 Расчеты третьего слоя катализатора (ячейки с BA1 по BM47)
Приложение T. Рабочий лист для расчета после-промежуточного-H 2 SO 4 — создание точек пересечения кривой равновесия пути нагрева
Приложение U.После-H 2 SO 4 -приготовление SO 2 окисление SO 3 и CO 2 во входящем газе
U.1 Уравнение равновесия с SO 3 дюйм15H 4 — расчет входящего газа
U.2 H 2 SO 4 расчет количества входящего газа
U. 3 H 2 SO 4 расчет количества выходящего газа
3 H 2 SO 4 расчет количества выходящего газа
3 U.4 90 H 2 SO 4 Изготовление объемных процентов отходящих газов
U.5 Конструкция и эксплуатация рабочего листа
U.6 Расчет % SO 2 окисленный после всех слоев катализатора
Приложение V. Влажный воздух в H 2 SO 4 расчеты
V.. Приложение W. Расчет H 2 SO 4 создание массовых потоков градирни
W.1 Характеристики входного и выходного газа
W.2 Входной SO 3 (g) уравнение
W.3 Входная и выходная кислота уравнения композиции
W.4 Уравнение баланса общей массы
W.5 Уравнение баланса серы
W.6 Решение для потоков
W.7 Влияние массового процента кислоты на выходе H 2 SO 4 на входные и выходные потоки кислоты
Приложение X , Уравнения равновесия для SO 2 , O 2 , H 2 O(г), исходный газ N2
X. 1 Уравнения равновесия
1 Уравнения равновесия
X.2 Модифицированные уравнения равновесия
X.3 Определены мольные доли 0
X.4 Молярные количества сырья и окисленного газа
X.5 Подготовка уравнений. (X.1) и (X.2) из уравнений (X.19) и (X.21)
Приложение Y. Расчеты рециркуляции отходящего газа охлажденного первого слоя катализатора
Y.1 Температура отходящего газа без рециркуляции
Y.2 Настройка расчета рециркуляции
Y.3 Матрица рециркуляции ( Таблица Y.2)
Y.3.2 Результат
Y.4 Пересчет на стационарное состояние
Y.5 Различные температуры подачи и рециркуляции
Y.6 Расчеты рециркуляции отходящего газа третьего слоя катализатора
Ответы на числовые задачи
Глава 10
Глава 11
Глава 12
Глава 12
Глава 13
Глава 14
Глава 15
Глава 16
Глава 17
Глава 19
Глава 21
Глава 22
Глава 220003
Глава 24
Индекс
.

 3. Блок-схема процесса обращения. Как показано выше, это экзотермическая реакция, поэтому для удовлетворительного выхода триоксида серы (выше 99.необходима конверсия 5%), используется настолько низкая температура, насколько это экономически возможно. Таким образом, от газа, выходящего из каждого слоя, отводится тепло с помощью теплообменников. Полученный триоксид серы удаляют между третьим и четвертым слоями и направляют на следующую стадию превращения триоксида серы в серную кислоту.
3. Блок-схема процесса обращения. Как показано выше, это экзотермическая реакция, поэтому для удовлетворительного выхода триоксида серы (выше 99.необходима конверсия 5%), используется настолько низкая температура, насколько это экономически возможно. Таким образом, от газа, выходящего из каждого слоя, отводится тепло с помощью теплообменников. Полученный триоксид серы удаляют между третьим и четвертым слоями и направляют на следующую стадию превращения триоксида серы в серную кислоту. 
