Производство спирт этиловый: Производство этилового спирта в мире в 2019 г достигло 131,3 млрд л, на 7% превысив уровнень 2015 г. :: РБК Магазин исследований
Статья 9. Оборот этилового спирта и спиртосодержащей продукции, поставки алкогольной продукции / КонсультантПлюс
Статья 9. Оборот этилового спирта и спиртосодержащей продукции, поставки алкогольной продукции
(в ред. Федерального закона от 18.07.2011 N 218-ФЗ)
(в ред. Федерального закона от 21.07.2005 N 102-ФЗ)
1. Утратил силу с 1 января 2021 года. — Федеральный закон от 22.12.2020 N 436-ФЗ.
2. Поставки этилового спирта, алкогольной и спиртосодержащей продукции для федеральных государственных нужд осуществляются в соответствии с законодательством Российской Федерации о поставках продукции для федеральных государственных нужд.
3. Абзац утратил силу с 1 января 2021 года. — Федеральный закон от 22.12.2020 N 436-ФЗ.
Перевозки этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции осуществляются организацией, которая имеет лицензии на перевозки соответственно этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции (далее — перевозчик), на основании договора перевозки, заключенного между перевозчиком и покупателем указанной продукции.
(абзац введен Федеральным законом от 18.07.2011 N 218-ФЗ; в ред. Федерального закона от 22.12.2020 N 436-ФЗ)
При этом договор поставки, заключенный между поставщиком-продавцом и покупателем указанной продукции, должен предусматривать переход права собственности на указанную продукцию к покупателю с момента ее сдачи перевозчику.
(абзац введен Федеральным законом от 18.07.2011 N 218-ФЗ)
Перевозки автомобильным транспортом этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции в объеме, превышающем 200 декалитров в год, должны осуществляться транспортными средствами организаций, оборудованными опломбированными данной организацией емкостями (цистернами) и (или) снаряженными прицепом (полуприцепом) с такими емкостями (цистернами) и находящимися в собственности, хозяйственном ведении или оперативном управлении таких организаций, и только при условии оснащения этих транспортных средств оборудованием для учета объема перевозок этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции и специальными техническими средствами регистрации в автоматическом режиме движения, опломбированными федеральным органом по контролю и надзору, которые обеспечивают передачу данных о перемещении этих транспортных средств по территории Российской Федерации, в том числе данных о текущем местоположении, пройденном маршруте, времени и местах стоянок, по спутниковым навигационным системам в единую государственную автоматизированную информационную систему (далее — специальные технические средства регистрации).
(в ред. Федерального закона от 22.12.2020 N 436-ФЗ)
Требования к автомобильному транспорту, к оборудованию для учета объема перевозок этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции в объеме, превышающем 200 декалитров в год, к специальным техническим средствам регистрации устанавливаются федеральным органом по контролю и надзору.
(в ред. Федерального закона от 22.12.2020 N 436-ФЗ)
Требования настоящего пункта не распространяются на перевозки этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции, помещенных под таможенную процедуру таможенного транзита.
(абзац введен Федеральным законом от 18.07.2011 N 218-ФЗ; в ред. Федерального закона от 22.12.2020 N 436-ФЗ)
Требования настоящего пункта не распространяются на перевозки этилового спирта и нефасованной спиртосодержащей продукции с содержанием этилового спирта более 25 процентов объема готовой продукции, указанные в абзацах пятом и восьмом пункта 1 статьи 18 настоящего Федерального закона.
(абзац введен Федеральным законом от 23.07.2013 N 232-ФЗ; в ред. Федеральных законов от 08.06.2020 N 166-ФЗ, от 22.12.2020 N 436-ФЗ)
4. Поставки этилового спирта (за исключением фармацевтической субстанции спирта этилового (этанола) осуществляются только организациями, которые имеют лицензии на производство, хранение и поставки произведенного этилового спирта.
(в ред. Федеральных законов от 27.12.2019 N 481-ФЗ, от 22.12.2020 N 436-ФЗ)
Поставки фармацевтической субстанции спирта этилового (этанола) осуществляются только организациями, которые имеют одновременно лицензию на производство этилового спирта для производства фармацевтической субстанции спирта этилового (этанола) и лицензию на производство лекарственных средств (фармацевтической субстанции спирта этилового (этанола).
(в ред. Федерального закона от 27.12.2019 N 481-ФЗ)
5. Утратил силу с 1 января 2021 года. — Федеральный закон от 22.12.2020 N 436-ФЗ.
6. Закупка (за исключением импорта) и поставки (за исключением экспорта) этилового спирта (за исключением биоэтанола) осуществляются по ценам не ниже цен, установленных регулирующим органом.
(п. 6 введен Федеральным законом от 18.07.2011 N 218-ФЗ; в ред. Федеральных законов от 28.11.2018 N 448-ФЗ, от 22.12.2020 N 436-ФЗ)
7. Закупка (за исключением импорта из государств, не являющихся членами ЕАЭС) и поставки (за исключением экспорта) этилового спирта (за исключением биоэтанола) осуществляются при условии представления в соответствии с законодательством Российской Федерации о налогах и сборах извещения об уплате авансового платежа акциза или извещения об освобождении от уплаты авансового платежа акциза.
(п. 7 введен Федеральным законом от 18.07.2011 N 218-ФЗ; в ред. Федеральных законов от 29.06.2015 N 182-ФЗ, от 28.11.2018 N 448-ФЗ)
Открыть полный текст документа
Усиливается контроль за деятельностью производителей этилового спирта
Сенаторы
одобрили изменения в закон о государственном регулировании производства и оборота этилового спирта и спиртосодержащей продукции.
Совет Федерации одобрил Федеральный закон «О внесении изменений в Федеральный закон «О государственном регулировании
производства и оборота этилового спирта, алкогольной и спиртосодержащей
продукции и об ограничении потребления (распития) алкогольной продукции» и о проведении на территории Калининградской области эксперимента по маркировке
алкогольной продукции федеральными специальными марками». Совершенствуется порядок
применения норм минимального использования производственной мощности в отношении основного технологического оборудования для производства этилового
спирта.
Смотрите также
Анатолий Дмитриевичпредставитель от исполнительного органа государственной власти Калужской области Сергеем Рябухиным, Рябухин
Сергей Николаевичпредставитель от законодательного (представительного) органа государственной власти Ульяновской области Андреем Епишиным, Епишин
Андрей Николаевичпредставитель от законодательного (представительного) органа государственной власти Тверской области
Константин Константиновичпредставитель от исполнительного органа государственной власти Мурманской области Ахматом Салпагаровым, Салпагаров
Ахмат Анзоровичпредставитель от законодательного (представительного) органа государственной власти Карачаево-Черкесской Республики Валерием Семеновым.
 Семенов
СеменовВалерий Владимировичпредставитель от законодательного (представительного) органа государственной власти Красноярского края
Как сообщил первый заместитель председателя Комитета СФ по бюджету и финансовым рынкам Сергей Рябухин, вносятся изменения, направленные на усиление контроля за деятельностью производителей этилового спирта.
Уточняются определения таких основных понятий, как мощность основного технологического оборудования для производства этилового спирта или алкогольной продукции, норма минимального использования производственной мощности, приостановление использования и уведомление о приостановлении или возобновлении использования такого оборудования.
Не допускается производство этилового спирта, если квартальный объем не соответствует норме минимального использования производственной мощности (70
процентов). В случае проведения ремонта основного технологического оборудования
для производства этилового спирта организация уведомляет об этом лицензирующий
орган по телекоммуникационным каналам связи в форме электронного документа,
подписанного квалифицированной электронной подписью, до даты начала ремонта.
Определяются признаки осуществляющих производство этилового спирта организаций, входящих в группу организаций (принадлежность одной из организаций более 70 процентов акций или долей в уставном капитале других организаций, осуществляющих производство этилового спирта, при этом суммарная производственная мощность основного технологического оборудования для производства этилового спирта группы организаций должна составлять не менее 20 миллионов декалитров в год).
Организациям,
входящим в группу организаций, и организациям, осуществляющим производство алкогольной
продукции с использованием этилового спирта, в случае невозможности соблюдения
нормы минимального использования производственной мощности предоставляется
возможность направить уведомление в форме электронного документа о приостановлении и возобновлении использования основного технологического
оборудования для производства этилового спирта или алкогольной продукции с использованием этилового спирта. Порядок направления в лицензирующий орган
таких уведомлений будет утверждаться уполномоченным федеральным органом
исполнительной власти.
Порядок направления в лицензирующий орган
таких уведомлений будет утверждаться уполномоченным федеральным органом
исполнительной власти.
Закрепляется возможность проведения эксперимента, предусматривающего применение в течение определенного периода специального регулирования в отношении маркировки федеральными специальными марками ввозимой в Российскую Федерацию алкогольной продукции с определением круга лиц и территории, на которые распространяется это специальное регулирование. Положение о проведении такого эксперимента должно утверждаться Правительством Российской Федерации.
Предписывается
провести на территории Калининградской области эксперимент по маркировке
федеральными специальными марками ввозимой в Российскую Федерацию алкогольной
продукции, помещенной под таможенную процедуру таможенного склада,
продолжительностью с 1 июня 2021 года по 31 мая 2023 года. Определены цели
проведения эксперимента, его участники, условия, при которых маркировка
алкогольной продукции, ввозимой в Российскую Федерацию осуществляться не будет. Правительству РФ надлежит утвердить положение о проведении эксперимента, в котором
определить участников эксперимента, условия их участия в эксперименте, порядок
проведения эксперимента и представления отчета о результатах его проведения.
Правительству РФ надлежит утвердить положение о проведении эксперимента, в котором
определить участников эксперимента, условия их участия в эксперименте, порядок
проведения эксперимента и представления отчета о результатах его проведения.
Организациям, имеющим на 1 июля 2021 года действующую лицензию на производство, хранение и поставки произведенного этилового спирта (за исключением винного, виноградного, плодового, коньячного, кальвадосного, вискового дистиллятов) или на производство этилового спирта для производства фармацевтической субстанции спирта этилового (этанола), предоставлено право продолжения производственной деятельности при условии выполнения ими нормы минимального использования производственной мощности, рассчитываемой по правилам Федерального закона. При этом установлена обязанность этих организаций подать до 31 октября 2021 года заявление о переоформлении лицензий, предусматривающее установление производственной мощности на квартал.
Спирт этиловый ректификованный из пищевого сырья сорта «Люкс»
Спирт этиловый ректификованный из пищевого сырья сорта «Люкс», СТБ 1334-2003.
Код ТН ВЭД 22 07 10 0000. Объем производства: до 90000 дал в месяц.
Получают в процессе ферментативного брожения пищевого растительного сырья (смеси зерновых культур). Применяется спирт этиловый ректификованный сорта «Люкс» в медицине, фармацевтической и ликероводочной промышленностях, в других отрасях народного хозяйства.
Потребителями спирта этилового ректификованного из пищевого сырья являются более 20 предприятий Республики Беларусь, осуществляются поставки на экспорт.
Спирт этиловый ректификованный из пищевого сырья ежегодно презентуется в международных конкурсах спиртов. Итак, в 2012 г. спирт был удостоен серебряной медалью, а в 2014 г. и 2015 г. — золотымси медалями.
Качественные характеристики спирта марки «Люкс»:
— Прозрачная, бесцветная жидкость без посторонних частиц с запахом характерным для этилового спирта, выработанного из соответствующего сырья, без привкуса и запаха посторонних веществ;
— Объемная доля этилового спирта, не менее 96,3 %;
— Проба на чистоту с серной кислотой – выдерживает;
— Проба на окисляемость при 20ºС не менее 22 мин. ;
;
— Массовая концентрация альдегидов, в пересчете на уксусный, в безводном спирте не более 2 мг/дм3;
— Массовая концентрация сивушного масла, в пересчете на смесь изоамилового и изобутилового спиртов (3:1), в безводном спирте не более 2 мг/дм3;
— Массовая концентрация эфиров, в пересчете на уксусно-этиловый, в безводном спирте не более 10 мг/дм3;
— Объемная доля метилового спирта, в пересчете на безводный спирт не более 0,03 %;
— Массовая концентрация свободных кислот (без CO2), в безводном спирте не более 8 мг/дм3;
— Содержание фурфурола – не допускается.
Условия поставки: ж.д. транспортом (в ж.д. цистернах до 59 тонн или танк-контейнерах), самовывоз автомобильным транспортом в соответствии с правилами транспортировки опасных грузов.
Система менеджмента качества разработки и производства спирта этилового ректификованного из пищевого сырья соответствует требованиям СТБ ИСО 9001 – 2001.
Система управления окружающей средой производства спирта этилового ректификованного из пищевого сырья соответствует требованиям СТБ ИСО 14001 – 2005.
Отпуск спирта осуществляется по нарядам, выданным концерном «Белгоспищепром» г. Минск в установленном порядке. Цена устанавливается Министерством экономики.
ОПТИМИЗАЦИЯ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА ПРОИЗВОДСТВА СИНТЕТИЧЕСКОГО И ГИДРОЛИЗНОГО ЭТИЛОВЫХ СПИРТОВ | Попов
ОПТИМИЗАЦИЯ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА ПРОИЗВОДСТВА СИНТЕТИЧЕСКОГО И ГИДРОЛИЗНОГО ЭТИЛОВЫХ СПИРТОВ
Валерий Павлович Попов, Евгений Владимирович Ганин, Саида Жалгоспановна Рахумова, Юлия Сергеевна Боронина, Николай Николаевич Мартынов
Аннотация
Синтез этилового спирта – жидкого искусственного топлива, который широко используется в медицине и парфюмерии, при изготовлении взрывчатых веществ, лаков, красок продолжает развиваться. Ранее этиловый спирт получали, в основном, из зернового сырья, картофеля, патоки и других пищевых продуктов, в которых содержится крахмал или сахар, необходимые для сбраживания сырья. При этом содержащийся в сырье сахар сбраживается дрожжами и превращается в этиловый спирт и углекислый газ. Миллионы тонн зерна и картофеля использовались для этих целей ежегодно. Необходимость сохранить эти продукты и привела к созданию технологии производства синтетического этилового спирта. Преимущество такого спирта в его дешевизне и меньших трудовых затратах по сравнению с традиционными способами. Однако технология производства синтетического этилового спирта сложнее традиционной. На сегодняшний день производство синтетического этилового спирта обусловлено большим расходом ресурсов и энергии. В связи с этим в данной статье рассматривается проведение оптимизации технологии получения синтетического спирта методом гидратации для снижения энергоемкости процесса и повышения ресурсосбережения. Другим перспективным способом производства синтетического спирта является способ с применением гидролиза целлюлозосодержащего сырья, так как актуальной задачей является проблема утилизации отходов сельского хозяйства.
При этом содержащийся в сырье сахар сбраживается дрожжами и превращается в этиловый спирт и углекислый газ. Миллионы тонн зерна и картофеля использовались для этих целей ежегодно. Необходимость сохранить эти продукты и привела к созданию технологии производства синтетического этилового спирта. Преимущество такого спирта в его дешевизне и меньших трудовых затратах по сравнению с традиционными способами. Однако технология производства синтетического этилового спирта сложнее традиционной. На сегодняшний день производство синтетического этилового спирта обусловлено большим расходом ресурсов и энергии. В связи с этим в данной статье рассматривается проведение оптимизации технологии получения синтетического спирта методом гидратации для снижения энергоемкости процесса и повышения ресурсосбережения. Другим перспективным способом производства синтетического спирта является способ с применением гидролиза целлюлозосодержащего сырья, так как актуальной задачей является проблема утилизации отходов сельского хозяйства. Данный способ позволяет сэкономить необходимые для продовольственной безопасности пищевые ресурсы, в частности глюкозу. В связи с этим важным аспектом являлось изучение влияния отдельных параметров на выход глюкозы при производстве спирта из отходов агропромышленного комплекса.
Данный способ позволяет сэкономить необходимые для продовольственной безопасности пищевые ресурсы, в частности глюкозу. В связи с этим важным аспектом являлось изучение влияния отдельных параметров на выход глюкозы при производстве спирта из отходов агропромышленного комплекса.
Ключевые слова
этиловый спирт;гидролизный спирт;гидратация;гидролиз;оптимизация;удельные затраты энергии;выход спирта;ethyl alcohol;hydrolytic alcohol;hydration;hydrolysis;optimization;specific energy consumption;alcohol yield;
Полный текст:
PDFЛитература
Ганин Е.В., Мартынов Н.Н., Антимонов С.В., Мартынова Д.В. Исследование влияния различных агрессивных сред на физические и химические свойства резин // Инновации в науке. 2019. № 1 (89). С. 28-31.
Рахумова С.Ж., Попов В.П. Оптимизация технологического процесса производства синтетического этилового спирта // Перспективные разработки науки и техники: матер.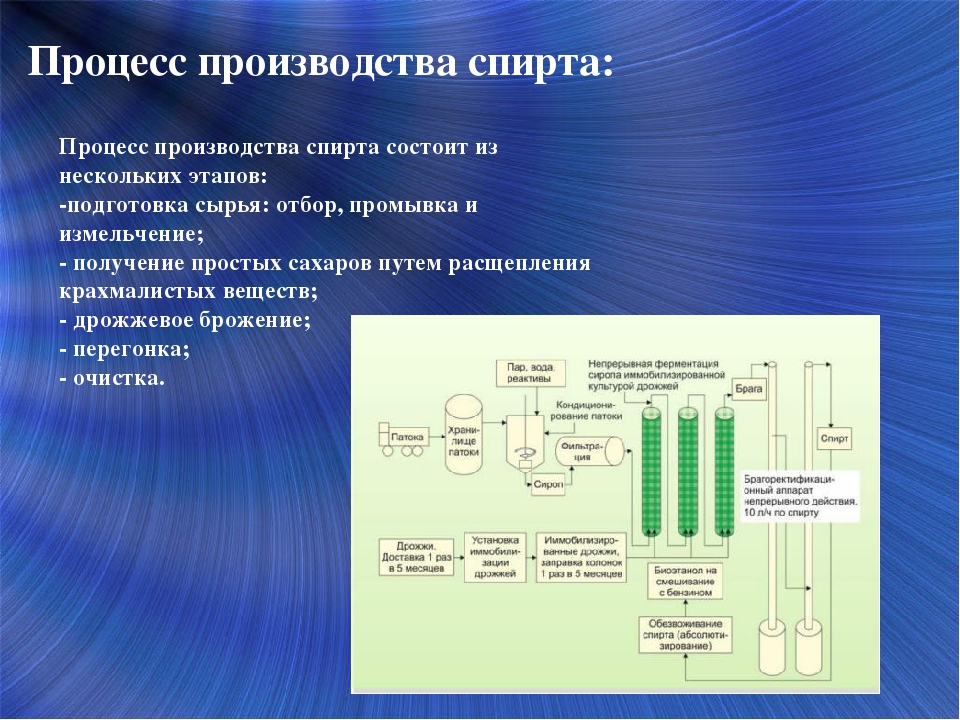 XII Междунар. науч.-практ. конф. Пшемысль, 2016. С. 66-70.
XII Междунар. науч.-практ. конф. Пшемысль, 2016. С. 66-70.
Сушкова В.И. Разработка технологии безотходного производства этилового спирта и кормовых белковых продуктов на гидролизных заводах: дис. … д-ра биол. наук. Киров: Изд-во ВГУ, 2004. 418 с.
Терентьев В.С. Совершенствование производства синтетического этилового спирта методом прямой гидратации этилена (на примере ОАО «Уфаоргсинтез»): дис. … канд. техн. наук. Уфа: Изд-во УГНТУ, 2000. 138 с.
Туршатов М.В. Разработка энергосберегающей технологии этилового спирта на основе новых способов подготовки сырья: дис. … канд. техн. наук. М.: Изд-во ВНИИПБТ, 2009. 132 с.
DOI: http://dx.doi.org/10.17122/ogbus-2019-3-195-210
Ссылки
- На текущий момент ссылки отсутствуют.
© 2021 УГНТУ.
Все права защищены.
Производство пищевого этилового спирта — ГИПХ
Рис.1 Наращивание тарельчатой ректификационной колонны насадочной царгой.
АО «РНЦ «Прикладная химия(ГИПХ)« разработал высокоэффективную энергосберегающую технологию, содержащую ряд «ноу-хау», и оригинальную аппаратуру для выделения этилового спирта марок «Люкс» и «Альфа» по ГОСТ Р 51652-2000 из бражного дистиллята, в том числе полученного на основе дефектного зерна, с выходом товарного продукта 98…99,5 % от спирта, содержащегося в бражном дистилляте. Также разработаны установки для получения спирта этилового марки «Высшей очистки», «Базис» и «Экстра» из головной (эфироальдегидной фракции) и установки для выделения изоамилового, изобутилового и др. спиртов из сивушного масла спиртовой промышленности. ОАО «Тамбовский завод «Комсомолец» совместно с АО «РНЦ «Прикладная химия (ГИПХ)» освоил выпуск колонной аппаратуры нового поколения и производство установок по переработке ЭАФ и сивушного масла со сдачей их «под ключ».В качестве эпюрационной и ректификационной колонн, а также колонн по переработке ЭАФ и сивушного масла используются высокоэффективные массообменные аппараты нового поколения с регулярной насадкой из профилированной сетки (из нержавеющей стали 12Х18Н10Т). Диаметр этих колонн примерно в 1,5…2 раза, а высота в 1,2…1,4 раза меньше, чем у традиционно используемых в России колонн с колпачковыми тарелками при равной производительности и эффективности.
Диаметр этих колонн примерно в 1,5…2 раза, а высота в 1,2…1,4 раза меньше, чем у традиционно используемых в России колонн с колпачковыми тарелками при равной производительности и эффективности.
В то же время при равной высоте насадочных и тарельчатых колонн, колонны с регулярной насадкой имеют в 1,5…2 раза большую эффективность, что позволяет отделять даже микропримеси, содержащиеся в этиловом спирте и существенно влияющие на органолептические показатели. Колонны устойчиво работают в широком диапазоне нагрузок (например, при уменьшении нагрузки в 10 раз эффективность разделения не снижается, в то время как тарельчатые колонны при таких колебаниях нагрузок вообще перестают работать). Кроме того, за счет высокого запаса по эффективности насадочные колонны, в отличие от тарельчатых, обеспечивают требуемое качество продукта даже при существенных колебаниях состава и качества исходного сырья. За счет использования высокоэффективных колонн и оригинальной технологии выделения обеспечивается максимальный выход целевого продукта на 3…4 % выше, чем в известных технологиях. Обследовано более 50 предприятий спиртовой промышленности (Россия, Украина, Белоруссия, Узбекистан, Казахстан, Вьетнам). Разработаны конкретные предложения по их модернизации. Модернизировано 27 предприятий спиртовой промышленности (Россия, Белоруссия, Казахстан, Вьетнам) с использованием регулярных насадок нового поколения, разработанных АО «РНЦ «Прикладная химия (ГИПХ)», что обеспечило гарантированный выпуск спирта марки «Люкс» с улучшенными показателями даже при использовании некондиционного сырья. На ряде спиртовых производств успешно внедрен способ модернизации существующих тарельчатых колонн путем их наращивания насадочными блоками. Опыт эксплуатации насадочных колонн показал, что, являясь основным модулем брагоректификационных установок, они малоинерционны, легко и быстро выводятся на режим, устойчивы в работе, просты в управлении и обеспечивают высокий выход спирта.
Обследовано более 50 предприятий спиртовой промышленности (Россия, Украина, Белоруссия, Узбекистан, Казахстан, Вьетнам). Разработаны конкретные предложения по их модернизации. Модернизировано 27 предприятий спиртовой промышленности (Россия, Белоруссия, Казахстан, Вьетнам) с использованием регулярных насадок нового поколения, разработанных АО «РНЦ «Прикладная химия (ГИПХ)», что обеспечило гарантированный выпуск спирта марки «Люкс» с улучшенными показателями даже при использовании некондиционного сырья. На ряде спиртовых производств успешно внедрен способ модернизации существующих тарельчатых колонн путем их наращивания насадочными блоками. Опыт эксплуатации насадочных колонн показал, что, являясь основным модулем брагоректификационных установок, они малоинерционны, легко и быстро выводятся на режим, устойчивы в работе, просты в управлении и обеспечивают высокий выход спирта.
В раздел «Ректификация и дистилляция»
Усилен контроль за производством медицинского спирта — Российская газета
Полгода назад вступили в силу поправки в федеральные законы № 171-ФЗ и 61-ФЗ, регулирующие производство и оборот фармацевтической субстанции спирта этилового (этанола).
Непрерывный учет производства и оборота фармацевтической субстанции фиксируется системой учета ЕГАИС и отслеживается на всех этапах производства, отгрузки, перевозки и получения фармацевтической субстанции фармфабриками.
На протяжении первой половины 2021 года производитель фармацевтической субстанции отмечает усиление контроля государственных органов за своим предприятием, но при этом предприятие выполняет все плановые отгрузки.
Так, российская фармацевтическая компания АО «РФК» в первом полугодии в полной мере обеспечила потребности рынка в фармацевтической субстанции спирте этиловом (этаноле).
В июне 2021-го бенефициарным владельцем «РФК» стала госкорпорация «Ростех» — одна из крупнейших промышленных компаний России, объединяющая более 800 научных и производственных организаций в 60 регионах страны.
Ключевые направления деятельности госкорпорации — авиастроение, радиоэлектроника, медицинские технологии, инновационные материалы и др. В портфель корпорации входят такие известные бренды, как АВТОВАЗ, КАМАЗ, ОАК, «Вертолеты России», ОДК, Уралвагонзавод, «Швабе», Концерн «Калашников», НПО «Микроген», ФОРТ и др. «Ростех» активно участвует в реализации всех 12 национальных проектов. Почти треть выручки компании обеспечивает экспорт высокотехнологичной продукции.
«Ростех» активно участвует в реализации всех 12 национальных проектов. Почти треть выручки компании обеспечивает экспорт высокотехнологичной продукции.
«Новый акционер в лице госкорпорации «Ростех» в рамках развития компании «РФК» — это стратегически важный этап в решении тех задач в фармацевтической отрасли, которыми мы занимаемся уже много лет. Объединяя наши компетенции, возможности и опыт мы сможем вывести на рынок новые продукты и составить конкуренцию зарубежным поставщикам на внутреннем рынке», — рассказал генеральный директор АО «РФК» Владимир Верескунов.
Производимая компанией «РФК» субстанция является главной составляющей многих необходимых лекарственных препаратов, в том числе вакцин
К концу 2021 года «РФК» планирует запустить производство фармацевтической субстанции «Этанол абсолютированный 99,5%» в рамках реализации совместного проекта с компанией «Фармстандарт». Субстанция уже зарегистрирована в Государственном реестре лекарственных средств, а промышленное производство планируется начать в 3-4 квартале этого года. Сегодня фармацевтические производители вынуждены закупать абсолютированный спирт за границей, цена на него зависит от колебаний валютных курсов.
Сегодня фармацевтические производители вынуждены закупать абсолютированный спирт за границей, цена на него зависит от колебаний валютных курсов.
«В этой связи выражаем надежду на эффективную и оперативную работу всех структур, задействованных в реализации программы по импортозамещению для скорейшего начала производства отечественного абсолютированного этанола», — отметил Верескунов Владимир.
К декабрю 2021 года также планируется завершить процедуры по вхождению в структуру компании «РФК» еще нескольких крупных предприятий, в том числе в новых для компании направлениях.
Справка
Российская фармацевтическая компания АО «РФК» ведет свою деятельность с 2007 года и в течение короткого времени зарекомендовала себя как надежный поставщик фармацевтических субстанций спирта этилового (этанола) и лекарственных препаратов антисептического действия, в том числе входящих в перечень жизненно необходимых и важнейших лекарственных препаратов.
Получаемая фармацевтическая субстанция используется компанией не только для производства собственных готовых лекарственных форм. Ее активно закупают ведущие предприятия фармацевтической отрасли России и иностранные компании для производства собственных лекарственных средств.
Ее активно закупают ведущие предприятия фармацевтической отрасли России и иностранные компании для производства собственных лекарственных средств.
Производимая субстанция является главной составляющей многих лекарственных препаратов, в том числе закупается производителями вакцин и используется в производстве жизненно необходимых и важнейших лекарственных препаратов.
Линии производства спирта – СНПО
Линии производства спирта
Предназначено для строительства высокорентабельного, компактного, малоэнергоемкого, безотходного и экологически чистого спиртзавода с высоким уровнем механизации и автоматизации.
Сырьем для производства спирта может служить как зерно, так и крахмалосодержащее сырье: картофель, топиока, маниока, а также меласса и другая сельскохозяйственная продукция, содержащая сахар и крахмал.
Освоено производство нормального ряда заводов производительностью 100, 250, 500, 1000, 1500, 2000, 3000, 6000 дал. в сутки. Спиртзаводы производительностью 100 и 250 дал/сутки работают по периодической схеме, большей производительности – по непрерывной.
в сутки. Спиртзаводы производительностью 100 и 250 дал/сутки работают по периодической схеме, большей производительности – по непрерывной.
Комплект поставки включает:
- емкостное, теплообменное и колонное оборудование;
- водокольцевые вакуумные и химические насосы;
- трубопроводную арматуру;
- контрольно-измерительные приборы, автоматику и др.
Предоставляется также компьютерное и программное обеспечение.
Основными преимуществами является безотходное экологически чистое производство, возможность размещения на территории сельскохозяйственных и перерабатывающих производств, попутное производство высококалорийного корма для сельскохозяйственных животных с повышеным содержанием белка, дрожжевых компонентов и микроэлементов, возможность получения технического спирта для двигателей внутреннего сгорания.
Технико-технологические показатели спиртзаводов:
| Потребление сырья, материалов, энергоносителей | ||||||
| Сырье зерно (50 % крахмала), т | 3,1 | 7,75 | 15,5 | 31,0 | 46,5 | 62,0 |
| Антисептики кислота серная (100%), кг хлорная известь, кг | 2,3 2,5 | 5,75 6,25 | 11,5 12,5 | 23,0 25,0 | 34,5 37,5 | 46,0 50,0 |
| Питательные вещества карбамид, кг кислота ортофосфорная, кг | 0,6 0,2 | 1,5 0,5 | 3,0 1,0 | 6,0 2,0 | 9,0 6,0 | 12,0 4,0 |
| Осахаривающие материалы термамил, л Сан-Супер, л | 0,31 1,53 | 0,78 3,83 | 1,55 7,65 | 3,1 15,3 | 4,65 23,0 | 6,2 30,6 |
| Вода охлаждающая, м3 питьевая,м3 | 126 15 | 315 38 | 630 75 | 1260 150 | 1890 225 | 2520 300 |
| Энергоносители пар (6 ата), т электроэнергия, кВт/ч | 12 190 | 30 475 | 60 950 | 120 1900 | 180 2850 | 240 3800 |
| Оборудование количество, шт.  масса, т | 90 32 | 122 69 | 134 97 | 142 148 | 150 198 | 185 400 |
| Производственная площадь | ||||||
| технологический корпус, м2 | 300 | 300 | 400 | 820 | 980 | 1150 |
| Сменный технологический персонал | ||||||
| рабочие профессии, чел. ИТР, чел. | 16 1 | 20 2 | 20 3 | 24 5 | 24 6 | 28 8 |
| Продукция, побочные продукты | ||||||
| Продукция спирт этиловый ректификованный высшей очистки, дал.  | 95,9 | 239,75 | 479,5 | 959,0 | 1438,5 | 1918,0 |
| Побочные продукты головная фракция этилового спирта, дал. сивушное масло, дал. послеспиртовая барда, м3 | 3,0 0,3 12,0 | 7,5 0,75 30,0 | 15,0 1,5 60,0 | 30 3,0 120,0 | 45 4,5 180,0 | 60 6,0 240,0 |
Центр данных по альтернативным видам топлива: Производство этанола
Этанол — это альтернативное топливо местного производства, которое чаще всего производится из кукурузы. Он также производится из целлюлозного сырья, такого как пожнивные остатки и древесина, хотя это встречается не так часто. Заводы по производству этанола в США сконцентрированы на Среднем Западе из-за близости к производству кукурузы. Заводы за пределами Среднего Запада обычно получают кукурузу по железной дороге или используют другое сырье и расположены недалеко от крупных населенных пунктов.
Заводы за пределами Среднего Запада обычно получают кукурузу по железной дороге или используют другое сырье и расположены недалеко от крупных населенных пунктов.
Производство
Способ производства этанола зависит от типа используемого сырья.Этот процесс короче для исходного сырья на основе крахмала или сахара, чем для целлюлозного сырья.
Производство этанола на основе крахмала и сахара
Большая часть этанола в Соединенных Штатах производится из сельскохозяйственных культур на основе крахмала путем сухой или мокрой переработки. Почти 90% заводов по производству этанола — это сухие заводы из-за более низких капитальных затрат. Сухой помол — это процесс измельчения кукурузы в муку и ее ферментации до этанола с побочными продуктами из зерен дистилляторов и углекислого газа. Установки мокрого помола в основном производят кукурузные подсластители, а также этанол и некоторые другие побочные продукты (например, кукурузное масло и крахмал).Мокрые мельницы разделяют крахмал, белок и клетчатку в кукурузе перед переработкой этих компонентов в такие продукты, как этанол.
Производство целлюлозы
Производство этанола из целлюлозного сырья, такого как трава, древесина и растительные остатки, является более сложным процессом, чем использование крахмальных культур. Существует два основных пути производства целлюлозного этанола: биохимический и термохимический. Биохимический процесс включает предварительную обработку для высвобождения сахаров гемицеллюлозы с последующим гидролизом для разложения целлюлозы на сахара.Сахар ферментируется в этанол, а лигнин извлекается и используется для производства энергии, необходимой для процесса. Процесс термохимического преобразования включает добавление тепла и химикатов к сырью биомассы для получения синтез-газа, который представляет собой смесь монооксида углерода и водорода. Синтез-газ смешивается с катализатором и превращается в этанол и другие жидкие побочные продукты.
Чтобы узнать больше о процессе конверсии, см. Дизайн процесса и экономика биохимического преобразования лигноцеллюлозной биомассы в этанол: предварительная обработка разбавленной кислотой и ферментативный гидролиз кукурузной соломы и Дизайн процесса и экономика биохимического преобразования лигноцеллюлозной биомассы в этанол: термохимический путь путем Косвенная газификация и смешанный синтез спиртов.
Схема системы распределения топлива
Источник: Дин Армстронг, Национальная лаборатория возобновляемых источников энергии
Распределение
Большинство заводов по производству этанола в США сосредоточено на Среднем Западе, но потребление бензина выше всего на Восточном и Западном побережьях (используйте TransAtlas, чтобы увидеть расположение заводов по производству этанола). По данным Министерства сельского хозяйства США, 90% этанола транспортируется поездом или грузовиком. Оставшиеся 10% в основном транспортируются баржами, при этом минимальные объемы транспортируются по трубопроводам.В 2019 году США потребили почти 14,6 миллиарда галлонов этанола; автоцистерна может перевозить от 8 000 до 10 000 галлонов этанола, а один железнодорожный вагон может перевозить приблизительно 30 000 галлонов этанола.
Этанол, смесь бензина и присадки доставляются отдельно на топливные терминалы, где они смешиваются с бензовозами для доставки на станции.
Трубопроводы этанола
Подача этанола по трубопроводу является наиболее эффективным вариантом, но сродство этанола к воде и свойствам растворителей требует использования выделенного трубопровода или значительной очистки существующих трубопроводов, чтобы преобразовать их в выделенные трубопроводы.Kinder Morgan отправляет партии этанола по трубопроводу Центральной Флориды. Для получения дополнительной информации см. Проект этанола по трубопроводу Центральной Флориды.
Объяснение этанола — Управление энергетической информации США (EIA)
Этанол производится из биомассы
Этанол — это возобновляемое биотопливо, потому что оно производится из биомассы. Этанол — это прозрачный бесцветный спирт, полученный из различных материалов биомассы, которые называются сырьем , (сырье, используемое для производства продукта).Производители топливного этанола в США в основном используют пищевые зерна и культуры с высоким содержанием крахмала и сахара в качестве исходного сырья для производства этанола, такого как кукуруза, сорго, ячмень, сахарный тростник и сахарная свекла. Этанол также можно производить из трав, деревьев и сельскохозяйственных и лесных отходов, таких как кукурузные початки и запасы, рисовая солома, опилки и древесная щепа. Этанол получают из этого сырья несколькими способами.
Этанол также можно производить из трав, деревьев и сельскохозяйственных и лесных отходов, таких как кукурузные початки и запасы, рисовая солома, опилки и древесная щепа. Этанол получают из этого сырья несколькими способами.
Ферментация — наиболее распространенный метод производства топливного этанола
В наиболее распространенных сегодня процессах производства этанола дрожжи используются для сбраживания крахмала и сахаров кукурузы, сахарного тростника и сахарной свеклы.Кукуруза является основным сырьем для топливного этанола в Соединенных Штатах из-за ее изобилия и относительно низкой исторической цены. Крахмал в зернах кукурузы ферментируется до сахара, который затем ферментируется до спирта.
Сахарный тростник и сахарная свекла — наиболее распространенное сырье, используемое для производства топливного этанола в других частях мира. Поскольку алкоголь производится путем ферментации сахара, сахарные посевы легче всего превратить в алкоголь. Бразилия, второй по величине производитель топливного этанола в мире после США, делает большую часть своего топливного этанола из сахарного тростника. Большинство автомобилей в Бразилии могут работать на чистом этаноле или на смеси бензина и этанола.
Большинство автомобилей в Бразилии могут работать на чистом этаноле или на смеси бензина и этанола.
Исследователи Министерства сельского хозяйства США добавляют дрожжи для начала ферментации этанола
Фото: Скотт Бауэр, Служба сельскохозяйственных исследований Министерства сельского хозяйства США (общественное достояние)
Целлюлозный этанол является крупным потенциальным источником топливного этанола
Этанол также можно получить, расщепляя целлюлозу в растительных волокнах.Этот целлюлозный этанол считается передовым биотопливом и требует более сложного и дорогостоящего производственного процесса, чем ферментация. Однако существуют большие потенциальные источники целлюлозного сырья для непродовольственных культур. Деревья, травы и сельскохозяйственные остатки являются потенциальным сырьем для производства целлюлозного этанола. Деревьям и травам для роста требуется меньше энергии, удобрений и воды, чем для выращивания зерновых, и их также можно выращивать на землях, которые не подходят для выращивания продовольственных культур. Ученые создали быстрорастущие деревья, которые вырастают в полный размер за 10 лет. Многие травы могут давать два урожая в год в течение многих лет без ежегодной пересадки. Несмотря на технический потенциал производства целлюлозного этанола, экономичное производство было труднодостижимым, и в Соединенных Штатах было произведено только относительно небольшое количество целлюлозного топливного этанола.
Ученые создали быстрорастущие деревья, которые вырастают в полный размер за 10 лет. Многие травы могут давать два урожая в год в течение многих лет без ежегодной пересадки. Несмотря на технический потенциал производства целлюлозного этанола, экономичное производство было труднодостижимым, и в Соединенных Штатах было произведено только относительно небольшое количество целлюлозного топливного этанола.
История этанола
В 1850-х годах этанол был основным топливом для освещения. Во время гражданской войны этанол был обложен налогом на спиртные напитки, чтобы собрать деньги на войну.Налог настолько увеличил цену этанола, что он больше не мог конкурировать с другими видами топлива, такими как керосин. Производство этанола резко сократилось из-за этого налога, и уровни производства не начали восстанавливаться до тех пор, пока налог не был отменен в 1906 году.
Автомобиль модели Т
Источник: стоковая фотография (защищена авторским правом)
Модель T работала на этаноле
В 1908 году Генри Форд сконструировал свою модель T, очень ранний автомобиль, работающий на смеси бензина и спирта. Форд назвал эту смесь топливом будущего. В 1919 году, когда начался Сухой закон, этанол был запрещен, потому что он считался алкогольным напитком. Его можно было продать только в смеси с нефтью. Этанол снова стал использоваться в качестве топлива после прекращения сухого закона в 1933 году.
Форд назвал эту смесь топливом будущего. В 1919 году, когда начался Сухой закон, этанол был запрещен, потому что он считался алкогольным напитком. Его можно было продать только в смеси с нефтью. Этанол снова стал использоваться в качестве топлива после прекращения сухого закона в 1933 году.
Большинство автомобильных бензинов в настоящее время содержат топливный этанол
Использование этанола временно увеличилось во время Второй мировой войны, когда не хватало нефти и других ресурсов. В 1970-х годах интерес к этанолу как транспортному топливу возродился, поскольку нефтяные эмбарго, рост цен на нефть и растущая зависимость от импортируемой нефти повысили интерес к альтернативным видам топлива.С тех пор использование и производство этанола стимулировалось налоговыми льготами и экологическими нормативами, требующими более экологически чистого топлива.
В 2005 году Конгресс принял Стандарт по возобновляемым видам топлива, который установил минимальные требования к использованию возобновляемых видов топлива, включая этанол. В 2007 году целевые показатели использования возобновляемого топлива RFS должны были неуклонно расти до уровня 36 миллиардов галлонов к 2022 году. В 2020 году в США было израсходовано около 12,6 миллиардов галлонов топливного этанола.Большая часть автомобильного бензина, продаваемого в настоящее время в Соединенных Штатах, составляет около 10% по объему топливного этанола.
В 2007 году целевые показатели использования возобновляемого топлива RFS должны были неуклонно расти до уровня 36 миллиардов галлонов к 2022 году. В 2020 году в США было израсходовано около 12,6 миллиардов галлонов топливного этанола.Большая часть автомобильного бензина, продаваемого в настоящее время в Соединенных Штатах, составляет около 10% по объему топливного этанола.
Последнее обновление: 21 июня 2021 г.
Производство этилового спирта | General MicroScience
Ферментация этилового спирта
1] Введение
Этиловый спирт также называют этанолом. Этанол производится биологическим процессом, в котором сахара, такие как глюкоза, фруктоза, сахароза, превращаются в спирт и диоксид углерода.Брожение проводится в анаэробных условиях. Этанол — летучая и легковоспламеняющаяся жидкость.
Спиртовое брожение было первым брожением, осуществленным человеком. Раньше спирт использовался только для потребления, но позже стали известны различные способы его применения, такие как универсальный растворитель и химическое сырье, дезинфицирующее средство для поверхностей, лекарственный растворитель, антисептик. Так был запущен метод производства спирта путем ферментации на ликероводочных заводах.
Так был запущен метод производства спирта путем ферментации на ликероводочных заводах.
Субстраты, используемые при ферментации этилового спирта, являются отходами ферментационной промышленности, такими как сахариды, крахмал и целлюлозный материал. Бактерии, а также грибки могут превращать сахар в спирт. Обычно спирт получают путем ферментации или нефтехимического процесса.
Структура этанола
2] Микроорганизмы, используемые в ферментации
Микроорганизм, используемый для ферментации, зависит от типа сырья, используемого для ферментации.
- Если в качестве субстрата используются крахмал и сахар, то в качестве ферментационного организма используется Saccharomyces cerevisiae или Saccharomyces ellipsoideus.
- Ферментация спирта из молочных отходов Используется Candida pseudotropicalis .
- Если сульфитный отработанный щелок используется в бумажной промышленности, то для ферментации используется штамм Candida utilis .

Микроорганизм ферментации выбран из
- Используемый штамм должен давать высокий выход продукта.
- Штамм должен быть быстрорастущим и допускать высокую концентрацию сахара, чтобы обеспечивать высокий выход продукта.
- Микроорганизм должен быть генетически стабильным.
3] Приготовление посевного материала
Инокулят, добавленный в бродильный чан, представляет собой дрожжевую культуру. В процессе ферментации этанола требуется большое количество инокулята. Инокулят, добавляемый в процессе ферментации, обычно составляет 4%, но иногда может быть добавлено от 8% до 10% инокулята.
Состав питательных сред, используемых для приготовления инокулята, аналогичен составу сред для ферментации. В процессе приготовления посевного материала питательные среды улучшаются за счет высокой степени аэрации и перемешивания. Это важно для быстрого роста клеток. Оптимальная поддерживаемая температура составляет от 28 ° C до 30 ° C, а оптимальный pH составляет от 4,8 до 5. Поддержание оптимальных условий в средах для приготовления иннокулята важно для роста и производства клеточной массы.
Поддержание оптимальных условий в средах для приготовления иннокулята важно для роста и производства клеточной массы.
4] Сырье, используемое для ферментации
В качестве сырья для ферментации этанола используются различные промышленные и сельскохозяйственные отходы.
- Использованный целлюлозный материал содержит сульфитный отработанный щелок, солому.
- Крахмалистый материал, такой как кукурузный крахмал, картофельный крахмал и пшеничная мука.
- Используются сахариды, такие как патока сахарного тростника, патока свекольная, гидрол, фруктовые соки.
5] Ферментационная среда
Сырье, используемое при ферментации, должно быть экономически дешевым.Он должен быть легкодоступным, в основном сельскохозяйственные отходы используются в качестве сырья для ферментации этанола. Обычно меласса используется в Индии для ферментации. Используемые сельскохозяйственные отходы должны быть предварительно обработаны для удаления нежелательных, токсичных продуктов, а сырье преобразовано в сахарную форму. Таким образом, этот сахар может быть легко использован иннокулятом и производить большое количество этанола. Меласса, используемая для ферментации, предварительно обрабатывается, а содержание сахара в патоке разбавляется и доводится до 10–18%.
Таким образом, этот сахар может быть легко использован иннокулятом и производить большое количество этанола. Меласса, используемая для ферментации, предварительно обрабатывается, а содержание сахара в патоке разбавляется и доводится до 10–18%.
Свекольная патока также добавляется в среду в качестве источника биотина, поскольку это один из важных факторов роста. Источник азота добавляется в виде сульфата аммония или фосфата аммония в концентрации около 0,015%. Оптимальный pH, поддерживаемый ферментационной средой, составляет примерно от 4,8 до 5, а оптимальная поддерживаемая температура составляет от 28 ° C до 30 ° C. В этом случае ферментации нет необходимости в стерилизации среды, может быть проведена только пастеризация этой среды.
6] Восстановление
Перебродивший бульон дают отстояться для отстаивания продукта и далее его перегоняют методом фракционной перегонки.Продукт перегоняют с использованием анализатора и ректификационной колонны. Полученный дистиллированный продукт — этиловый спирт и сивушное масло. Получаемый продукт: спирт этиловый 95% и вода 5%.
Получаемый продукт: спирт этиловый 95% и вода 5%.
Дистилляционная установка лабораторного масштаба
7] По продуктам
Побочные продукты, полученные после ферментации
- Стоки ликероводочного завода. Стоки ликероводочного завода представляют собой не что иное, как сивушное масло. Это сивушное масло используется в производстве парфюмерии, в лакокрасочной промышленности, отработанные смывки содержат соли калия, используемые при производстве калийных удобрений.
- Остаточные дрожжевые клетки используются при приготовлении кормов.
- Произведенный диоксид углерода очищается и используется в виде сухого льда или в безалкогольных напитках.
Как производится этанол? | Давайте поговорим о науке
AB Биология 20 (2007 г., обновлено 2014 г.) 11 Блок C: Фотосинтез и клеточное дыхание
AB
Биология 20 (2007 г. , обновлено 2014 г.)
11
Блок D: Человеческие системы
, обновлено 2014 г.)
11
Блок D: Человеческие системы
AB Химия 30 (2007 г., обновлено 2014 г.) 12 Блок A: Термохимические изменения
AB Химия 30 (2007 г., обновлено 2014 г.) 12 Блок C: Химические изменения органических соединений
AB Наука 30 (2007 г., обновлено 2014 г.) 12 Блок D: Энергия и окружающая среда
До нашей эры Анатомия и физиология 12 (июнь 2018 г.) 12 Большая идея: гомеостаз поддерживается физиологическими процессами.
До нашей эры Химия 11 (июнь 2018) 11 Большая идея: органическая химия и ее приложения имеют большое значение для здоровья человека, общества и окружающей среды.
МБ 11 класс биологии (2010) 11 Раздел 2: Пищеварение и питание
МБ Химия 11 класс (2006) 11 Тема 5: Органическая химия
МБ 12 класс химии (2013) 12 Тема 3: Химическая кинетика
NB Биология 112/111 (2008) 11 Блок 3: Поддержание динамического равновесия I
NB Химия 121/122 (2009) 12 Раздел 1: Термохимия
NB Химия 121/122 (2009) 12 Блок 2: От растворов к кинетике к равновесию
NB Химия 121/122 (2009) 12 Раздел 4: Органическая химия
NL Биология 2201 (2002) 11 Блок 3: Поддержание динамического равновесия I
NL Химия 2202 (2018) 11 Раздел 3: Органическая химия
NL Химия 3202 (2005) 12 Блок 1: От кинетики к равновесию
NS Химия 11 (2009) 11 Органическая химия
NS Химия 12 (2009) 12 Растворы, кинетика и равновесие
NS Химия 12 (2009) 12 Термохимия
NT
Биология 20 (Альберта, 2007 г. , обновлено 2014 г.)
11
Блок C: Фотосинтез и клеточное дыхание
, обновлено 2014 г.)
11
Блок C: Фотосинтез и клеточное дыхание
NT Биология 20 (Альберта, 2007 г., обновлено 2014 г.) 11 Блок D: Человеческие системы
NT Химия 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок A: Термохимические изменения
NT Химия 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок C: Химические изменения органических соединений
NT Наука 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок D: Энергия и окружающая среда
НУ Биология 20 (Альберта, 2007 г., обновлено 2014 г.) 11 Блок C: Фотосинтез и клеточное дыхание
НУ Биология 20 (Альберта, 2007 г., обновлено 2014 г.) 11 Блок D: Человеческие системы
НУ Химия 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок A: Термохимические изменения
НУ Химия 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок C: Химические изменения органических соединений
НУ Наука 30 (Альберта, 2007 г., обновлено 2014 г.) 12 Блок D: Энергия и окружающая среда
НА Биология, 11 класс, Колледж (SBI3C) 11 Строка B: клеточная биология
НА Биология, 12 класс, Университет (SBI4U) 12 Направление B: Биохимия
НА Биология, 12 класс, Университет (SBI4U) 12 Нить D: молекулярная генетика
НА Химия, 12 класс, техникум (СЧ5С) 12 Строка C: органическая химия
НА Химия, 12 класс, ВУЗ (СЧ5У) 12 Направление B: органическая химия
НА Химия, 12 класс, ВУЗ (СЧ5У) 12 Нить D: изменение энергии и скорость реакции
НА Экология, 11 класс, Университет / колледж (SVN3M) 11 Направление B: Научные решения современных экологических проблем
НА Экология, 11 класс, Университет / колледж (SVN3M) 11 Strand F: Сохранение энергии
НА Экология, 11 класс, рабочее место (SVN3E) 11 Strand D: Энергосбережение
НА Естественные науки, 12 класс, университет / колледж (SNC4M) 12 Strand D: Наука о питании
НА Естественные науки, 12 класс, университет / колледж (SNC4M) 12 Strand F: Биотехнологии
НА Естественные науки, 12 класс, рабочее место (SNC4E) 12 Направление C: химические вещества в потребительских товарах
PE Биология 521A (2010) 11 Поддержание динамического равновесия I
PE
Химия 521А (проект 2021 г. )
11
Знание содержания: СК 3.1
)
11
Знание содержания: СК 3.1
PE Химия 621А (проект 2021 г.) 12 Знание содержания: CK 2 .2
PE Science 7e année (2016) (только на французском) 7 Тема 2: L’univers vivant — Понятие D: Режимы воспроизведения
КК Прикладная наука и технологии Раздел III Технологический мир
КК Химия Раздел V Энергетические изменения в реакциях
КК Химия Раздел V Скорость реакции
КК Наука и технология Раздел III Технологический мир
SK Биология 30 (2016) 12 Генетика и биотехнология
SK Химия 30 (2016) 12 Химическая связь и материаловедение
SK Наука о здоровье 20 (2016) 11 Питание
YT Анатомия и физиология 12 (Британская Колумбия, июнь 2018 г.) 12 Большая идея: гомеостаз поддерживается физиологическими процессами.
YT
Chemistry 11 (Британская Колумбия, июнь 2018 г.)
11
Большая идея: органическая химия и ее приложения имеют большое значение для здоровья человека, общества и окружающей среды.
Фактов об использовании, преимуществах и химической безопасности этанола
Ответы на вопросы
Какие продукты содержат этанол?
Бренды и конфеты с алкогольной начинкой являются примерами продуктов, содержащих этанол. Другие пищевые продукты, такие как сливовый пудинг и фруктовый пирог, могут содержать этанол, если для ароматизации и консервирования используются дистиллированные спирты.
Для чего используется этиловый спирт?
Этиловый спирт используется для изготовления алкогольных напитков, например вина, пива и спиртных напитков. Этиловый спирт также можно использовать в качестве растворителя.
Как производится этанол?
В Соединенных Штатах этанол в основном производится путем ферментации крахмала в кукурузном зерне. В топливной промышленности на предприятиях биопереработки используются современные технологии для преобразования зерна, напитков и пищевых отходов, целлюлозной биомассы и другого сырья в высокооктановый этанол.
Почему алкоголь входит в состав жидкости для полоскания рта?
Спирт добавляется в жидкость для полоскания рта, чтобы растворить другие ингредиенты и помочь важным активным ингредиентам, таким как ментол, эвкалиптол и тимол, проникнуть в зубной налет.
Почему алкоголь входит в состав моего сиропа от кашля?
Многие жидкости от кашля и простуды и другие безрецептурные продукты содержат некоторое количество алкоголя. В составе спирт помогает растворить активные ингредиенты или сохранить продукт.
Какие продукты содержат этанол?
Бренды и конфеты с алкогольной начинкой являются примерами продуктов, содержащих этанол.Другие пищевые продукты, такие как сливовый пудинг и фруктовый пирог, могут содержать этанол, если для ароматизации и консервирования используются дистиллированные спирты.
Для чего используется этиловый спирт?
Этиловый спирт используется для изготовления алкогольных напитков, например вина, пива и спиртных напитков. Этиловый спирт также можно использовать в качестве растворителя.
Этиловый спирт также можно использовать в качестве растворителя.
Как производится этанол?
В Соединенных Штатах этанол в основном производится путем ферментации крахмала в кукурузном зерне.В топливной промышленности на предприятиях биопереработки используются современные технологии для преобразования зерна, напитков и пищевых отходов, целлюлозной биомассы и другого сырья в высокооктановый этанол.
Почему алкоголь входит в состав жидкости для полоскания рта?
Спирт добавляется в жидкость для полоскания рта, чтобы растворить другие ингредиенты и помочь важным активным ингредиентам, таким как ментол, эвкалиптол и тимол, проникнуть в зубной налет.
Почему алкоголь входит в состав моего сиропа от кашля?
Многие жидкости от кашля и простуды и другие безрецептурные продукты содержат некоторое количество алкоголя.В составе спирт помогает растворить активные ингредиенты или сохранить продукт.
границ | Повышение производства этанола в электрохимической ячейке с помощью Saccharomyces cerevisiae (CDBT2) и Wickerhamomyces anomalus (CDBT7)
Введение
Зависимость от транспортного топлива на основе нефти — серьезная проблема для развивающихся стран, не имеющих запасов ископаемого топлива. Проблема серьезна в странах, не имеющих выхода к морю, таких как Непал (Joshi et al., 2011). Фактически страны, не имеющие выхода к морю, тратят большую часть своего ВВП на импорт ископаемого топлива через другие страны. Учитывая вышесказанное, предпринимаются серьезные попытки разработать альтернативные источники энергии, которые, как ожидается, помогут решить указанную выше проблему. Биоэтанол — одно из возобновляемых и экологически чистых видов топлива (Khatiwada and Silveira, 2011). Помимо использования в качестве топлива, биоэтанол также может использоваться для других целей, таких как производство биопластиков (Rose and Palkovits, 2011) и разработка топливных элементов на этаноле для производства электроэнергии (Saisirirat and Joommanee, 2017).
Биотопливо второго поколения, такое как биоэтанол (полученный из лигноцеллюлозы), можно производить как в сельских, так и в городских районах с использованием легкодоступной лигноцеллюлозной биомассы. Лигноцеллюлоза — самая распространенная биомасса в мире, годовое производство которой составляет около 1000 гига-метрических тонн. Биомасса представляет собой смесь целлюлозы, гемицеллюлозы, лигнина и других компонентов, таких как пектин. Целлюлоза и гемицеллюлоза при разложении производят ферментируемые сахара, например глюкозу и ксилозу. Эти сахара могут быть далее преобразованы в важные продукты, включая этанол, путем ферментации.Объем этанола, который может быть произведен лигноцеллюлозной биомассой, зависит от состава сахаров, который варьируется в зависимости от растений и среды обитания, в которой они растут (Hermosilla et al., 2017; Joshi et al., 2018). На сегодняшний день стоимость производства этанола из лигноцеллюлозной биомассы зависит от используемой технологии. Чем лучше техника, тем ниже стоимость производства (Haque, Epplin, 2012).
Дрожжи, такие как S. cerevisiae , широко используются для ферментации этанола. Наиболее ценными в этом процессе являются дрожжи с высокой толерантностью к соли и этанолу.Кроме того, для эффективного производства этанола из лигноцеллюлозных гидролизатов дрожжи должны уметь использовать как глюкозу, так и пентозы, такие как ксилоза и арабиноза. Это связано с тем, что лигноцеллюлозная биомасса богата как глюкозой, так и ксилозой (пентозой) (Joshi et al., 2018). Это главный недостаток использования одного только S. cerevisiae , поскольку он не может сбраживать глюкозу и ксилозу. Соответственно, идентификация штаммов дрожжей, которые могут сбраживать как глюкозу, так и ксилозу, имеет решающее значение, если нет, по крайней мере, использовать два разных штамма дрожжей, которые способны утилизировать эти сахара независимо.В этом исследовании мы идентифицировали и использовали высокоэффективные, устойчивые к соли и этанолу штаммы дрожжей, , а именно S. cerevisiae (CDBT2) (Joshi et al. , 2014) и ксилозу, использующую аномальный Вт ( Вт) (CDBT7). для производства этанола из лигноцеллюлозной биомассы.
, 2014) и ксилозу, использующую аномальный Вт ( Вт) (CDBT7). для производства этанола из лигноцеллюлозной биомассы.
Для увеличения производства этанола может быть использована технология электро-ферментации, сочетающая традиционную ферментацию с электрохимией. Электроферментация — это новый процесс, в котором микробный ферментативный метаболизм можно контролировать электрохимически.Преимущества этого процесса заключаются в том, что процесс (i) является селективным, (ii) увеличивает эффективность использования сахара (углерода), (iii) сводит к минимуму использование добавок для окислительно-восстановительного баланса или контроля pH, (iv) усиливает рост клеток и ( v) в некоторых случаях повышают извлечение продукта (Schievano et al., 2016). Электроды, используемые в электрохимической ячейке, могут действовать как поглотители электронов, как источник электронов или поляризовать ионы, присутствующие в микробах, что обеспечивает несбалансированный рост. Такие электрохимические модификации также оказывают значительное влияние не только на метаболизм и клеточную регуляцию, но и на межвидовые взаимодействия, а также на выбор микробных популяций (Moscoviz et al. , 2016). Новые штаммы дрожжей S. cerevisiae (CDBT2) и W. аномальный (CDBT7), идентифицированные в нашей лаборатории, используются в этом исследовании для определения лучшего использования глюкозы и ксилозы из лигноцеллюлозной биомассы и увеличения производства этанола в электрохимическая ячейка. Лигноцеллюлозная биомасса, использованная в исследовании, была получена из Saccharum spontaneum , предварительно обработанного горячей водой при 100 ° C в течение 2 часов с последующим гидролизом 0,5 M соляной кислоты (Joshi et al., 2018).
, 2016). Новые штаммы дрожжей S. cerevisiae (CDBT2) и W. аномальный (CDBT7), идентифицированные в нашей лаборатории, используются в этом исследовании для определения лучшего использования глюкозы и ксилозы из лигноцеллюлозной биомассы и увеличения производства этанола в электрохимическая ячейка. Лигноцеллюлозная биомасса, использованная в исследовании, была получена из Saccharum spontaneum , предварительно обработанного горячей водой при 100 ° C в течение 2 часов с последующим гидролизом 0,5 M соляной кислоты (Joshi et al., 2018).
Материалы и методы
Материалы
Тканый графитовый войлок (толщина 10 мм) был приобретен у Nippon Co., Nippon, Japan. Платиновая проволока (диаметр 0,2 мм), высококачественный нейтральный красный, этанол и тионилхлорид были приобретены у Sigma Chemical Co., Сент-Луис, Миссури, США. Сосуды для электрохимических ячеек (ECC), изготовленные из стекла Pyrex, были приобретены у Adams and Chittenden Scientific Glass Co. , Калифорния, США. Мембрана Nafion 117 была приобретена у DuPont Co., Уилмингтон, Делавэр, США. Гексагидрат гексахлороплатината (IV) водорода (Kanto Chemicals Company, Япония) был любезно предоставлен профессором д-ром Амаром Прасадом Ядавом, Центральный химический факультет, Трибхуванский университет, Непал. D-глюкоза, динитросалициловая кислота (DNSA), тартрат натрия и калия, дрожжевой экстракт, пептон, сульфат аммония и альгинат натрия были приобретены у Hi-Media Company, Бангалор, Индия. Все остальные химические вещества были аналитической чистоты и были доступны на месте.
, Калифорния, США. Мембрана Nafion 117 была приобретена у DuPont Co., Уилмингтон, Делавэр, США. Гексагидрат гексахлороплатината (IV) водорода (Kanto Chemicals Company, Япония) был любезно предоставлен профессором д-ром Амаром Прасадом Ядавом, Центральный химический факультет, Трибхуванский университет, Непал. D-глюкоза, динитросалициловая кислота (DNSA), тартрат натрия и калия, дрожжевой экстракт, пептон, сульфат аммония и альгинат натрия были приобретены у Hi-Media Company, Бангалор, Индия. Все остальные химические вещества были аналитической чистоты и были доступны на месте.
Образцы биомассы S.spontaneum был собран в помещениях кампуса Трибхуванского университета, Киртипур, Катманду, Непал, в августе. Место отбора проб было 27,6818 ° с.ш. и 85,2865 ° ю.ш. Надземную часть собранного образца сушили на воздухе в течение 24 ч и разрезали на кусочки размером около 2 см. Далее его сушили в печи при 60 ° C в течение 24 часов. Сухие образцы измельчали с помощью блендера. Смешанную биомассу просеивали с использованием сит 250–500 мкм и упаковывали в пластиковые пакеты для дальнейшего использования в исследованиях ферментации.
Методы
Производство этанола в электрохимической ячейке
Разработка посевных материалов CDBT2 и CDBT7
Консервированные штаммы дрожжей CDBT2 (номер доступа банка генов MK910215) и CDBT7 (номер доступа банка генов MK910216) использовали для создания инокулятов. Инокуляты получали путем инокуляции заполненных петлей агаровых культур штаммов CDBT2 и CDBT7 в среду PYN (пептон, дрожжевой экстракт и питательные вещества) (пептон: 3,5 г · л -1 , дрожжевой экстракт: 3 г · л -1 , KH 2 PO 4 : 2 г · л -1 , MgSO4: 1 г · л -1 и (NH 4 ) 2 SO 4 : 1 г · л -1 ) (Balakumar and Arasaratnam, 2012) с добавлением 5% глюкозы.Их культивировали в орбитальном шейкере в течение 18 ч при 30 ° C и pH 5,0.
Конструкция электрохимической ячейки (ЭХЯ)
Анодная и катодная камеры ECC были собраны плотно с использованием резиновой прокладки с нафионовой мембраной, которая разделяет две камеры (рис. 1). Рабочий объем катодного и анодного отсеков составлял ~ 300 мл каждое. Обычный графитовый войлок (11 см × 3 см × 1 см) использовался в качестве катода, а платиновая проволока (диаметр 0,2 мм, длина 1 м) использовалась в качестве анода.Каждый раз добавляли 1,2 мл соответствующего посевного материала, приготовленного выше, с 300 мл среды PYN в каждом случае.
1). Рабочий объем катодного и анодного отсеков составлял ~ 300 мл каждое. Обычный графитовый войлок (11 см × 3 см × 1 см) использовался в качестве катода, а платиновая проволока (диаметр 0,2 мм, длина 1 м) использовалась в качестве анода.Каждый раз добавляли 1,2 мл соответствующего посевного материала, приготовленного выше, с 300 мл среды PYN в каждом случае.
Рисунок 1 . Электрохимический элемент (ECC): ECC был собран с использованием сборки топливного элемента из стекла Pyrex, как показано на рисунке, разделенного нафионовой мембраной с использованием герметичной резиновой прокладки. Электроды вставляли через небольшие отверстия в каждой из крышек камеры и затем подключали к блоку питания для подачи внешнего напряжения.
Оптимизация производства этанола в ECC
Штаммы дрожжей CDBT2 и CDBT7 культивировали в ECC (рис. 1) и оценивали продукцию этанола в присутствии источников углеводов, т.е.е. глюкоза (5%) и гидролизат лигноцеллюлозной биомассы (с 3,3% редуцирующего сахара). Гидролизат лигноцеллюлозной биомассы был приготовлен путем сбора гидролизата, который образовался после предварительной обработки биомассы Saccharum spontaneum (размер 250–500 мкм) горячей водой при 100 ° C в течение 2 часов с последующим гидролизом 0,5 М HCl в течение 24 часов. 5% -ный гидролизат глюкозы или биомассы действовал как источник углеводов (Joshi et al., 2018). Состав СМИ PYN добавлен в качестве дополнений. Среда для ферментации в ECC без культуры и внешнего источника напряжения служила контролем.Два отсека ECC были заполнены средой PYN с добавлением глюкозы или гидролизата лигноцеллюлозной биомассы, инокулированы штаммами дрожжей и позволяли производить этанол в присутствии и отсутствии приложенного напряжения при оптимизированном pH 5,5 и 30 ° C (Joshi et al. , 2014).
Гидролизат лигноцеллюлозной биомассы был приготовлен путем сбора гидролизата, который образовался после предварительной обработки биомассы Saccharum spontaneum (размер 250–500 мкм) горячей водой при 100 ° C в течение 2 часов с последующим гидролизом 0,5 М HCl в течение 24 часов. 5% -ный гидролизат глюкозы или биомассы действовал как источник углеводов (Joshi et al., 2018). Состав СМИ PYN добавлен в качестве дополнений. Среда для ферментации в ECC без культуры и внешнего источника напряжения служила контролем.Два отсека ECC были заполнены средой PYN с добавлением глюкозы или гидролизата лигноцеллюлозной биомассы, инокулированы штаммами дрожжей и позволяли производить этанол в присутствии и отсутствии приложенного напряжения при оптимизированном pH 5,5 и 30 ° C (Joshi et al. , 2014).
Производство этанола штаммами дрожжей CDBT2 и CDBT7 под приложенным напряжением
В первой реакции ферментации штаммы дрожжей CDBT2 и CDBT7 культивировали в катодной и анодной камерах соответственно. Во второй реакции ферментации штаммы дрожжей CDBT2 и CDBT7 культивировали в анодной и катодной камерах соответственно. В каждой из вышеуказанных реакций на ECC постоянно подавали 4 В. Производство этанола дрожжевыми штаммами CDBT2 и CDBT7 в ECC контролировали с интервалами 12 ч, как описано Seo et al. (2009). Образец бульона (1 мл), собранный из ECC, первоначально центрифугировали при 4000 × g в течение 15 минут для удаления клеточного дебриса. Затем супернатант смешивали с 1 мл трин-бутилфосфата (ТВФ), встряхивали в течение 15 минут и центрифугировали при 4000 × g в течение 15 минут для разделения слоев.Около 750 мкл верхнего слоя ТВР переносили в другую пробирку и смешивали с таким же количеством подкисленного реагента 5% дихромата калия. Смесь встряхивали, центрифугировали, как описано выше, и нижний зеленый слой (слой реагента дихромата калия) отделяли, и его оптическую плотность измеряли при 595 нм с использованием спектрофотометра против холостого опыта. Рост клеток контролировали путем измерения мутности культурального бульона при 600 нм.
Во второй реакции ферментации штаммы дрожжей CDBT2 и CDBT7 культивировали в анодной и катодной камерах соответственно. В каждой из вышеуказанных реакций на ECC постоянно подавали 4 В. Производство этанола дрожжевыми штаммами CDBT2 и CDBT7 в ECC контролировали с интервалами 12 ч, как описано Seo et al. (2009). Образец бульона (1 мл), собранный из ECC, первоначально центрифугировали при 4000 × g в течение 15 минут для удаления клеточного дебриса. Затем супернатант смешивали с 1 мл трин-бутилфосфата (ТВФ), встряхивали в течение 15 минут и центрифугировали при 4000 × g в течение 15 минут для разделения слоев.Около 750 мкл верхнего слоя ТВР переносили в другую пробирку и смешивали с таким же количеством подкисленного реагента 5% дихромата калия. Смесь встряхивали, центрифугировали, как описано выше, и нижний зеленый слой (слой реагента дихромата калия) отделяли, и его оптическую плотность измеряли при 595 нм с использованием спектрофотометра против холостого опыта. Рост клеток контролировали путем измерения мутности культурального бульона при 600 нм. Снижение концентрации понижающего сахара в образцах бульонов измеряли методом DNSA (Miller, 1959).
Снижение концентрации понижающего сахара в образцах бульонов измеряли методом DNSA (Miller, 1959).
Образование пленки в графитовом электроде дрожжами
Образование биопленок анализировали с помощью сканирующей электронной микроскопии (SEM). После завершения эксперимента в ECC графитовые электроды, которые использовались в качестве катода с культурами CDBT2 и CDBT7, упаривали в вакууме и упаковывали в стерильный пластиковый пакет. Образцы были отправлены в Advanced Instrumental Lab, Университет Джавахарлала Неру, Нью-Дели, Индия для SEM. Образование биопленки было подтверждено микрофотографией.
Производство этанола на CDBT2 и CDBT7 при разном напряжении
Чтобы определить оптимальный источник внешнего напряжения для производства этанола, напряжение ECC менялось от 0 до 5 В (± 0.1 В) с интервалом 1 В и производство этанола измеряли, как указано выше.
Сравнение продукции этанола CDBT7 с несколькими штаммами S. cerevisiae
Для сравнения эффективности продукции этанола CDBT2 с другими S. cerevisiae , производство этанола в анодном отсеке ECC контролировали путем культивирования штаммов S. cerevisiae , полученных из различных источников. Штаммы дрожжей MKY09 (лабораторный штамм дрожжей) и Ethanol Red (промышленный штамм дрожжей) любезно предоставлены проф.Экхард Боле, Франкфуртский университет, Германия. Штамм дрожжей MKY09, трансформированный плазмидой pGPD2, в которую вставлен ген лакказы (pGPD2 / lac), был разработан в Центральном департаменте биотехнологии Трибхуванского университета, Непал (Bishwakarma, 2017). Плазмида pGPD2 / lac была сконструирована путем клонирования синтетического гена лакказы Ganoderma lucidum размером 1576 п.н. в векторе экспрессии pGPD2, приобретенном у Addgene Company. Сконструированную плазмиду трансформировали в штамм MKY09. Штамм дрожжей CDBT7 во всех случаях культивировали в катодном отсеке.Две камеры были разделены нафионовой мембраной. Производство этанола измеряли, как описано выше.
cerevisiae , производство этанола в анодном отсеке ECC контролировали путем культивирования штаммов S. cerevisiae , полученных из различных источников. Штаммы дрожжей MKY09 (лабораторный штамм дрожжей) и Ethanol Red (промышленный штамм дрожжей) любезно предоставлены проф.Экхард Боле, Франкфуртский университет, Германия. Штамм дрожжей MKY09, трансформированный плазмидой pGPD2, в которую вставлен ген лакказы (pGPD2 / lac), был разработан в Центральном департаменте биотехнологии Трибхуванского университета, Непал (Bishwakarma, 2017). Плазмида pGPD2 / lac была сконструирована путем клонирования синтетического гена лакказы Ganoderma lucidum размером 1576 п.н. в векторе экспрессии pGPD2, приобретенном у Addgene Company. Сконструированную плазмиду трансформировали в штамм MKY09. Штамм дрожжей CDBT7 во всех случаях культивировали в катодном отсеке.Две камеры были разделены нафионовой мембраной. Производство этанола измеряли, как описано выше.
Эффект различных систем повышения электронного транспорта в ECC
Производство этанола контролировали в катодном и анодном отсеках путем культивирования штаммов дрожжей CDBT2 и CDBT7 в различных комбинациях следующим образом. В реакции 1 штамм дрожжей CDBT2 культивировали в обоих отсеках. В реакции 2 штаммы дрожжей CDBT2 и CDBT7 культивировали в анодном и катодном отсеках соответственно.В реакции 3 штаммы дрожжей CDBT2 и CDBT7 совместно культивировали как в катодном, так и в анодном отсеках. Во всех реакциях наблюдали за образованием этанола, как указано выше. В следующей серии реакций графитовый войлок (катод) и платиновая проволока (анод) были покрыты различными усилителями электронного транспорта и использовались в качестве катода и анода в ECC. В первом случае графитовый электрод иммобилизовали дрожжевыми клетками с помощью геля альгината кальция и использовали в качестве катода. Вкратце, сначала центрифугировали около 2,4 мл 18-часовой культуры дрожжевых штаммов, осадок смешивали с 10 мл 25 мМ фосфатного буфера (pH 7.0), содержащего 4% альгината натрия, и позволили ему впитаться в графитовый электрод в течение 30 мин. Графитовый электрод, содержащий альгинат и дрожжевые клетки, затем вымачивали в охлажденном 100 мМ растворе CaCl 2 на 30 минут, чтобы вызвать коагуляцию альгината кальция, и, наконец, промывали 25 мМ фосфатным буфером.
В реакции 1 штамм дрожжей CDBT2 культивировали в обоих отсеках. В реакции 2 штаммы дрожжей CDBT2 и CDBT7 культивировали в анодном и катодном отсеках соответственно.В реакции 3 штаммы дрожжей CDBT2 и CDBT7 совместно культивировали как в катодном, так и в анодном отсеках. Во всех реакциях наблюдали за образованием этанола, как указано выше. В следующей серии реакций графитовый войлок (катод) и платиновая проволока (анод) были покрыты различными усилителями электронного транспорта и использовались в качестве катода и анода в ECC. В первом случае графитовый электрод иммобилизовали дрожжевыми клетками с помощью геля альгината кальция и использовали в качестве катода. Вкратце, сначала центрифугировали около 2,4 мл 18-часовой культуры дрожжевых штаммов, осадок смешивали с 10 мл 25 мМ фосфатного буфера (pH 7.0), содержащего 4% альгината натрия, и позволили ему впитаться в графитовый электрод в течение 30 мин. Графитовый электрод, содержащий альгинат и дрожжевые клетки, затем вымачивали в охлажденном 100 мМ растворе CaCl 2 на 30 минут, чтобы вызвать коагуляцию альгината кальция, и, наконец, промывали 25 мМ фосфатным буфером. Во втором случае платиновый электрод был покрыт наночастицей платины электрохимическим способом на аноде. Для этого платиновая проволока была погружена в 10% раствор гексахлороплатината (IV) водорода в дистиллированной воде (Kanto Chemical Co.) при постоянной подаче 0,2 В с помощью потенциостата Hokuto Denko-151 (Hokuto Denko Corporation, Япония) в течение 30 мин. В третьем случае катод был покрыт нейтрально-красным, как описано Jeon and Park (2010). Вкратце, графитовый войлок сначала пропитывали метанолом, затем погружали в 1% раствор поливинилового спирта на 3-4 часа и сушили в печи при температуре около 80 ° C в течение 24 часов. Затем полностью высушенный графитовый войлок пропитывали чистым хлороформом, содержащим 10% тионилхлорида и 0,01% нейтрального красного, на 6 часов.Затем графитовый войлок оставляли на 12 часов для высыхания на воздухе. Затем его автоклавировали и промывали проточной дистиллированной водой до сохранения цвета. Наконец, его сушили при 60 ° C в течение 24 ч и использовали в качестве катода.
Во втором случае платиновый электрод был покрыт наночастицей платины электрохимическим способом на аноде. Для этого платиновая проволока была погружена в 10% раствор гексахлороплатината (IV) водорода в дистиллированной воде (Kanto Chemical Co.) при постоянной подаче 0,2 В с помощью потенциостата Hokuto Denko-151 (Hokuto Denko Corporation, Япония) в течение 30 мин. В третьем случае катод был покрыт нейтрально-красным, как описано Jeon and Park (2010). Вкратце, графитовый войлок сначала пропитывали метанолом, затем погружали в 1% раствор поливинилового спирта на 3-4 часа и сушили в печи при температуре около 80 ° C в течение 24 часов. Затем полностью высушенный графитовый войлок пропитывали чистым хлороформом, содержащим 10% тионилхлорида и 0,01% нейтрального красного, на 6 часов.Затем графитовый войлок оставляли на 12 часов для высыхания на воздухе. Затем его автоклавировали и промывали проточной дистиллированной водой до сохранения цвета. Наконец, его сушили при 60 ° C в течение 24 ч и использовали в качестве катода. Лучшее сочетание систем транспорта электронов среди них было определено на основе более высокого производства этанола.
Лучшее сочетание систем транспорта электронов среди них было определено на основе более высокого производства этанола.
Производство этанола гидролизатом лигноцеллюлозной биомассы в качестве источника углеводов
Производство этанола из гидролизата
Гидролизат биомассы лигноцеллюлозы с добавкой среды PYN использовали для дальнейшей ферментации с получением этанола.Гидролизаты хранили в камерах ECC. После автоклавирования камеры инокулировали штаммами дрожжей CDBT2 и CDBT7 в анодной и катодной камерах соответственно. Две камеры были разделены нафионовой мембраной. Производство этанола измеряли, как описано выше.
Сравнение производства этанола с помощью нафиона и ацетатцеллюлозной мембраны
Описанные выше эксперименты были повторены в ECC, снабженном мембраной из ацетата целлюлозы для разделения двух камер. Производство этанола измеряли, как указано выше, и сравнивали с теми, которые определялись, когда разделяющей мембраной была нафионная мембрана.
Статистический анализ
Все представленные данные были средним значением трех избыточных данных. Все графики и статистические расчеты были выполнены с помощью Graph Pad Prism 8.0.1. Стандартные ошибки были представлены в виде ± стандартное отклонение (± SD).
Результаты
Оптимизация производства этанола в электрохимической ячейке (ECC)
Стандартные условия, при которых ферментация проводилась в ECC (схема сборки ECC показана на рисунке 1) с использованием различных штаммов дрожжей, были pH 5.5, 30 ° C, бульон PYN с добавлением 5% глюкозы и внешнего источника 4V. Система ферментации, в которой штамм CDBT2 культивировали в анодном отсеке, а штамм CDBT7 в катодном отсеке, оказалась наиболее эффективной для производства этанола, чем культивирование штамма CDBT2 в катодном отсеке и штамма CDBT7 в анодном отсеке (рисунки 2A, B, таблица 1). Сканирующая электронная микроскопия показала образование пленки CDBT7 в графитовом войлочном электроде (рис.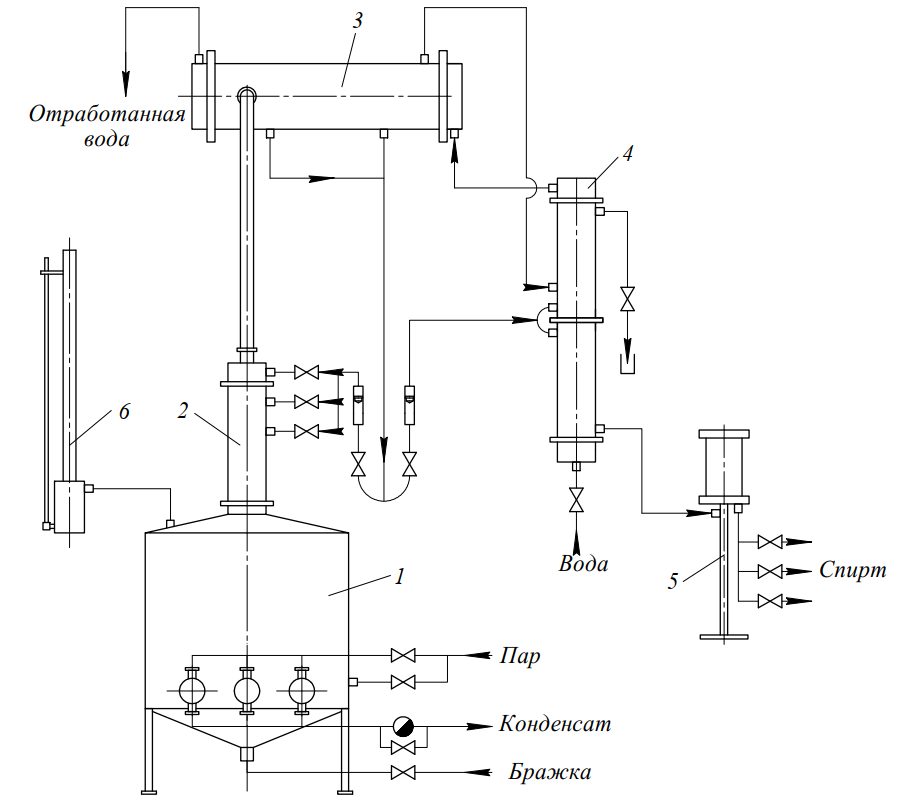 3). Эффективность ферментации была увеличена как в культурах в катодной, так и в анодной камере по сравнению с реакциями ферментации, проводимыми в отсутствие приложенного напряжения.Наблюдался более быстрый и усиленный рост CDBT2 в анодном отсеке (рис. 2С). С другой стороны, рост штамма CDBT2 при культивировании в катодном отсеке был относительно ограниченным. Штамм CDBT7 при культивировании в анодном отсеке показал относительно меньшее усиление продукции этанола (таблица 1). При приложении внешнего напряжения в диапазоне от 0 до 5 В (± 0,1 В), в то время как CDBT2 культивировали в анодном отсеке, а CDBT7 культивировали в катодном отсеке, приложение 4 В производило наибольшее количество этанола (рис. 2D).Наблюдаемое усиление продукции этанола составило 19,4 ± 0,18%, когда CDBT2 культивировали в анодном отсеке, и 23,7 ± 0,51%, когда CDBT7 культивировали в катодном отсеке. Подача внешнего напряжения через ECC в отсутствие инокулятов дрожжей (отрицательный контроль) не приводила к обнаруживаемым уровням этанола.
3). Эффективность ферментации была увеличена как в культурах в катодной, так и в анодной камере по сравнению с реакциями ферментации, проводимыми в отсутствие приложенного напряжения.Наблюдался более быстрый и усиленный рост CDBT2 в анодном отсеке (рис. 2С). С другой стороны, рост штамма CDBT2 при культивировании в катодном отсеке был относительно ограниченным. Штамм CDBT7 при культивировании в анодном отсеке показал относительно меньшее усиление продукции этанола (таблица 1). При приложении внешнего напряжения в диапазоне от 0 до 5 В (± 0,1 В), в то время как CDBT2 культивировали в анодном отсеке, а CDBT7 культивировали в катодном отсеке, приложение 4 В производило наибольшее количество этанола (рис. 2D).Наблюдаемое усиление продукции этанола составило 19,4 ± 0,18%, когда CDBT2 культивировали в анодном отсеке, и 23,7 ± 0,51%, когда CDBT7 культивировали в катодном отсеке. Подача внешнего напряжения через ECC в отсутствие инокулятов дрожжей (отрицательный контроль) не приводила к обнаруживаемым уровням этанола.
Рисунок 2 . Производство этанола в ECC штаммами дрожжей CDBT2 / CDBT7 с подачей 4V извне. (A) Производство этанола в катодной и анодной камерах с помощью CDBT2 и CDBT7 по отдельности. (B) Среднее производство этанола в обеих камерах. (C) Рост клеток и использование глюкозы при культивировании CDBT2 в анодной и катодной камерах с и без приложенного внешнего напряжения (нормальный рост — без подачи внешнего напряжения). (D) Влияние приложенного электрического тока на производство этанола с помощью CDBT2 и CDBT7. (Контроль: ЕСС без дрожжевой культуры и без источника питания; нормальная ферментация: ЕСС без источника питания).
Таблица 1 .Этанол, продуцируемый CDBT2, и CDBT7, культивируемый в разных компартментах.
Рисунок 3 . Сканирующие электронные микроскопические изображения графитовых войлочных электродов. (A) Плоский графитовый войлок. (B) Графитовый войлок на катоде после выращивания CDBT7 и производство этанола в катодной камере. (C) Графитовый войлок на катоде после выращивания CDBT2 и производства этанола в катодной камере.
(B) Графитовый войлок на катоде после выращивания CDBT7 и производство этанола в катодной камере. (C) Графитовый войлок на катоде после выращивания CDBT2 и производства этанола в катодной камере.
Сравнение производства этанола различными
S.cerevisiae Штаммы, культивируемые в анодном отсеке, соединенные со штаммом CDBT 7, культивированные в катодном отсеке Для определения эффективности производства этанола с использованием различных штаммов S. cerevisiae в ECC, производство этанола контролировали путем культивирования CDBT2, этанолового красного, MKY09 и MKY09-pGPD2 / lac в анодном отсеке против CDBT7 в катодном отсеке. И снова CDBT2 продуцировал наибольшее количество этанола (фиг. 4A) по сравнению с другими штаммами S. cerevisiae .Кроме того, генетическая модификация штамма MKY09 путем трансформации его геном лакказы (MKY09-pGPD2 / lac) не влияла на выработку этанола в ECC, а штаммы MKY09 и MKY09-pGPD2 / lac продуцировали сходные количества этанола. Кроме того, штамм дрожжей CDBT2, культивируемый в анодной камере, связанный со штаммом CDBT7, культивированным в катодной камере, показал усиление продукции этанола с помощью CDBT7 (рис. 4B).
Кроме того, штамм дрожжей CDBT2, культивируемый в анодной камере, связанный со штаммом CDBT7, культивированным в катодной камере, показал усиление продукции этанола с помощью CDBT7 (рис. 4B).
Рисунок 4 . Производство этанола различными штаммами S. cerevisiae , культивированными в анодном отсеке электрохимической ячейки с CDBT7, культивируемым в катодном отсеке: сравнительное исследование. (A) Производство этанола в анодном отсеке. (B) Производство этанола в катодном отсеке.
Эффект различных систем электронного транспорта
Эффект дрожжевых культур
Для определения влияния культур дрожжей на системы транспорта электронов штаммы дрожжей CDBT2 и CDBT7 культивировали в ECC в следующих комбинациях; (i) CDBT2 / CDBT2 в анодном / катодном отсеках; (ii) CDBT2 / CDBT7 в анодном и катодном отсеках и (iii) совместное культивирование CDBT2 и CDBT7 в обоих отсеках.В комбинации CDBT2 / CDBT2 было обнаружено, что штамм дрожжей CDBT2 продуцировал больше этанола в анодном отсеке (15,5 ± 0,14 мг · мл -1 ) по сравнению с катодным отсеком (13,4 ± 0,07 мг · мл -1 ) . Среднее производство этанола в этой комбинации составило 14,4 ± 0,15 мг · мл -1 (таблица 2), а увеличение производства этанола составило 27,5 ± 0,44%. В комбинации CDBT2 / CDBT7 штамм CDBT2 снова продуцировал больше этанола в анодной камере (15,10 ± 0,28 мг · мл -1 ) по сравнению со штаммом CDBT7 в катодном отсеке (12.5 ± 0,50 мг · мл -1 ). Среднее производство этанола в этой комбинации составило 13,8 ± 0,56 мг · мл -1 (рис. 5А, таблица 2), а увеличение производства этанола составило 21,5 ± 0,71%. Когда штаммы CDBT2 и CDBT7 совместно культивировали в обоих отсеках, продукция этанола была значительно ниже по сравнению с отдельными культурами.
Среднее производство этанола в этой комбинации составило 14,4 ± 0,15 мг · мл -1 (таблица 2), а увеличение производства этанола составило 27,5 ± 0,44%. В комбинации CDBT2 / CDBT7 штамм CDBT2 снова продуцировал больше этанола в анодной камере (15,10 ± 0,28 мг · мл -1 ) по сравнению со штаммом CDBT7 в катодном отсеке (12.5 ± 0,50 мг · мл -1 ). Среднее производство этанола в этой комбинации составило 13,8 ± 0,56 мг · мл -1 (рис. 5А, таблица 2), а увеличение производства этанола составило 21,5 ± 0,71%. Когда штаммы CDBT2 и CDBT7 совместно культивировали в обоих отсеках, продукция этанола была значительно ниже по сравнению с отдельными культурами.
Таблица 2 . Производство этанола в КЭП с различными комбинациями анодных и катодных систем для увеличения переноса электронов: резюме.
Рисунок 5 . Производство этанола с использованием различных систем повышения транспорта электронов. (A) Использование дрожжей в различных комбинациях в ECC (A: нормальная ферментация CDBT2; B: CDBT2 / CDBT2 в электрохимической ячейке; C: CDBT2 / CDBT7 в электрохимической ячейке, D: нормальная ферментация CDBT2 / CDBT7, E: CDBT2 / CDBT7 смешанная культура). (B) Использование графитового электрода, иммобилизованного штаммом дрожжей CDBT7 [A: графитовый катод / Pt анод; B: графитовый катод (иммобилизованный CDBT7) / Pt анод; C: нормальная ферментация CDBT2 / CDBT7; D: нормальная ферментация CDBT2 / CDBT7, иммобилизованная в графите]. (C) Использование электродов, покрытых различными переносчиками электронов (A: нормальный платиновый анод / графитовый катод; B: платиновый анод / графитовый катод с платиновым покрытием; C: графитовый катод с нейтральным красным покрытием / платиновый анод; D: нейтральный красный катод с покрытием / Анод с платиновым покрытием).
(A) Использование дрожжей в различных комбинациях в ECC (A: нормальная ферментация CDBT2; B: CDBT2 / CDBT2 в электрохимической ячейке; C: CDBT2 / CDBT7 в электрохимической ячейке, D: нормальная ферментация CDBT2 / CDBT7, E: CDBT2 / CDBT7 смешанная культура). (B) Использование графитового электрода, иммобилизованного штаммом дрожжей CDBT7 [A: графитовый катод / Pt анод; B: графитовый катод (иммобилизованный CDBT7) / Pt анод; C: нормальная ферментация CDBT2 / CDBT7; D: нормальная ферментация CDBT2 / CDBT7, иммобилизованная в графите]. (C) Использование электродов, покрытых различными переносчиками электронов (A: нормальный платиновый анод / графитовый катод; B: платиновый анод / графитовый катод с платиновым покрытием; C: графитовый катод с нейтральным красным покрытием / платиновый анод; D: нейтральный красный катод с покрытием / Анод с платиновым покрытием).
Эффект иммобилизации дрожжей
Штамм дрожжей CDBT7, иммобилизованный в присутствии альгината кальция на катоде, при использовании для производства этанола в ECC со штаммом CDBT2 в анодном отсеке, продуцировал 12. 6 ± 0,42 мг · мл -1 и 4,95 ± 0,07 мг · мл -1 этанола под действием штаммов CDBT2 и CDBT7 соответственно без приложенного напряжения, т.е. имело место значительное снижение выработки этанола (рис. 5B). При использовании той же системы в ECC с подачей внешнего напряжения (4 В) производство этанола было значительно увеличено. Производство этанола в последнем случае составляло 16,1 ± 0,49 мг · мл -1 (CDBT2 в анодном отсеке) и 7,75 ± 0,5 мг · мл -1 (штамм CDBT7 в катодном отсеке), соответственно.Среднее производство этанола составило 11,5 ± 0,70 мг · мл -1 , а увеличение производства этанола составило 36,2 ± 0,54%, чем без источника питания. Однако среднее производство этанола в ECC было меньше, чем без иммобилизации CDBT7 на катоде. Таким образом, иммобилизация не показала лучшего увеличения производства этанола.
6 ± 0,42 мг · мл -1 и 4,95 ± 0,07 мг · мл -1 этанола под действием штаммов CDBT2 и CDBT7 соответственно без приложенного напряжения, т.е. имело место значительное снижение выработки этанола (рис. 5B). При использовании той же системы в ECC с подачей внешнего напряжения (4 В) производство этанола было значительно увеличено. Производство этанола в последнем случае составляло 16,1 ± 0,49 мг · мл -1 (CDBT2 в анодном отсеке) и 7,75 ± 0,5 мг · мл -1 (штамм CDBT7 в катодном отсеке), соответственно.Среднее производство этанола составило 11,5 ± 0,70 мг · мл -1 , а увеличение производства этанола составило 36,2 ± 0,54%, чем без источника питания. Однако среднее производство этанола в ECC было меньше, чем без иммобилизации CDBT7 на катоде. Таким образом, иммобилизация не показала лучшего увеличения производства этанола.
Эффект материалов, улучшающих перенос электронов
Покрытие платинового электрода мелкими частицами (наночастицами) платины с использованием гексахлороплатината (IV) и графитового катода нейтральным красным, а также культивирование штамма CDBT2 в анодном отсеке и штамма CDBT7 в катодном отсеке 17. 5 ± 0,01 мг · мл -1 и 17,2 ± 0,01 мг · мл -1 этанола, соответственно (рис. 5C). Наблюдалось значительное увеличение производства этанола (52,8 ± 0,44%) по сравнению с нормальной ферментацией без подачи напряжения (Таблица 2).
5 ± 0,01 мг · мл -1 и 17,2 ± 0,01 мг · мл -1 этанола, соответственно (рис. 5C). Наблюдалось значительное увеличение производства этанола (52,8 ± 0,44%) по сравнению с нормальной ферментацией без подачи напряжения (Таблица 2).
Электрохимическое производство этанола из
Saccharum spontaneum Гидролизат Когда лигноцеллюлозный ( Saccharum spontaneum) гидролизат с 3,3% редуцирующего сахара использовался в качестве субстрата для ферментации в ECC, наблюдалось значительное увеличение производства этанола в анодном (9.0 ± 0,1 мг · мл -1 ; увеличение = 60,8 ± 0,10%), а также в катодных (11,9 ± 0,05 мг · мл -1 ; увеличение = 63,0 ± 0,07%) отсеках со средним увеличением на 61,9 ± 0,12% по сравнению с нормальной ферментацией без подачи напряжения. Производство этанола с помощью CDBT2 и CDBT7 без внешнего источника напряжения составляло 5,6 ± 0,03 и 7,3 ± 0,06 мг · мл -1 , соответственно (рисунок 6, таблица 3). Увеличение количества производимого этанола, когда субстратом ферментации был лигноцеллюлозный гидролизат, было намного выше по сравнению с ферментацией с глюкозой в качестве субстрата в идентичных условиях.Кроме того, когда мембранный барьер был заменен на ацетат целлюлозы вместо нафионовой мембраны, произошло дальнейшее увеличение (6,30 ± 0,22%) производства этанола (рисунок 7, таблица 3).
Увеличение количества производимого этанола, когда субстратом ферментации был лигноцеллюлозный гидролизат, было намного выше по сравнению с ферментацией с глюкозой в качестве субстрата в идентичных условиях.Кроме того, когда мембранный барьер был заменен на ацетат целлюлозы вместо нафионовой мембраны, произошло дальнейшее увеличение (6,30 ± 0,22%) производства этанола (рисунок 7, таблица 3).
Рисунок 6 . Производство этанола из лигноцеллюлозного гидролизата ( S. spontaneum , предварительно обработанного горячей водой в течение 2 часов с последующим 0,5 М кислотным гидролизом) в ECC со штаммами CDBT2 и CDBT7, культивированными в анодном и катодном отсеках, соответственно (контроль: ECC без культуры дрожжей и без внешней среды). напряжение питания.Нормальный: ECC с дрожжевой культурой и без внешнего источника питания).
Таблица 3 . Этанол, продуцируемый CDBT2 и CDBT7, культивированный с гидролизатом лигноцеллюлозной биомассы.
Рисунок 7 . Производство этанола из лигноцеллюлозного гидролизата (предварительно обработанная горячая вода S. spontaneum в течение 2 часов с последующим 0,5 М кислотным гидролизом) в ECC с CDBT2 и CDBT7 в анодном и катодном отсеках, разделенных нафионовой мембраной или мембраной из ацетата целлюлозы.Измерения этанола в культурах определяли через 3,5 дня ферментации.
Обсуждение
Штаммы дрожжей S. cerevisiae CDBT2 и W. anomalus CDBT7 были выбраны для исследования, потому что оба являются хорошими продуцентами этанола, и было показано, что последний способен превращать ксилозу в этанол. Оптимальные значения pH для производства этанола с использованием штаммов дрожжей CDBT2 и CDBT7 составляли pH 5,5 и температуру 30 ° C соответственно. Условия соответствовали нашим предыдущим экспериментам по оптимизации дрожжевых штаммов CDBT2 (Joshi et al., 2014). Система ECC с CDBT2 в анодном отсеке и CDBT7 в катодном отсеке производила наибольшее количество этанола по сравнению с тестируемой системой с обратным ходом. Это может быть связано с тем, что деформация CDBT7 образует пленку на графитовом катоде, что приводит к быстрому переносу электронов через катод. Это дополнительно подтверждается тем фактом, что (i) изображения поверхности катода на СЭМ ясно показывают образование биопленки CDBT7 (рис. 3), и (ii) использование катода с иммобилизованным CDBT7 привело к значительному увеличению продукции этанола при культивировании в ECC (таблица 2). ) (Тойт и Преториус, 2000).Кроме того, исследование Mohamoud (2014) предполагает, что подача внешнего напряжения увеличивает окислительно-восстановительный потенциал пленки и, таким образом, приводит к увеличению переноса электронов и увеличению производства этанола. Согласно этому исследованию, при подаче электричества на электрод с полианилин / поливиниловым композитом окислительно-восстановительный потенциал пленки увеличивался на 40%. Canelas et al. (2008) наблюдали, что образование этанола требует поддержания отношений НАД + / НАДН. У здоровых эукариот отношения NAD + / NADH обычно относительно высоки, а диапазон колеблется в широких пределах (60–700).
Это может быть связано с тем, что деформация CDBT7 образует пленку на графитовом катоде, что приводит к быстрому переносу электронов через катод. Это дополнительно подтверждается тем фактом, что (i) изображения поверхности катода на СЭМ ясно показывают образование биопленки CDBT7 (рис. 3), и (ii) использование катода с иммобилизованным CDBT7 привело к значительному увеличению продукции этанола при культивировании в ECC (таблица 2). ) (Тойт и Преториус, 2000).Кроме того, исследование Mohamoud (2014) предполагает, что подача внешнего напряжения увеличивает окислительно-восстановительный потенциал пленки и, таким образом, приводит к увеличению переноса электронов и увеличению производства этанола. Согласно этому исследованию, при подаче электричества на электрод с полианилин / поливиниловым композитом окислительно-восстановительный потенциал пленки увеличивался на 40%. Canelas et al. (2008) наблюдали, что образование этанола требует поддержания отношений НАД + / НАДН. У здоровых эукариот отношения NAD + / NADH обычно относительно высоки, а диапазон колеблется в широких пределах (60–700). Canelas et al. (2008) также наблюдали, что соотношение цитозольных свободных NAD + / NADH у S. cerevisiae в устойчивом и высокодинамичном состоянии колеблется от 101 ± 14 до 320 ± 45, тогда как соотношение NAD + / NADH в цельной клетке составляет 7,5. ± 2,5. Кроме того, было обнаружено, что в S. cerevisiae отношение NAD + / NADH снижалось при наличии донора электронов и соотношение увеличивалось в присутствии акцептора электронов. В нашем случае, когда штамм дрожжей культивировали в катодном отсеке, производство этанола увеличивалось, потому что катод был донором электронов, что приводило к большему превращению NAD + в NADH, который направлял преобразование пирувата в этанол.Обратимо, когда штамм дрожжей, культивируемый в анодном отсеке, который является акцептором электронов, преобразовывал НАДН в НАД + , который управлял быстрым превращением глюкозы в пируват, так что мы могли видеть усиление роста и образование этанола.
Canelas et al. (2008) также наблюдали, что соотношение цитозольных свободных NAD + / NADH у S. cerevisiae в устойчивом и высокодинамичном состоянии колеблется от 101 ± 14 до 320 ± 45, тогда как соотношение NAD + / NADH в цельной клетке составляет 7,5. ± 2,5. Кроме того, было обнаружено, что в S. cerevisiae отношение NAD + / NADH снижалось при наличии донора электронов и соотношение увеличивалось в присутствии акцептора электронов. В нашем случае, когда штамм дрожжей культивировали в катодном отсеке, производство этанола увеличивалось, потому что катод был донором электронов, что приводило к большему превращению NAD + в NADH, который направлял преобразование пирувата в этанол.Обратимо, когда штамм дрожжей, культивируемый в анодном отсеке, который является акцептором электронов, преобразовывал НАДН в НАД + , который управлял быстрым превращением глюкозы в пируват, так что мы могли видеть усиление роста и образование этанола. Несмотря на указанные выше соотношения, эукариоты могли выжить, даже когда соотношение НАД + / НАДН было всего лишь 7–10 (Veech et al., 1972). Входное внешнее напряжение поляризует ионы, присутствующие в цитозоле, и в результате положительно заряженный ион NAD + , связанный с клеточной мембраной, делает перенос электронов с катода более легким и быстрым (Gunawardena et al., 2008; McGillivray and Gow, 2009), таким образом, упрощает доступ для восстановления NAD + до NADH в катоде, что приводит к увеличению производства этанола. Согласно Яу и соавт. (2013) считалось, что приложенное напряжение поляризует ионные заряды в дрожжевых клетках, что может снизить туннельный барьер для переноса электронов во время окисления глюкозы, что приводит к большему количеству пирувата и, следовательно, большему росту клеток и производству этанола.
Несмотря на указанные выше соотношения, эукариоты могли выжить, даже когда соотношение НАД + / НАДН было всего лишь 7–10 (Veech et al., 1972). Входное внешнее напряжение поляризует ионы, присутствующие в цитозоле, и в результате положительно заряженный ион NAD + , связанный с клеточной мембраной, делает перенос электронов с катода более легким и быстрым (Gunawardena et al., 2008; McGillivray and Gow, 2009), таким образом, упрощает доступ для восстановления NAD + до NADH в катоде, что приводит к увеличению производства этанола. Согласно Яу и соавт. (2013) считалось, что приложенное напряжение поляризует ионные заряды в дрожжевых клетках, что может снизить туннельный барьер для переноса электронов во время окисления глюкозы, что приводит к большему количеству пирувата и, следовательно, большему росту клеток и производству этанола.
Пируват, образующийся во время гликолиза, превращается в (i) ацетил-КоА в аэробных условиях у эукариот, (ii) лактат во время гомолактической ферментации у млекопитающих или (iii) этанол во время анаэробной ферментации у дрожжей и бактерий. При подаче внешнего напряжения NAD + непосредственно преобразовывался в NADH, повышая уровень NADH. Известно, что это вызывает дисбаланс в росте дрожжей, который способствует производству этанола, заставляя дрожжи преобразовывать пируват в ацетальдегид, а затем в этанол за счет потребления НАДН. Также было показано, что повышенный уровень НАДН аллостерически ингибирует пируватдегидрогеназу (Harris et al., 2002) и предотвращает превращение пирувата в ацетилкофермент А. Соответственно, пируват может переключаться на образование этанола.Song et al. (2014) показали, что внешний ввод напряжения можно использовать для управления кинетикой метаболизма глюкозы у S. cerevisiae как в аэробных, так и в анаэробных условиях. Здесь внутриклеточные переносчики электронов, такие как NAD + , NADH и система переноса электронов через трансплазматическую мембрану (tPMET), расположенные в плазматической мембране, играют важную роль для прямого транспорта электронов через клеточную мембрану.
При подаче внешнего напряжения NAD + непосредственно преобразовывался в NADH, повышая уровень NADH. Известно, что это вызывает дисбаланс в росте дрожжей, который способствует производству этанола, заставляя дрожжи преобразовывать пируват в ацетальдегид, а затем в этанол за счет потребления НАДН. Также было показано, что повышенный уровень НАДН аллостерически ингибирует пируватдегидрогеназу (Harris et al., 2002) и предотвращает превращение пирувата в ацетилкофермент А. Соответственно, пируват может переключаться на образование этанола.Song et al. (2014) показали, что внешний ввод напряжения можно использовать для управления кинетикой метаболизма глюкозы у S. cerevisiae как в аэробных, так и в анаэробных условиях. Здесь внутриклеточные переносчики электронов, такие как NAD + , NADH и система переноса электронов через трансплазматическую мембрану (tPMET), расположенные в плазматической мембране, играют важную роль для прямого транспорта электронов через клеточную мембрану. Система tPMET состоит из цитохромов и различных окислительно-восстановительных ферментов, таких как НАДН-оксидаза, которая обеспечивает окислительно-восстановительную активность мембраны в определенных участках.
Система tPMET состоит из цитохромов и различных окислительно-восстановительных ферментов, таких как НАДН-оксидаза, которая обеспечивает окислительно-восстановительную активность мембраны в определенных участках.
На самом деле, для уменьшения отношения NAD + / NADH, необходимое приложенное напряжение составляет около -0,33 В (Veech et al., 1972). В наших экспериментах мы видим, что оптимальное производство этанола было получено при 4 В ± 0,1 В. Мы полагаем, что более высокое напряжение было из-за омического падения, вызванного разработанным ECC. Мэтью и др. (2015) сообщили о постепенном увеличении роста в 1,1 раза и производства этанола в 2 раза при культивировании S. cerevisiae при внешнем напряжении до 15 В.В нашем исследовании увеличение напряжения выше 4 В снижает производство этанола. Это может быть связано с тем, что повышение напряжения может окислять платину до диоксида платины, который действует как изолятор и снижает активность электрода (Wang et al. , 2006). Точно так же в катоде может иметь место избыточное производство газообразного водорода, что может снизить активность графитового электрода (Hsu et al., 2008). Кроме того, при использовании смешанной культуры штаммов дрожжей CDBT2 и CDBT7 продукция этанола была относительно низкой. Это может быть потому, что когда S.cerevisiae и W. аномальный культивировали вместе, рост W. аномальный мог подавить рост S. cerevisiae , таким образом снизив общее производство этанола (Ruyters et al., 2015).
, 2006). Точно так же в катоде может иметь место избыточное производство газообразного водорода, что может снизить активность графитового электрода (Hsu et al., 2008). Кроме того, при использовании смешанной культуры штаммов дрожжей CDBT2 и CDBT7 продукция этанола была относительно низкой. Это может быть потому, что когда S.cerevisiae и W. аномальный культивировали вместе, рост W. аномальный мог подавить рост S. cerevisiae , таким образом снизив общее производство этанола (Ruyters et al., 2015).
Steinbusch et al. (2010) сообщили об увеличении более чем в 2 раза производства этанола в присутствии внешнего источника электрического тока, когда ацетат использовался в качестве субстрата для ферментации. He et al. (2016) сообщили о 60.Увеличение производства бутанола на 3% за счет Clostridium spp . когда нейтральный красный использовался как переносчик электронов. He et al. также продемонстрировали, что нейтральный красный увеличивает производство бутанола лучше, чем другие переносчики электронов, такие как виологеновые красители (красители, содержащие пиридиновые группы). Кроме того, нейтральный красный может прочно связываться с клеточными мембранами (Park et al., 1999). Он имеет окислительно-восстановительный потенциал около -0,325 В, который аналогичен окислительно-восстановительному потенциалу НАДН (-0,32 В). Соответственно, нейтральный красный может взаимодействовать с НАДН и, таким образом, повышать уровень НАД + / НАДН, вызывая больше этанола.Уменьшение продукции этанола в иммобилизованной культуре было связано с тем, что иммобилизация снижает диффузию субстрата, и, следовательно, продукция этанола была меньше, чем при нормальном росте, тогда как она увеличивает быстрый перенос электронов на пересечении электрода.
Кроме того, нейтральный красный может прочно связываться с клеточными мембранами (Park et al., 1999). Он имеет окислительно-восстановительный потенциал около -0,325 В, который аналогичен окислительно-восстановительному потенциалу НАДН (-0,32 В). Соответственно, нейтральный красный может взаимодействовать с НАДН и, таким образом, повышать уровень НАД + / НАДН, вызывая больше этанола.Уменьшение продукции этанола в иммобилизованной культуре было связано с тем, что иммобилизация снижает диффузию субстрата, и, следовательно, продукция этанола была меньше, чем при нормальном росте, тогда как она увеличивает быстрый перенос электронов на пересечении электрода.
Увеличение производства этанола из-за приложенного внешнего источника напряжения было еще больше, когда в качестве субстрата использовался гидролизат Saccharum spontaneum , гидролизованный кислотой. Это может быть потому, что; NaCl, присутствующий в нейтрализованном гидролизате, может способствовать увеличению производства этанола за счет снижения сопротивления. Фактически, Ян и др. (2015) показали, что при увеличении концентрации NaCl с 5 до 30 г · л -1 в ферментационной среде внутреннее сопротивление системы уменьшается с 2432,0 до 2328,4 Ом. Аналогичным образом Камцев и др. (2018) также отметили, что увеличение концентрации соли увеличивает электрическую проводимость, следовательно, увеличивает поток электронов и снижает сопротивление. Соответственно, повышенная проводимость, вероятно, будет способствовать производству этанола. Повышенное производство этанола из лигноцеллюлозной биомассы также может быть частично связано с присутствием в смеси различных натуральных продуктов / веществ, которые могут способствовать росту штаммов дрожжей.Изменение мембраны из ацетата целлюлозы вместо мембраны нафиона увеличило производство этанола. Последнее может быть связано с транспортом ксилозы через ацетатцеллюлозную мембрану из анодной камеры в катодную, а также со снижением внутреннего сопротивления из-за накопления ионов на поверхности мембраны (Tang et al.
Фактически, Ян и др. (2015) показали, что при увеличении концентрации NaCl с 5 до 30 г · л -1 в ферментационной среде внутреннее сопротивление системы уменьшается с 2432,0 до 2328,4 Ом. Аналогичным образом Камцев и др. (2018) также отметили, что увеличение концентрации соли увеличивает электрическую проводимость, следовательно, увеличивает поток электронов и снижает сопротивление. Соответственно, повышенная проводимость, вероятно, будет способствовать производству этанола. Повышенное производство этанола из лигноцеллюлозной биомассы также может быть частично связано с присутствием в смеси различных натуральных продуктов / веществ, которые могут способствовать росту штаммов дрожжей.Изменение мембраны из ацетата целлюлозы вместо мембраны нафиона увеличило производство этанола. Последнее может быть связано с транспортом ксилозы через ацетатцеллюлозную мембрану из анодной камеры в катодную, а также со снижением внутреннего сопротивления из-за накопления ионов на поверхности мембраны (Tang et al. , 2010).
, 2010).
Заключение
Таким образом, комбинация штаммов дрожжей S. cerevisiae CDBT2 и W. аномальный CDBT7 эффективно и эффективно продуцирует этанол как из глюкозы, так и из гидролизата лигноцеллюлозной биомассы.Использование штаммов CDBT2 / CDBT7 в ECC эффективно утилизирует редуцирующие сахара, на что указывает почти полное использование редуцирующих сахаров. Производство этанола штаммами дрожжей CDBT2 и CDBT7 может быть увеличено за счет подачи низкого уровня внешнего напряжения. S. cerevisiae CDBT2 был наиболее эффективным при производстве этанола в анодном отсеке, тогда как аномальный штамм дрожжей W. CDBT7 был наиболее эффективным при производстве этанола в катодном отсеке. Дальнейшее увеличение производства этанола наблюдалось, когда КЭП работал с мелкими наночастицами платины, нанесенными на платиновый анод, и нейтральный красный цвет был нанесен на графитовый катод.Предварительно обработанная горячей водой и гидролизованная минеральной кислотой лигноцеллюлозная биомасса (экономичный метод) может использоваться в качестве субстрата для ферментации в ECC со штаммами CDBT2 и CDBT7. Дополнительным преимуществом использования гидролизованной лигноцеллюлозной биомассы было то, что она дополнительно увеличивает производство этанола в ECC. С учетом представленных здесь данных, штамм дрожжей CDBT2 может служить мощным промышленным штаммом для генетической модификации и производства этанола. Одно из ограничений этого исследования — дальнейшее расширение.Мы твердо уверены, что масштабирование этого исследования вполне возможно при наличии большой ячейки электрохимической ферментации и является следующим этапом нашего исследования.
Дополнительным преимуществом использования гидролизованной лигноцеллюлозной биомассы было то, что она дополнительно увеличивает производство этанола в ECC. С учетом представленных здесь данных, штамм дрожжей CDBT2 может служить мощным промышленным штаммом для генетической модификации и производства этанола. Одно из ограничений этого исследования — дальнейшее расширение.Мы твердо уверены, что масштабирование этого исследования вполне возможно при наличии большой ячейки электрохимической ферментации и является следующим этапом нашего исследования.
Доступность данных
Все наборы данных, созданные для этого исследования, включены в файлы рукописи / дополнительные файлы.
Авторские взносы
JJ выполнил лабораторные работы и подготовил черновик рукописи. ТБ, LS и AY редактировали рукопись. ПД, БП, ПП, МЫ, ММ, РМ помогали в лабораторных работах.Все авторы отредактировали рукопись и одобрили представленную версию.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Г-н Суджан Бишвокарма, Центральный факультет биотехнологии, Трибхуванский университет, Программа финансирования возобновляемых источников энергии Непала, заслуживает высокой оценки за их поддержку.
Список литературы
Бишвакарма, С. (2017). Гетерологическая экспрессия гена лакказы Ganoderma lucidum в Saccharomyces cerevisiae для деградации лигноцеллюлозной биомассы (M.Sc. Thesis). Университет Трибхувана, регистрационный номер: 5-1-48-301-2007.
Google Scholar
Канелас, А. Б., Ван Гулик, В. М., и Хейнен, Дж. Дж. (2008). Определение соотношения цитозольных свободных НАД / НАДН в Saccharomyces cerevisiae в установившихся и высокодинамичных условиях. Biotechnol. Bioeng. 100, 734–743. DOI: 10.1002 / bit.21813
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хак М., Эпплин Ф. М. (2012). Стоимость производства проса и стоимость производства этанола из проса для нескольких уровней инвестиционных затрат на биоперерабатывающий завод и степени конверсии биомассы в этанол. Биомасса Биоэнергетика 46, 517–530. DOI: 10.1016 / j.biombioe.2012.07.008
Биомасса Биоэнергетика 46, 517–530. DOI: 10.1016 / j.biombioe.2012.07.008
CrossRef Полный текст | Google Scholar
Харрис, Р.А., Боукер-кинли М. М. и Хуанг Б. (2002). Регулирование активности комплекса пируватдегидрогеназы. Adv. Enzyme Regul. 42, 249–259.
PubMed Аннотация | Google Scholar
He, A. Y., Yin, C. Y., Xu, H., Kong, X. P., Xue, J. W., Zhu, J., et al. (2016). Повышенное производство бутанола в ячейке для микробного электролиза с помощью Clostridium beijerinckii IB4. Биопроцесс Биосист. Англ. 39, 245–254. DOI: 10.1007 / s00449-015-1508-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эрмосилла, Э., Шальчли, Х., Мутис, А., Диез, М.С. (2017). Комбинированное действие индукторов ферментов и нитрата на селективную деградацию лигнина в пшеничной соломе с помощью Ganoderma lobatum . Environ. Sci. Загрязнение. Res. 24, 21984–21996. DOI: 10.1007 / s11356-017-9841-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hsu, P. C., Seol, S. K., Lo, T. N., Liu, C. J., Wang, C. L., Lin, C. S., et al. (2008). Пузырьки водорода и морфология роста разветвленного цинка при электроосаждении. J. Electrochem. Soc. 155: D400. DOI: 10.1149 / 1.2894189
C., Seol, S. K., Lo, T. N., Liu, C. J., Wang, C. L., Lin, C. S., et al. (2008). Пузырьки водорода и морфология роста разветвленного цинка при электроосаждении. J. Electrochem. Soc. 155: D400. DOI: 10.1149 / 1.2894189
CrossRef Полный текст | Google Scholar
Чон Б. Ю. и Пак Д. Х. (2010). Улучшение производства этанола за счет электрохимической окислительно-восстановительной комбинации Zymomonas mobilis и Saccharomyces cerevisiae . J. Microbiol. Biotechnol. 20, 94–100. DOI: 10.4014 / jmb.0904.04029
CrossRef Полный текст | Google Scholar
Джоши Б., Бхатт М. Р., Шарма Д., Джоши, Дж., Малла, Р., и Шрирама, Л. (2011). Производство лигноцеллюлозного этанола: современные методы и последние разработки. Biotechnol. Мол. Биол. Ред. 6, 172–182. DOI: 10.1111 / j.1540-8159.2011.03289.x
CrossRef Полный текст | Google Scholar
Джоши Дж., Бхаттарай Т. и Шрирама Л. (2018). Эффективные методы предварительной обработки для высвобождения восстанавливающих сахаров из лигноцеллюлозной биомассы, произрастающей в Непале, и характеристики предварительно обработанной лигноцеллюлозной биомассы. Int. J. Adv. Biotechnol. Res. 9, 9–23.
Int. J. Adv. Biotechnol. Res. 9, 9–23.
Google Scholar
Джоши, Дж., Шреста, Р., Манандхар, Р., Манандхар, К., Шрирама, Л., и Бхаттараи, Т. (2014). Улучшение производства этанола за счет электрохимической окислительно-восстановительной комбинации дрожжевых клеток. Int. J. Biol. Sci. Прил. 1, 46–54. DOI: 10.13140 / RG.2.2.19735.06564
CrossRef Полный текст | Google Scholar
Камцев Дж., Суджанани Р., Янг, Э. С., Ян, Н., Мо, Н., Пол, Д. Р. и др.(2018). Зависимость ионной проводимости ионообменных мембран от концентрации соли. J. Membrane Sci. 547, 123–133. DOI: 10.1016 / j.memsci.2017.10.024
CrossRef Полный текст | Google Scholar
Khatiwada, D., and Silveira, S. (2011). Балансы парниковых газов этанола на основе патоки в Непале. J. Clean. Prod. 19, 1471–1485. DOI: 10.1016 / j.jclepro.2011.04.012
CrossRef Полный текст | Google Scholar
Мэтью, А.С., Ван, Дж., Луо, Дж., И Яу, С. Т. (2015). Повышенное производство этанола за счет электростатически ускоренной ферментации глюкозы с использованием Saccharomyces cerevisiae . Sci. Реп. 5, 1–6. DOI: 10.1038 / srep15713
Т. (2015). Повышенное производство этанола за счет электростатически ускоренной ферментации глюкозы с использованием Saccharomyces cerevisiae . Sci. Реп. 5, 1–6. DOI: 10.1038 / srep15713
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Макгилливрей А.М., Гоу Н.А.Р. (2009). Применяемые электрические поля поляризуют рост мицелиальных грибов. Microbiology 132, 2515–2525. DOI: 10.1099 / 00221287-132-9-2515
CrossRef Полный текст | Google Scholar
Миллер, Г.Л. (1959). Использование реактива динитросалициловой кислоты для определения редуцирующего сахара. Анал. Chem. 31, 426–428.
Google Scholar
Мохамуд, М.А. (2014). Неожиданное повышение окислительно-восстановительного потенциала и электрохимические характеристики псевдоемкости композитных пленок полианилин / поливиниловый спирт (PAn / PVA). Электрохим. Acta 139, 201–208. DOI: 10.1016 / j.electacta.2014.06.174
CrossRef Полный текст | Google Scholar
Moscoviz, R. , Toledo-Alarcón, J., Трабли, Э., Бернет, Н. (2016). Электро-ферментация: как запустить ферментацию с помощью электрохимических систем. Trends Biotechnol. 34, 856–865. DOI: 10.1016 / j.tibtech.2016.04.009
, Toledo-Alarcón, J., Трабли, Э., Бернет, Н. (2016). Электро-ферментация: как запустить ферментацию с помощью электрохимических систем. Trends Biotechnol. 34, 856–865. DOI: 10.1016 / j.tibtech.2016.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Парк, Д. Х., Лайвениекс, М., Геттлер, М. В., Джайн, М. К., и Зейкус, Дж. Г. (1999). Микробиологическое использование электрически восстановленного нейтрального красного в качестве единственного донора электронов для роста и производства метаболитов. Прил.Environ. Microbiol. 65, 2912–2917.
PubMed Аннотация | Google Scholar
Руйтерс, С., Мукерджи, В., Верстрепен, К. Дж., Тевелейн, Дж. М., Виллемс, К. А., и Ливенс, Б. (2015). Оценка потенциала диких дрожжей для производства биоэтанола. J. Ind. Microbiol. Biotechnol. 42, 39–48. DOI: 10.1007 / s10295-014-1544-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сайсирират П. и Джуммани Б. (2017). Исследование характеристик топливного элемента с микропрямым этанолом (Micro-DEFC) для применения с портативными электронными устройствами. Energy Proc. 138, 187–192. DOI: 10.1016 / j.egypro.2017.10.148
(2017). Исследование характеристик топливного элемента с микропрямым этанолом (Micro-DEFC) для применения с портативными электронными устройствами. Energy Proc. 138, 187–192. DOI: 10.1016 / j.egypro.2017.10.148
CrossRef Полный текст | Google Scholar
Schievano, A., Pepé Sciarria, T., Vanbroekhoven, K., De Wever, H., Puig, S., Andersen, S.J., et al. (2016). Электро-ферментация — слияние электрохимии с ферментацией в промышленных применениях. Trends Biotechnol. 34, 866–878. DOI: 10.1016 / j.tibtech.2016.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Seo, H.Б., Ким, Х. Дж., Ли, О. К., Ха, Дж. Х., Ли, Х. Й. и Юнг, К. Х. (2009). Измерение концентрации этанола с помощью экстракции растворителем и окисления дихромата и его применение в процессе производства биоэтанола. J. Ind. Microbiol. Biotechnol. 36, 285–292. DOI: 10.1007 / s10295-008-0497-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стейнбуш, К. Дж., Хамелерс, Х. В., Шаап, Дж. Д., Кампман, К., и Байсман, К. Дж. (2010). Биоэлектрохимическое производство этанола путем опосредованного восстановления ацетата смешанными культурами. Environ. Sci. Technol. 44, 513–517. DOI: 10.1021 / es
Дж., Хамелерс, Х. В., Шаап, Дж. Д., Кампман, К., и Байсман, К. Дж. (2010). Биоэлектрохимическое производство этанола путем опосредованного восстановления ацетата смешанными культурами. Environ. Sci. Technol. 44, 513–517. DOI: 10.1021 / es
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан X., Го К., Ли Х., Ду З. и Тиан Дж. (2010). Характеристики мембран микрофильтрации в двухкамерных микробных топливных элементах. Biochem. Англ. J. 52, 194–198. DOI: 10.1016 / j.bej.2010.08.007
CrossRef Полный текст | Google Scholar
Тойт Д. М., Преториус И. С. (2000). Микробная порча и консервация вина: с помощью оружия из собственного арсенала природы — обзор. S. Afr. J. Enol. Витич. 21, 74–96.
Google Scholar
Вич, Р. Л., Гинн, Р., Велозо, Д. (1972). Динамика воздействия этанола на окислительно-восстановительные и фосфорилирующие состояния печени крыс. Biochem. J. 127, 387–397. DOI: 10.1042 / bj1270387
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Х. , Кумар Р. и Майерс Д. Дж. (2006). Влияние напряжения на растворение платины. Электрохим. Sol.State Lett. 9, A225 – A227. DOI: 10.1149 / 1.2180536
, Кумар Р. и Майерс Д. Дж. (2006). Влияние напряжения на растворение платины. Электрохим. Sol.State Lett. 9, A225 – A227. DOI: 10.1149 / 1.2180536
CrossRef Полный текст | Google Scholar
Янг Э., Чой М. Дж., Ким К. Ю., Чаэ К. Дж. И Ким И. С. (2015). Влияние начальных концентраций соли на производительность клеток и распределение внутреннего сопротивления в микробных опреснительных клетках. Environ. Technol. 36, 852–860. DOI: 10.1080 / 09593330.2014.964333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Яу, С. Т., Сюй, Ю., Сонг, Ю., Фэн, Ю., и Ван, Дж. (2013). Катализируемое ферментом преобразование глюкозы в глюконолактон с регулируемым напряжением с использованием полевого ферментативного детектора. Phys. Chem. Chem. Phys. 15, 20134–20139. DOI: 10.1039 / c3cp52004h
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Этанол: что это такое? — этанол
Этанол — это зерновой спирт, который можно смешивать
с бензином и используется в автотранспортных средствах. Многие заправочные станции предоставляют смешанное топливо,
который обычно составляет 10 процентов этанола и 90
процентов бензина.Транспортные средства не нужны
модификации для использования этой смеси топлива. Гибкое топливо
автомобили с модификациями топлива
систем, можно использовать E85, который представляет собой смесь
до 85 процентов этанола и 15 процентов бензина.
С доработками эти автомобили могут использовать
чистый бензин или любая смесь этанола до
85 процентов.
Многие заправочные станции предоставляют смешанное топливо,
который обычно составляет 10 процентов этанола и 90
процентов бензина.Транспортные средства не нужны
модификации для использования этой смеси топлива. Гибкое топливо
автомобили с модификациями топлива
систем, можно использовать E85, который представляет собой смесь
до 85 процентов этанола и 15 процентов бензина.
С доработками эти автомобили могут использовать
чистый бензин или любая смесь этанола до
85 процентов.
2008 Производство этанола в США
180+ заводов по производству этанола:
Более 3 миллиардов бушелей кукурузы используются для производства этанола производство (23% U.S. производство) =
Произведено 9,2 миллиарда галлонов этанола (емкость примерно 10 миллиардов галлонов)
Откуда это?
Этанол можно сбраживать из многих источников
крахмала, в том числе кукурузы, пшеницы, зерна сорго,
ячмень, и картофель, и из сахара
такие культуры, как сахарный тростник и сладкое сорго. Поскольку было много
поставка кукурузы, большая часть этанола производится в
Соединенные Штаты из кукурузы.Большая часть этанола производится на Среднем Западе.
и Верхний Средний Запад, где расположены заводы по производству этанола.
близко к кукурузе и имеют постоянные запасы кукурузы,
доступ к водным ресурсам и животноводство
производство рядом. Побочный продукт этанола
продукция — зерно дистилляторов, которое можно скармливать
животным, влажным или сушеным. Поскольку
зерно мокрых дистилляторов скоропортящееся и тяжелое,
что увеличивает транспортные расходы, они
обычно используется в радиусе 100 миль от этанола
растение.Зерна дистилляторов более стабильны и
легче транспортировать, если производитель этанола
сушит их, однако увеличивает энергию
стоимость для производителя этанола. Дистилляторы зерна
сохраняют многие питательные вещества из кукурузы, так как
был удален только крахмал. Из-за
высокое содержание клетчатки в большинстве зерен дистилляторов
скармливают мясному и молочному скоту, однако
также может использоваться в качестве корма для птицы и свиней.
Поскольку было много
поставка кукурузы, большая часть этанола производится в
Соединенные Штаты из кукурузы.Большая часть этанола производится на Среднем Западе.
и Верхний Средний Запад, где расположены заводы по производству этанола.
близко к кукурузе и имеют постоянные запасы кукурузы,
доступ к водным ресурсам и животноводство
производство рядом. Побочный продукт этанола
продукция — зерно дистилляторов, которое можно скармливать
животным, влажным или сушеным. Поскольку
зерно мокрых дистилляторов скоропортящееся и тяжелое,
что увеличивает транспортные расходы, они
обычно используется в радиусе 100 миль от этанола
растение.Зерна дистилляторов более стабильны и
легче транспортировать, если производитель этанола
сушит их, однако увеличивает энергию
стоимость для производителя этанола. Дистилляторы зерна
сохраняют многие питательные вещества из кукурузы, так как
был удален только крахмал. Из-за
высокое содержание клетчатки в большинстве зерен дистилляторов
скармливают мясному и молочному скоту, однако
также может использоваться в качестве корма для птицы и свиней.
США этанол Производство Сырье
90% кукуруза 10% пшеница / сорго
Как это производится?
На большинстве новых заводов по производству этанола, также известных
как растения для «сухого помола» зерна кукурузы
мелко измельчить на мелкие частицы.Тогда вода
добавлен в молотую кукурузу вместе с ферментами
преобразовать крахмал для брожения. Микстура,
также известный как пюре, готовится, чтобы сломать
крахмал вниз. Пюре удалено
из плит и дать остыть перед
второй фермент (глюкоамализ) добавляется к
пюре. Этот фермент помогает превратить жидкий крахмал
в сахара. В затор добавляются дрожжи и
брожение создает этанол и углерод
диоксид. Примерно через два дня ферментация
процесс завершен и затор нагревается
снова.В процессе нагрева этанол
испаряется в пар, который собирается,
а оставшиеся сухие вещества кукурузы и дрожжей
оставаться. Пары этанола охлаждаются и конденсируются.
в жидкость. Эта жидкость обезвоживается до
удалить из этанола лишнюю воду, сделав
«безводный» этанол, пригодный для смешивания с
бензин.
Эта жидкость обезвоживается до
удалить из этанола лишнюю воду, сделав
«безводный» этанол, пригодный для смешивания с
бензин.
1 бушель кукурузы (56 фунтов) = 2,8 галлона этанола + 17 фунты дистилляторов зерна
В процесс сухого измельчения, который:
- повысить энергоэффективность
- сократить водопотребление
- уменьшить размер и сложность этанола завод
- получить больше продуктов с добавленной стоимостью из зерно помимо этанола, углекислого газа и зерна дистилляторов.
Эти инновации и непрерывный процесс исследования создают лучшие экономические возможности в производстве зернового этанола, и меняются способы взглянуть на завод по производству этанола как на сообщество инвестиции.
Этанол можно также производить путем мокрого помола.
процесс, который разделяет кукурузу на несколько разных
компоненты и предоставляет множество вариантов завершения
продукты, в том числе этанол. Мокрые мельницы — это много
более сложный и имеет гораздо больший капитал
стоимость, чем установки сухого помола.
Мокрые мельницы — это много
более сложный и имеет гораздо больший капитал
стоимость, чем установки сухого помола.
Несмотря на созданную базу заводов по производству этанола использование крахмалосодержащих зерен в качестве исходного сырья, другие интересные способы приготовления топливных спиртов путем брожения существуют. Целлюлоза, самая распространенная биоматериал на земле, состоит из молекулы сахара, которые можно расщепить и ферментированный определенными организмами и / или ферментами. В настоящее время исследователи изучают способы сделать этанол из целлюлозы, которая извлекается из биомасса, такая как кукурузные початки, кукурузная солома (стебли и листья), солома из пшеницы или риса, многолетнее травы, такие как мискантус и просо, и древесные отходы от лесного хозяйства и бумаги отрасли.
Как транспортируется этанол?
Автомобильные и железнодорожные перевозки являются основными видами транспорта.
подачи этанола на смесительные терминалы,
где этанол смешивают с бензином с образованием
Смеси E-10 или E-85 для использования в потребительских двигателях. В настоящее время этанол не транспортируется по трубопроводам.
которые разработаны и используются для нефтяных
продукты, однако несколько компаний тестируют
доставка этанола этим способом. Используя более дорогой
рост грузовых, железнодорожных и баржных перевозок
затраты на рынки, наиболее далекие от
заводы по производству этанола.
В настоящее время этанол не транспортируется по трубопроводам.
которые разработаны и используются для нефтяных
продукты, однако несколько компаний тестируют
доставка этанола этим способом. Используя более дорогой
рост грузовых, железнодорожных и баржных перевозок
затраты на рынки, наиболее далекие от
заводы по производству этанола.
Как это используется?
Этанол — хорошее топливо для искрового зажигания. двигатели. Он имеет высокое октановое число, что делает его привлекательно как антидетонационная присадка в бензин. Это может использоваться как добавка к дизельному топливу (биодизель). Этанол также является важным сырьем для химическая индустрия.
Чистый прирост энергии в производстве
Производство этанола дает чистый прирост энергии —
согласно некоторым авторитетным анализам жизненного цикла —
производит примерно на 67 процентов больше энергии
чем нужно, чтобы вырастить и переработать кукурузу в
этиловый спирт. 1 Часто цитируемый энергетический баланс может
вводить в заблуждение, поскольку промышленность по производству этанола
быстро меняется для повышения эффективности
и производить больше продуктов с добавленной стоимостью из
зерновое сырье. 2 Один из способов увеличения
эта эффективность заключается в создании целлюлозного этанола из
побочный продукт DDGS, который уже находится в этаноле
сажайте и используйте кукурузные початки и кукурузную солому
(листья и стебли) в качестве топлива вместо природного газа.
1 Часто цитируемый энергетический баланс может
вводить в заблуждение, поскольку промышленность по производству этанола
быстро меняется для повышения эффективности
и производить больше продуктов с добавленной стоимостью из
зерновое сырье. 2 Один из способов увеличения
эта эффективность заключается в создании целлюлозного этанола из
побочный продукт DDGS, который уже находится в этаноле
сажайте и используйте кукурузные початки и кукурузную солому
(листья и стебли) в качестве топлива вместо природного газа.
Список литературы
1. Улучшения в жизни Энергоэффективность цикла и Выбросы парниковых газов кукурузо-этанол, Адам Дж. Лиска, Хайшун С. Ян, Вирджил Р. Бремер, Терри Дж. Клопфенштейн, Дэниел Т. Уолтерс, Гален Эриксон, и Кеннет Г. Кассман. Журнал промышленной экологии.
Ресурсы
Научный центр биоэнергетики (Национальная лаборатория Окриджа)
http://bioenergycenter.org/
Организация переработчиков кукурузы (мокрый помол)
http: // www. corn.org/
corn.org/
Управление энергетической информации (Министерство энергетики США)
http://www.eia.doe.gov/fuelrenewable.html
Исследовательский центр биоэнергетики Великих озер
http://www.greatlakesbioenergy.org/
Объединенный научно-исследовательский институт биоэнергетики
http://www.jbei.org/
Национальная ассоциация производителей кукурузы
http://www.ncga.com/
Ассоциация возобновляемых источников топлива
http://www.ethanolrfa.org/
USDA | Служба сельскохозяйственных исследований
Bioenergy Research
http: // www.ars.usda.gov/research/programs/programs.htm?NP_CODE=307
Национальный центр исследований использования сельского хозяйства
http://www.ars.usda.gov/Main/docs.htm?docid=3153
USDA | Служба аграрного маркетинга
http://www.ams.usda.gov
Агентство по охране окружающей среды США
Альтернативные виды топлива
http://www.epa.gov/otaq/consumer/fuels/altfuels/altfuels.

