Получение в промышленности серной кислоты – Урок №22. Производство серной кислоты контактным способом
Глава 4 Производство серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это тем, что она самая дешевая из всех кислот, а также ее свойствами. Серна кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот.
Области применения серной кислоты чрезвычайно обширны. Она применяется при получении минеральных удобрений, кислот, солей, взрывчатых веществ, в металлургической, текстильной, пищевой промышленности и т.д.
Химическая промышленность выпускает три вида товарной кислоты:
— башенная кислота — 75%
-контактная кислота — 92,5%
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики. Чаще всего сера находится в природе в форме сульфидов или сульфатов металлов, а также входит в состав нефти, каменного угля. Природного и попутного газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV). Причем доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
Основные этапы получения серной кислоты.
Получение серной кислоты из самородной серы состоит из трех стадий: 1- получение диоксида серы обжигом элементарной серы, 2- окисление оксида серы(IV) в оксид серы(VI), 3- абсорбция триоксида серы.
1.Получение обжигового газа из серы.
S +O2 = SO2 (4.1.)
При сжигании серы протекает необратимая экзотермическая реакция с выделением очень большого количества теплоты: ΔН=-362,4 кДж/моль.
Сначала серу расплавляют, потом сжигают. Процесс гомогенный, т.к. теплоты реакции горения серы достаточно для ее испарения.
Процесс сжигания можно проводить в печах двух типов: форсуночные и циклонные.
Концентрация диоксида серы зависит от соотношения серы и воздуха. Воздух берут в избытке для снижения температуры в печи.
Процесс проводят при температуре 13000С и получают обжиговый газ, содержащий 13-14% SO2.
Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты.
2. Контактное окисление оксида серы (IV).
SO2 + 0,5O2 = SO3 + Q (4.2.)
Реакция окисления сернистого газа в серный простая, обратимая, экзотермическая.
С термодинамической точки зрения для смещения равновесия в сторону образования продукта необходимо: снижать температуру, увеличивать давление, использовать избыток одного из компонентов, а также выводить продукт из зоны реакции.
С кинетической точке зрения для увеличения скорости процесса необходимо повышать температуру. Однако, даже при высоких температурах реакция в газовой фазе не идет из-за высокой энергии активации. Для ее снижения процесс окисления сернистого газа в серный проводят на поверхности твердого катализатора.
Выбор оптимальных условий проведения процесса.
Катализатор.
Процесс окисления диоксида серы с заметной скоростью для различных катализаторов начинается при определенной температуре – температуре зажигания. Реакция ускоряется в присутствии платины (Е=70 кДж/моль) при температуре 2500С, оксида железа (III) ( Е=150 кДж/моль) при температуре 5500С, оксида ванадия (V) при температуре не ниже 4000С ( Е= 90 кДж/моль).
Платиновый катализатор обладает наибольшей активностью, однако дорог и быстро отравляется ядами (мышьяком, селеном, хлором). Оксид железа (III) – малоактивный катализатор.
Ванадиевая
контактная масса, например, марки БАВ
имеет примерный состав: V2O
Активными
компонентами ванадиевых катализаторов
являются сульфо- и пиросульфованадаты
калия, которые в условиях проведения
реакции находятся в расплавленном
состоянии на поверхности кремнеземистого
носителя. Формы контактной массы –
гранулы, кольца. Рабочий интервал
температур 400-6500С.
При температурах выше 6500С
активность катализатора уменьшается
из-за разрушения активного комплекса
V2O5K2S2O7 до кристаллического пентаоксида
ванадия, который катализатором не
является. При температурах ниже 4000С
возможно образование каталитически
неактивного соединения – сульфата
ванадила VOSO
Гетерогенно-каталитический процесс окисления диоксида серы в триоксид состоит из следующих стадий:
1). Перенос газообразных веществ из объема к поверхности катализатора ( внешняя диффузия).
2). Диффузия реагирующих веществ внутри пор катализатора (внутренняя диффузия).
3). Абсорбция SO2 и O2 на катализаторе.
4). Химическое взаимодействие исходных веществ с участием катализатора.
5). Десорбция SO3.
6). Диффузия SO3 внутри зерна катализатора к его поверхности (внутренняя диффузия).
7). Отвод продукта реакции в газовую фазу (внешняя диффузия).
Скорость всего процесса определяется скоростью наиболее медленной стадии. В выбранных условиях общая скорость окисления серы (IV) определяется скоростью химической реакции, т.е. протекает в кинетической области.
Температура.
Температура выбирается в пределах работы катализатора. Для получения высокого выхода оксида серы (VI) необходима минимальная температура- 4000С, так как реакция обратимая и экзотермическая. Однако скорость процесса при этой температуре мала даже в присутствии катализатора.
Выбор температурного режима, обеспечивающего высокую скорость обратимой экзотермической реакции, довольно сложен, так как изменение температуры различно сказывается на равновесном выходе продукта и на средней скорости процесса.
Если вести процесс при постоянной температуре 6000С, то реакция идет быстро, но, в соответствии с состоянием равновесия, выход целевого продукта уменьшается.
Если вести процесс при постоянной температуре 4000С, получим высокий выход, однако скорость процесса будет чрезвычайно мала.
Для обеспечения высокой интенсивности процесса необходимо проводить окисление оксида серы (IV) при меняющемся температурном режиме.
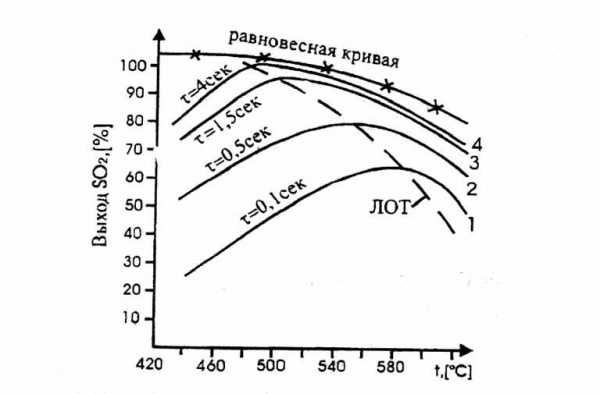
Рис.4.2. Зависимость практического выхода SO3 от температуры при различном времени контактирования.
На рис.4.2 приведен
график зависимости равновесного и
практических выходов от температуры.
С увеличением времени контактирования
максимумы на кривых смещаются в сторону
более низких температур. Кривую,
соединяющую эти максимумы, называют
линией оптимальных температур (ЛОТ).
При проведении процесса по линии
оптимальных температур окисление оксида
серы (IV)
протекает с максимально возможными
скоростями в каждый момент. Понижение
температуры к концу процесса с 600 до
400
Давление.
Процесс идет с уменьшением объема, поэтому для смещения равновесия вправо необходимо давление увеличивать. В зависимости от выбранной температуры эффективность воздействия давления различна. При низких температурах, когда равновесные степени контактирования оксида серы (IV) высокие, давление незначительно сказывается на смещении равновесия. При высоких температурах, когда окисление происходит далеко не полностью, давление может стать одним из решающих факторов, обеспечивающих высокую степень контактирования. Повышенное давление имеет значение для агрегатов большой единичной мощности.
В обычных условиях процесс проводят при давлении 0,1 МПа, так как смещения равновесия добиваются другими путями. Степень превращения SO2 составляет в среднем 99,5-99,8%.
Соотношение исходных компонентов.
При стехиометрическом соотношении превращение протекает недостаточно полно. Для смещения равновесия в сторону продукта реакции необходимо брать в избытке один из компонентов. Наиболее оптимальным является следующий состав газовой смеси: 11%O2, 7%SO2, 82%N2, т.е. кислород подают в избытке. Если взять избыток диоксида серы, то произойдет перегрев катализатора, что может вывести его из строя.
Таким образом, процесс окисления оксида серы(IV) в оксид серы (VI) является: простым, обратимым, экзотермическим, гетерогенно-каталитическим. Для получения максимальных выхода и скорости процесса его проводят по линии оптимальных температур (ЛОТ).
Конструкция контактного аппарата должна обеспечить возможность проведения каталитического окисления диоксида серы в условиях оптимального технологического режима. В контактном аппарате расположены пять слоев катализатора. Сначала газ проходит первые три слоя, причем, для реализации линии оптимальных температур он выводится после прохождения каждого слоя в выносные теплообменники для охлаждения.
Р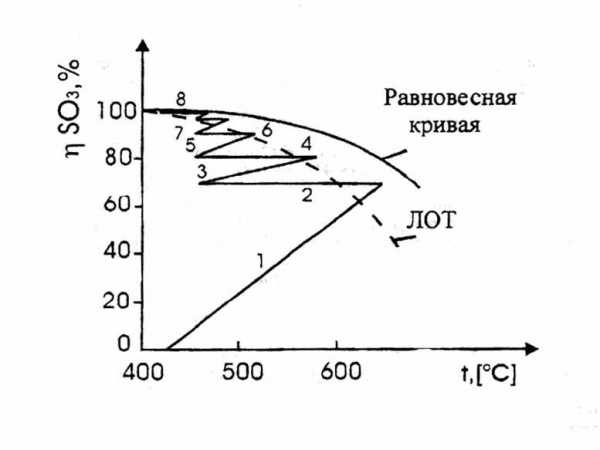 ис.
4.3. Изменение температуры и выхода при
четырехступенчатом контактировании в
аппарате со стационарными слоями
катализатора:
ис.
4.3. Изменение температуры и выхода при
четырехступенчатом контактировании в
аппарате со стационарными слоями
катализатора:
1, 3, 5, 7 –слои катализатора, 2, 4, 6, 8 – промежуточные теплообменники.
После третьего слоя газ попадает в моногидратный абсорбер и затем подается на 4 и 5 слои катализатора. Т.е. процесс окисления диоксида серы проводят по методу двойного контактирования, (рис.4.4.)
Вывод продукта из зоны реакции смещает равновесие в сторону образования целевого продукта.
3. Абсорбция триоксида серы.
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту.
Абсорбция SO3 является гетерогенным процессом и
скорость его равна: r
= k.F.( 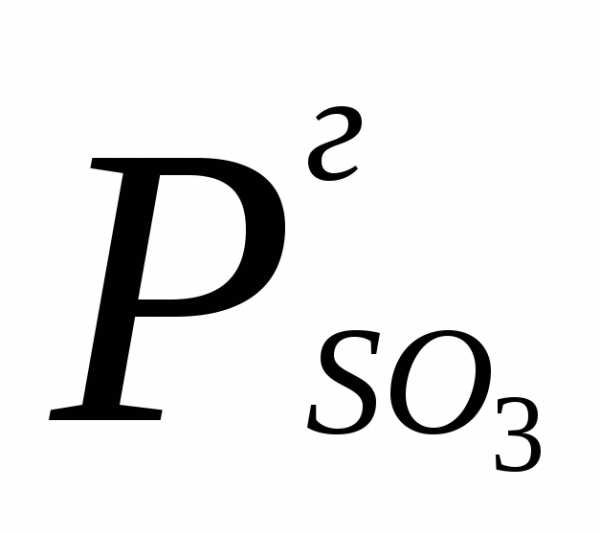 —
—  ),
где
),
где 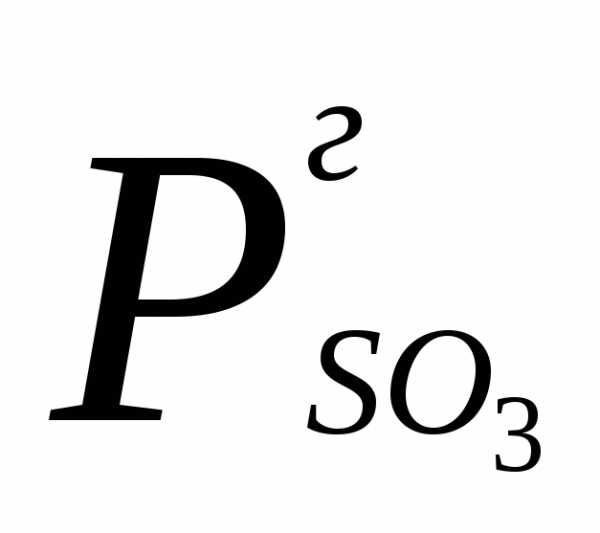 — давление газа,
— давление газа,  —
парциальное давление, давление паров
SO3 над растворителем.
—
парциальное давление, давление паров
SO3 над растворителем.
Для увеличения движущей силы процесса необходимо, чтобы парциальное давление паров SO3 было минимальным. Однако в качестве абсорбента нельзя использовать растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергироваться в инертной газовой среде – азоте, т.е. с образованием сернокислотного тумана.
Оптимальным абсорбентом является 98,3% серная кислота – моногидрат, соответствующий азеотропному составу. Над поверхностью такой кислоты практически нет ни паров воды, ни паров SO3.
Протекающий при этом процесс можно условно описать уравнением:
SO3 + mH2SO4 + H2O = (m + 1) H2SO4 + Q (4.3.)
Использование в качестве поглотителя менее концентрированной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью.
При высоких температурах над 98,3%-ной серной кислотой может быть значительным парциальное давление самой кислоты, что также будет снижать степень абсорбции SO3. Ниже 1000С равновесное давление паров серной кислоты очень мало и поэтому может быть достигнута практически 100%-ная степень абсорбции.
Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 1000С.
Технологическая схема производства серной кислоты из серы по методу двойного контактирования (ДК) изображена на рис.12.4.
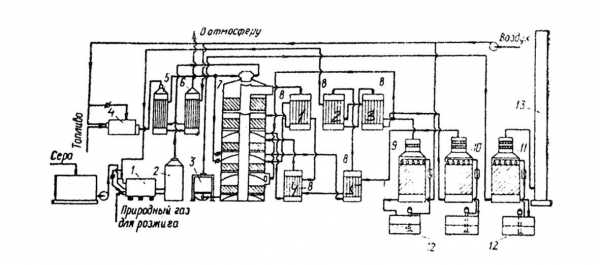
Рис.4.4. Схема производства серной кислоты из серы по методу ДК.
1 –серная печь, 2 –котел-утилизатор, 3 –экономайзер, 4 –пусковая топка, 5, 6 –теплообменники пусковой топки, 7 –контактный аппарат, 8 –теплообменники, 9 –сушильная башня, 10, 11 – первый и второй моногидратные абсорберы, 12 –сборники кислоты, 13 –выхлопная труба.
Серу подают в печь 1, пропуская через плавитель, где она плавится. Также в печь 1 подают воздух, осушаемый в сушильной башне 9, орошаемой 93% серной кислотой. Воздух предварительно нагревается в теплообменниках-8.2, 8.3. Из печи 1 газ (SO2) поступает в котел-утилизатор 2, где охлаждается до 4400С и направляется в контактный аппарат 7. Воздух нагревается в топке 4, в теплообменниках 5 и 6 и направляется в контактный аппарат. В контактном аппарате размещены пять слоев катализатора.
Для реализации линии оптимальных температур газ после каждого слоя катализатора необходимо охладить. С этой целью предусмотрена система теплообменников 8.
Таким образом, газовая смесь (SO2 и воздух) после первого слоя катализатора направляется в теплообменник 8.1, затем на второй слой катализатора. После второго слоя газ охлаждается в теплообменнике 8.4 и поступает на третий слой катализатора. После третьего слоя газ, пройдя теплообменники 8.5, 8.2, 8.3, направляется в первый моногидратный абсорбер 10, который орошается 98,3% серной кислотой. После первого моногидратного абсорбера газ поступает на четвертый слой катализатора в контактном аппарате, предварительно пройдя теплообменники 8.3, 8.2 и 8.5. После четвертого слоя вводят дополнительно воздух для охлаждения и интенсификации процесса. После четвертого слоя газ поступает на пятый слой, выходит из контактного аппарата и направляется для подогрева воды в экономайзер 3 и уже оттуда попадает во второй моногидратный абсорбер 11, где происходит окончательное поглощение триоксида серы. Выхлопные газы отводятся из второго моногидратного абсорбера через выхлопную трубу 13. Товарная серная кислота – 92,5% постоянно выводится из сушильной башни 9.
Важнейшими тенденциями развития производства серной кислоты являются: повышение концентрации SO3 в технологических газах, циклическая система производства, разработка низко-температурных катализаторов, использование теплоты реакций на всех стадиях для выработки водяного пара.
studfiles.net
Производство серной кислоты
Производство серной кислоты
Содержание
Введение
. Технологическая часть
.1 Серная кислота: физико-химические свойства и применение
.2 Способы получения серной кислоты
.3 Характеристика исходного сырья
. Технологическая схема производства серной кислоты контактным способом
.1 Производство серной кислоты из железного колчедана
.2 Печи для обжига колчедана
. Расчетная часть
.1 Материальный баланс
.2 Тепловой баланс
. Охрана окружающей среды, связанная с производством серной кислоты
Заключение
Список использованной литературы
Введение
Серная кислота — важнейший продукт основой химической промышленности. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Объясняется это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и ее свойствами. Серную кислоту применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, в концентрированном виде не корродирует черные металлы, способна образовывать многочисленные устойчивые соли и является дешевым сырьем для различных производств. Крупнейшим потребителем серной кислоты в настоящее время является промышленность фосфорных и азотных минеральных удобрений, таких как сульфат аммония, аммофос, суперфосфат и др. Простой суперфосфат получают обработкой апатитов и фосфоритов серной кислотой. Применение минеральных удобрений способствует повышению урожайности сельскохозяйственных культур и содержания в них полезных веществ. Кроме того, серная кислота применяется для производства некоторых кислот (фосфорной, соляной, уксусной), сульфатов, искусственных волокон, лаков, красок, пластмасс, моющих средств, взрывчатых веществ, лекарственных препаратов, ядохимикатов, а также при производстве цветных и редких металлов, спиртов, эфиров. Она расходуется на очистку нефтепродуктов, в качестве электролита в кислотных аккумуляторах, в машиностроении — на подготовку поверхности металлов при нанесении гальванических покрытий. В металлообрабатывающей промышленности серная кислота и ее соли применяют для травления стальных изделий. Прежде, чем найти применение веществу, сначала подробно изучают его физические и химические свойства. После этого становятся ясны границы использования вещества.
1. Технологическая часть
.1 Серная кислота: физико-химические свойства, применение
Физические свойства
Серная кислота h3SO4- сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3: h3O 1, — раствор SO3 в серной кислоте (олеум). Реактивная серная кислота имеет обычно плотность 1,84 г/см3 и содержит около
% h3SO4. Затвердевает она лишь ниже -20 °С. Температура плавления моногидрата равна 10,37 °С при теплоте плавления 10,5 кДж/моль. В обычных условиях он представляет собой очень вязкую жидкость с весьма высоким значением диэлектрической проницаемости (e = 100 при 25 °С). Стандартная энтальпия образования ДH=298 кДж/моль. Стандартная энергия Гиббса образования ДG=298 кДж/моль. Стандартная энтропия образования S=298 Дж/моль·K. Стандартная мольная теплоемкость Cp =298 Дж/моль·K.
Химические свойства
Серная кислота — сильная двухосновная кислота, диссоциация ее протекает по двум ступеням:
SO4 = H+ + HSO4- — первая ступень=H+ + SO42- — вторая ступень
В концентрированных растворах диссоциация серной кислоты по второй ступени незначительна.
Серная кислота — сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу из воздуха (гигроскопична), отнимает воду от кристаллогидратов:
SO4 конц. +CuSO4*5h3O голубой = CuSO4 белый + 5h3O;
углеводов:
(обугливает дерево и бумагу):
h3SO4конц.+ C12h32O= 12C + 11h3O ;
спиртов:
SO4 конц.+ C2H5OH = Ch3=Ch3 + h3O
Серная кислота проявляет все свойства сильных кислот:
а) взаимодействует с основными оксидами, например:
+ h3SO4 = CuSO4 + h3O
б) с основаниями, например:
NaOH + h3SO4= Na2 SO4 + 2h3O
в) вытесняет другие кислоты из их солей, например те, которые слабее нее:
+ h3SO4 = CaSO4 + CO2 + h3O
или более летучие (обладающие температурами кипения ниже, чем у серной кислоты):тв. + h3SO4 конц= NaH SO4 + HNO3- при нагревании.
В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты (неокислитель) — при этом восстанавливаются ионы Н+, например: Fe + h3SO4 разб= Fe SO4 + h3. Разбавленная h3SO4 не взаимодействует с металлами, стоящими в ряду напряжений правее водорода. Концентрированная серная кислота — кислота-окислитель, при этом восстанавливается сера (+6). Она окисляет металлы, стоящие в ряду напряжений правее водорода: Cu + 2 h3SO4конц= Cu SO4 + SO2 + 2h3O и металлы, стоящие левее водорода, при этом сера восстанавливается до степени окисления +4, 0 и -2:
Zn + 2 h3SO4 = Zn SO4+ SO2 + 2h3O (1.12) 3Zn + 4 h3SO4 = 3Zn SO4 + S + 4h3O
Zn + 5 h3SO4 = 4Zn SO4 + h3S + 4h3O
Железо, алюминий, хром концентрированной серной кислотой пассивируются (не реагируют), однако при сильном нагревании реакция начинается, например:
2Fe + 6 h3SO4 = Fe2(SO4)3 + 3SO2 + 6h3O.
Концентрированная серная кислота окисляет неметаллы, например:
C + 2 h3SO4 = CO2 + 2SO2 + 2h3O (1.16) S +2 h3SO4 = 3SO2 + 2h3O
Концентрированная серная кислота окисляет также сложные вещества, например HI и HBr:
2HBr + h3SO4 = Br2 + SO2 + 2h3O
8HI + h3SO4 = 4I2 + h3S + 4h3O ;
соли железа:
Fe SO4 + 2 h3SO4 = Fe2(SO4)3 + 2h3O + SO2.
Серную кислоту выпускают нескольких сортов. Они отличаются концентрацией и количеством примесей. Для производства медицинских препаратов, особо чистых реактивов, для заливки аккумуляторов требуется чистая кислота. При травлении металлов, в производстве суперфосфата можно воспользоваться кислотой, имеющей некоторые загрязнения. Экономически это выгодно. Такая кислота более дешевая.
Сернокислотная промышленность выпускает так называемый олеум, используемый при производстве некоторых органических препаратов, взрывчатых веществ. Олеум представляет собой раствор серного ангидрида в серной кислоте. Сорта олеума различаются по концентрации серного ангидрида в серной кислоте. Для некоторых особых целей выпускают олеум, содержащий серного ангидрида до 60%. Так, кислота серная техническая и олеум технический(ГОСТ 2184-77) применяются в производстве различных солей, кислот, всевозможных органических продуктов, красителей, взрывчатых веществ, минеральных удобрений, в качестве водоотнимающего и осушающего средства, в процессах нейтрализации, травления и многих других. Эти продукты не горючи и относятся к веществам 2-го класса токсичности.
Рис. 1
Серная кислота находит самое широкое применение. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т Р2О5 фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (Nh5)2SO4 — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений. Серная кислота также используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей, используется в производстве красителей, для зарядки аккумуляторов, в металлургии серную кислоту применяют для обнаружения микротрещин в готовой продукции, на металлообрабатывающих заводах серную кислоту используют в цехах гальванопокрытий. Как известно, перед нанесением на металлические изделия электрическим методом никеля, хрома, меди их нужно тщательно очистить, протереть, обезжирить и, наконец, выдержать непродолжительное время в ванне с раствором серной кислоты. При этом она растворяет тончайший слой металла и с ним удаляются следы загрязнений. В то же время поверхность металла становится более шершавой: на ней появляются микроскопические углубления и выступы. Электролитические покрытия к такой поверхности лучше пристают и более прочно сцеплены с металлом. Также серная кислота необходима для переработки различных руд и ископаемых. При переработке руд редких металлов большое значение имеет кислотный способ их расщепления. Обычно для этой цели используют наиболее дешевую нелетучую серную кислоту. Измельченную руду смешивают в определенной пропорции с серной кислотой и нагревают. Полученный раствор и осадок дальше перерабатывают химическим путем, исходя из химических свойств того элемента, который нужно выделить из раствора. На химическую переработку руд редких элементов расходуют тысячи тонн серной кислоты. Большое количество серной кислоты требуется нефтеперерабатывающей промышленности для очистки нефти и ее различных фракций. В органическом синтезе концентрированная серная кислота — необходимый компонент при получении многих красителей и лекарственных веществ. Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль Nа2SO4 * 10Н2О) применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса (СаSO4 * 2Н2О) и безводной соли ангидрита (Са SO4). Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600-700 оС) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др. Сульфат магния, или горькая соль (МgSO4*7Н2О) применяется в медицине как слабительное. Сульфат железа (II), или железный купорос (FеSO4*7Н2О) применяется для приготовления желтой кровяной соли (К4[Fе(СN)6]), чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос (СuSO4*5Н2О) применяется для борьбы с различными грибками — вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди. Из растворов, содержащих сульфат трехвалентного металла (Fе3+, Аl3+, Сг3+) и сульфат одновалентного металла (К+, NН4+, Rb+), выкристаллизовываются двойные соли типа К2 SO4Al2(SO4)32*4h3O или КАl(SO4)3*12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, т. е. как смесь сульфатов одно- и трехвалентных металлов. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
1.2 Способы получения серной кислоты
Еще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в.
В зависимости от того, как осуществляется процесс окисления SO2 в SO3, различают два основных метода получения серной кислоты. В контактном методе получения серной кислоты процесс окисления SO2 в SO3 проводят на твердых катализаторах. Триоксид серы переводят в серную кислоту на последней стадии процесса — абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции: SO3 + h3O = h3SO4
При проведение процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота. Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота: SO2 + N2O3 + h3O= h3SO4 + 2NO
В настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
1.3 Характеристика исходного сырья
Сырьевая база производства серной кислоты — серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепереработке.
Исходными реагентами для получения серной кислоты могут быть элементная сера и серосодержащие соединения, из которых можно получить либо серу, либо диоксид серы. Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты получают из серы, треть — из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы. В то же время отходящие газы — наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
2. Технологическая схема производства серной кислоты контактным способом
серный кислота железный колчедан
2.1 Производство серной кислоты из железного колчедана
Производство серной кислоты включает в себя следующую последовательность стадий:
Обжиг серного колчедана или серы.
Окисление диоксида серы.
Абсорбция триоксида серы.
Исходные вещества — минеральное сырье — содержит примеси, поэтому выходящие со стадии обжига газы подвергаются очистке. Первая стадия — обжиг, специфичен для каждого вида сырья, и далее она будет рассматриваться для колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления и абсорбции в основном одинаковы в разных способах получения серной кислоты. Поэтому эти стадии будут рассмотрены как типовые процессы.
Рис. 2 — Технологическая схема производства серной кислоты из колчедана: 1- печь; 2- система гидроудаления огарка; 3- котел-утилизатор; 4- циклон с пересыпным устройством; 5- сухой электрофильтр; 6- полая промывная башня; 7- насадочная промывная башня; 8,9- мокрые электрофильтры; 10- сушильная башня; 11- фильтр-брызгоуловитель; 12- турбогазодувка; 13- теплообменники контактного узла; 14- контактный аппарат; 15- пусковой подогреватель; 16- теплообменник; 17- второй моногидратный абсорбер; 18- сборник кислоты; 19 — холодильник; 20- первый моногидратный абсорбер; 21- олеумный абсорбер; 22- холодильник воздушного охлаждения кислоты
Технологическая схема производства серной кислоты из железного колчедана с использованием принципа двойного контактирования показана на рис.1. Колчедан через дозатор подают в печь 1 кипящего слоя. Полученный запыленный обжиговый газ, содержащий 13 % SO2 и имеющий на выходе из печи температуру около 700°С, подают сначала в котел-утилизатор 3, а затем на стадию сухой очистки от огарковой пыли (в циклоны 4 и в сухой электрофильтр 5). В котле-утилизаторе 3 происходит охлаждение газа с одновременным получением энергетического водяного пара (давление 4 МПа и температура 450 °С), который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода.
В очистном отделении, состоящем из двух промывных башен 6 и 7, двух пар мокрых электрофильтров 8 и 9 и сушильной башни 10, происходит очистка газа от соединений мышьяка, селена, фтора и его осушка.
Первая полая промывная башня 6 работает в испарительном режиме: циркулирующая кислота охлаждает газ, при этом теплота затрачивается на испарение воды из кислоты, поступающей на орошение. Концентрацию орошающей кислоты в первой башне, равную 40… 50%-ной h3SO4, поддерживают постоянной путем разбавления 10… 15%-ной кислотой из второй промывной башни 7. Кислота из второй башни поступает в сборник 18 и после охлаждения возвращается на орошение.
После второй промывной башни газ проходит последовательно две пары мокрых электрофильтров 8 и 9, затем насадочную сушильную башню 10, орошаемую 93…94%-ной серной кислотой при температуре 28…30°С. Кислота циркулирует между сушильной башней 10 и сборником 18, часть кислоты отводится как готовая продукция на склад. Для поддержания постоянной концентрации h3SO4 в сборник кислоты 18 вводят 98… 99%-ную кислоту из моногидратных абсорберов 17 и 20. Для поддержания постоянной температуры на стадии осушки циркулирующую кислоту охлаждают в холодильнике воздушного охлаждения 22. Перед сушильной башней обжиговый газ разбавляют воздухом для снижения в нем концентрации SO2 до 9 % и увеличения избытка кислорода в соответствии с оптимальными условиями окисления диоксида серы.
После сушильной башни обжиговый газ проходит через фильтр-брызгоуловитель 11 и поступает в турбогазодувку 12. В теплообменниках 13 газ нагревается за счет теплоты продуктов реакции до температуры зажигания катализатора (420…440°С) и поступает на первый слой контактного аппарата, где происходит окисление 74 % SO2 с одновременным повышением температуры до 600°С. После охлаждения до 465°С газ поступает на второй слой контактного аппарата, где степень превращения достигает 86%, а температура газа возрастает до 514ºС. После охлаждения до температуры 450ºС газ поступает на третий слой контактного аппарата, где степень превращения SO2 увеличивается до 94…94,5 %, а температура повышается до 470°С.
Затем реакционный газ охлаждают в теплообменниках 13 до 100°С и направляют на абсорбцию первой ступени: сначала в олеумный абсорбер 21, затем в моногидратный абсорбер 20. После моногидратного абсорбера и фильтра-брызгоуловителя газ вновь нагревают до температуры 430°С и подают на четвертый слой катализатора. Концентрация SO2 в газе составляет теперь 0,75…0,85 %. В четвертом слое происходит окисление остаточного SO2 с конверсией ? 80 %, сопровождающееся повышением температуры до 449°С. Реакционную смесь вновь охлаждают до температуры 409°С и направляют на последний (пятый) слой контактного аппарата. Общая степень превращения после пяти стадий контактирования составляет 99,9%.
Газовую смесь после охлаждения направляют в моногидратный абсорбер второй ступени абсорбции 17. Непоглощенный газ, состоящий в основном из воздуха, пропускают через фильтр 11 для выделения брызг и тумана и выбрасывают в атмосферу через выхлопную трубу.
Производительность установки составляет до 1500 т/сут по моногидрату.
Расход на 1 т моногидрата: колчедана 0,82 т, воды 50 м3, электроэнергии 82 кВт -ч.
2.2 Выбор и обоснование конструкции главного аппарата
Для обжига колчедана существуют печи различных конструкций: механические полочные (многоподовые), вращающиеся цилиндрические, печи пылевидного обжига, печи для обжига в кипящем слое.
В механических полочных печах обжиг колчедана ведут на нескольких полках (сводах, подах), расположенных этажами друг над другом. Перемешивание и перемещение колчедана с пода на под производится механически.
Вращающиеся цилиндрические печи представляют собой вращающийся барабан, установленный наклонно. Колчедан подают с верхнего конца, огарок выгружают через нижний конец печи.
Печи пылевидного обжига получили свое название в связи с тем, что колчедан в них сжигается в виде тонко измельченной взвеси (пыли), подаваемой через форсунки в шахту печи, представляющую собой вертикальный полый цилиндр.
Печи для обжига колчедана в кипящем, или, как принято говорить, во взвешенном слое, характеризуются тем, что колчедан в печи находится во взвешенном состоянии, напоминающем кипение. Это достигается продуванием через слой с большой скоростью воздуха.
Производительность печей выражают в количестве условного колчедана, содержащего 45% серы, сжигаемого в печи в 1 сутки. Для определения производительности печей введено понятие интенсивность.
Интенсивность работы печи характеризуется количеством колчедана, сжигаемого в сутки на 1 м2 поверхности рабочих подов печи, в 1 м3 объема печи или на 1 м2 сечения шахты печи, т. е. для каждого типа печи принято свое выражение (размерность) интенсивности (напряженности) работы печи.
В качестве реакторов для обжига колчедана могут применяться печи различной конструкции: механические, пылевидного обжига, кипящего слоя (КС).
Кипящий слой называют также взвешенным, псевдоожиженным слоем. Внешне такой слои находится как бы в состоянии кипения. Это достигается тем, что через слой измельченного сырья (например, колчедана), находящегося на решетке с отверстиями, подают воздух с такой скоростью, что колчедан не проваливается через решетку и не лежит на ней, а находится в состоянии беспорядочного движения. Это наглядно показано на рис.3. При кипении объем слоя увеличивается: первоначальная высота его (в покое) Н0 меньше, чем высота Н, соответствующая состоянию кипения.
Рис. 3 — Схема идеального кипящего слоя: а — неподвижный слой, б — кипящий слой; 1 — аппарат постоянного поперечного сечения, 2 — распределительная решетка, 3 — твердые частицы
В настоящее время новые сернокислотные системы оборудуются преимущественно печами КС. Механические печи на действующих заводах постепенно заменяются печами этого типа.
Существенными достоинствами метода обжига колчедана в печах КС являются:
а) возможность получения концентрированного сернистого газа (12 15% SO2) с низким содержанием серного ангидрида и мышьяка в обжиговом газе,
б) высокая интенсивность печей. Так, интенсивность печей КС [в кг/(м2сут)] в 80 раз выше интенсивности механических печей и в 4 раза — печей пылевидного обжига.
Печи с взвешенным (кипящим) слоем представляют собой цилиндрическую футерованную камеру с решеткой, на которую непрерывно поступает колчедан. Под решетку подается воздух со скоростью, обеспечивающей переход частиц во взвешенное состояние, но не достаточной для их уноса из печи. Частицы колчедана находятся в непрерывном движении, напоминающем кипение жидкости. Время пребывания частиц колчедана в печи составляет несколько секунд. Постоянный приток воздуха обеспечивает почти полное выгорание серы из колчедана. Взвешенный слой имеет высоту, определяемую расположением патрубка для вывода огарка. Частицы огарка свободно вылетают через патрубок благодаря высокой подвижности взвешенного слоя (рис.3).
Печи КС отличаются высокой интенсивностью (до 10000 кг/м2?сут), обеспечивают более полное выгорание дисульфида железа и контроль температуры, облегчают процесс утилизации теплоты реакции обжига. К недостаткам печей КС следует отнести повышенное содержание пыли в газе обжига, что затрудняет его очистку. В настоящее время печи КС полностью вытеснили печи других типов в производстве серной кислоты из колчедана.
Рис. 4 — Печь для обжига колчедана в кипящем слое
3. Расчетная часть
.1 Материальный баланс
ВариантПроизводительность печи, т/ч (G h3SO4)Степень использования серы (?)Расход сухого колчедана, т (?)Содержание %Содержание в воздухе, %Относительная влажность воздуха, % (?)Серы в колчедане (Cs)Влаги в колчедане (Cвл)Серы в огарке (Cs(ог))SO2 в сухом обжиговом газе (C SO2)SO3 в сухом обжиговом газе(C SO3)O2 (n)N2(CN2)221,160,9100,793671,2130,1207951Расчет:
) Общее содержание серы в колчедане:
G= = = 7600 кг/ч.
) Количество сухого колчедана:
=== 21113,25 кг/ч.
) Количество влаги в колчедане:
== = 1589,17 кг/ч.
) Количество огарка:
== = 16468,335 кг/ч.
) Количество серы в огарке:
=197,62 кг/ч.
) Потери серы с огарком:
= 2,59%
7) Количество выгоревшей серы:
— G S(ог) =7600,77-197,62=7403,15 кг/ч.
) Общий объем SO2+SO3:
V== 5172,51м 3 /ч
) Образовалось SO2:
=== 5133,025 м3/ч
) Образовалось SO3:
=V-V=5172,51 — 5133,025=39,485 м3/ч.
) Концентрация кислорода в обжиговом газе:
С=n-[m-] C-[ m+0,5 ] C,
где n — содержание кислорода в воздухе, n=22%;- стехиометрическое отношение числа молекул кислорода к числу молекул диоксида серы, по уравнению 4FeS2+11O2=8SO2+2Fe2O3; m=11:8=1,375;
C=20-[1,375-]13-[1,375+0,50,1 = 2,95%.
12) Объем сухого обжигового газа:
VГ= = 39484,81 м3/ч.
) Объем кислорода в обжиговом газе:
=== 1166 м3/ч.
) Объем азота в обжиговом газе:
=V-(V+V+V) = 39484,81- (2133,025+39,485+1166) = 33146 м3/ч.
) Объем сухого воздуха, поступающего на обжиг колчедана:
В=== 41957 м3/ч.
) Количество паров в воздухе
Н2О=== 494,58м3/ч.
17) Общее количество паров воды в обжиговом газе:
VН 2О = = 2472,2 м3/ч.
Материальный баланс печи КС
ПриходКоличествоРасходКоличествоКгм3Кгм3Колчедан21113-огарок16468-влага колчедана1589-сухой воздух5412441957SO215039513SO37639O216671166N24143233146h3O14832472Всего7682641957Всего7616641956
3.2 Тепловой баланс
Исходные данные:
ВариантТеплоемкостьТеплопотери, %Теплота обжига колчедана , ккалТемпература,0СКкал/кг градКкал/м3градКолчеданавоздухаОгаркаобжигового газаколчеданаОгаркаВоздухаSO2SO3O2N220,140,370,310,3420,3420,340,3423112850002216550670
Расчет:
Приход теплоты:
) Теплота вносимая сухим колчеданом:
= 0,14·22·21113·1000/21113=3080 ккал
) Теплота поступающая с сухим воздухом:
= 53133·0,31·16·1000/21113= 9850 ккал
) Теплота поступающая с влагой колчедана:
= 1589·22·1·1000/21113=1655,8 ккал
) Теплота поступающая с влагой воздуха:
= 494,67·0,36·16·1000/21113=135 ккал
) Теплота обжига Q5по условию задачи 1285000 ккал
Общий приход теплоты:
+9850+135+1285000=1299720,8 ккал
Расход теплоты:
) Теплота, уносимая с огарком при 550 С:
= 16468·0,37·550·1000/21113=158728,7 ккал
2) Теплота, уносимая с обжиговым газом:
= (5133 · 0,342 + 39· 0,342 + 1166· 0,34 + 33146·0,342) ·670=428446,8 ккал
) Теплопотери печи по условию 31% от прихода теплоты:
= 1302353 · 31/100= 403729,43 ккал
) Расход теплоты:
= Q6+ Q7+ Q8= 158728,7+428446,8+403729,43= 990904,93 ккал
) Количество теплоты, которое нужно отвести из печи с воздухом:
=1299720,8-990904,93 = 308815,87 ккал
Тепловой баланс обжига 1 т влажного колчедана
ПриходРасходСтатья приходаКоличество,Статья расходаКоличество,КкалКкалС сухим колчеданом3080С огарком158729С сухим воздухом9850С обжиговым газом428447С влагой колчедана1655,8Теплопотери403729С влагой воздуха135С охлаждающим воздухом308816От обжига колчедана1285000Всего1299720Всего1299720
4. Охрана окружающей среды, связанная с производством серной кислоты
Научно-техническая революция и связанный с ней интенсивный рост химического производства, вызывает существенные негативные изменения в окружающей среде. Например отравление пресных вод, загрязнение земной атмосферы, истребление животных и птиц. В результате мир оказался в тисках экологического кризиса. Вредные выбросы сернокислых заводов следует оценивать не только по действию содержащегося в них оксида серы на расположенные вблизи предприятия зоны, но и учитывать другие факторы — увеличение количества случаев респираторных заболеваний человека и животных, гибель растительности и подавление ее роста, разрушение конструкций из известняка и мрамора, повышение коррозионного износа металлов. По вине кислых дождей повреждены памятники архитектуры (Тадж-Макал).
В зоне до 300 км от источника загрязнения (SO2) опасность представляет серная кислота, в зоне до 600 км. — сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо экологического ущерба налицо экономический ущерб — громадные суммы каждый год теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее распространенных газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее перспективны методы, основанные на поглощение оксида серы известняком, раствором сульфита — гидросульфита аммония и щелочным раствором алюмината натрия. Интерес также представляют каталитические методы окисления оксида серы в присутствии оксида ванадия.
Особое значение имеет очистка газов от фторсодержащих примесей, которые даже в незначительной концентрации вредно влияют на растительность. Если в газах содержится фтороводород и фтор, то их пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору гидроксида натрия. В течении одной минуты протекают следующие реакции:
F2+2NaOH-> O2+h3O+2NaF+NaOH->NaF+h3O;
Образующийся фторид натрия обрабатывают для регенерации гидроксида натрия:
NaF+CaO+h3O->CaF2+2NaOH
Заключение
В курсовой работе рассмотрены теоретические аспекты производства серной кислоты из серного колчедана, произведен расчет материального и теплового баланса. Описаны технологические схемы и процессы протекающие на каждой стадии.
Список использованной литературы
1. Основы химической технологии: Учеб. для студентов 0-75 хим.-технол. спец. вузов/И.П. Мухленова, А.Е. Горштейн.- М.: высш. шк., 1991.- 463с.
. Общая химическая технология: Методические указания к выполнению курсовой работы./ Е. И. Чебунина. — Улан-Удэ г.; 2006.-27с.
. Основы химической технологии: Учеб. для студентов 0-75 хим.-технол. спец. вузов/И.П. Мухленова, А.Е. Горштейн.- М.: высш. шк., 1991.- 463стр.
4. <http://www.xumuk.ru/>
. <http://alhimikov.net/elektronbuch/kislota.html>.
diplomba.ru
Получение серной кислоты и области ее применения.
Сегодня получение серной кислоты производится в основном двумя промышленными способами: контактным и нитрозным. Контактный способ более прогрессивен и в России он применяется более широко, чем нитрозный, то есть башенный.
Получение серной кислоты начинается с обжига сернистого сырья, например, железного колчедана. В специальных колчеданных печах получается так называемый обжиговый газ, в котором содержится около 9 % сернистого ангидрида. Эта стадия одинакова как для контактного, так и для нитрозного способа.

Далее необходимо окислить полученный сернистый ангидрид в серный. Однако предварительно его нужно очистить от ряда примесей, которые мешают дальнейшему процессу. Обжиговый газ очищают от пыли в электрофильтрах или в циклон-аппаратах, а затем подают его в устройство, содержащее твердые контактные массы, где диоксид серы SO2 окисляется в серный ангидрид SO3.
Эта экзотермическая реакция обратима — повышение температуры приводит к разложению образовавшегося серного ангидрида. С другой стороны, при понижении температуры скорость прямой реакции очень мала. Поэтому температуру в контактном аппарате поддерживают в пределах 480оС, регулируя ее скоростью прохождения газовой смеси.
В дальнейшем при контактном способе образуется серная кислота при соединении серного ангидрида с водой.
Нитрозный способ характеризуется тем, что сернистый газ окисляется оксидами азота. Получение серной кислоты по этому методу запускается образованием сернистой кислоты при взаимодействии диоксида серы из обжигового газа с водой. В дальнейшем полученная сернистая кислота окисляется азотной кислотой, что приводит к образованию монооксида азота и серной кислоты.

Эта реакционная смесь подается в специальную башню. При этом, регулируя поток газа, добиваются, чтобы в газовой смеси, попадающей в поглотительную башню, диоксид и монооксид азота содержался в соотношении 1:1, что необходимо для получения азотистого ангидрида.
Наконец, при взаимодействии серной кислоты и азотистого ангидрида образуется NOHSO4 — нитрозилсерная кислота.
Образовавшаяся нитрозилсерная кислота подается в продукционную башню, где она, разлагаясь водой, выделяет азотистый ангидрид:
2NOHSO4+ Н2O = N2O3 + 2Н2SO4,
который и окисляет сернистую кислоту, образовавшуюся в башне.
Окись азота, выделившаяся в результате реакции, вновь возвращается в окислительную башню и вступает в новый цикл.
В настоящее время в России получение серной кислоты производится в основном контактным способом. Нитрозный метод используется редко.
Применение серной кислоты весьма широко и разнообразно.
Большая ее часть идет на производство химических волокон и минеральных удобрений, она необходима в производстве лекарственных веществ и красителей. С помощью серной кислоты получают этиловый и другие спирты, моющие средства и ядохимикаты.
Ее растворы применяются в текстильной, пищевой промышленности, в процессах нитрования и для производства взрывчатых веществ. Кислота серная аккумуляторная служит электролитом для заливки в свинцовые аккумуляторы, которые широко используются в транспорте.
fb.ru
Серная кислота – „едкая кровь” промышленности
Опубликовано: 28-03-2018
Промышленность уже давно потребляет огромные количества серной кислоты. Учитывая разнообразие областей применения, это вещество производят в массовом масштабе. Несмотря на все более жесткие экологические и правовые ограничения, производство серной кислоты не снижается. Постоянный спрос на это химическое соединение свидетельствует о том, насколько оно необходимо для мировой экономики. H2SO4 – это „едкая кровь” промышленности, пульсирующая в бесчисленных производственных установках по всему миру. С серной кислотой работают профессионалы, оперирующие в различных отраслях промышленности. Для многих исследований и экспериментов используют ее ученые, а с ее помощью знания получают в химических лабораториях студенты и ученики. Сегодня сложно себе представить функционирование современной экономики без серной кислоты. Свойства серной кислоты делают ее незаменимым сырьем и реактантом, которое трудно вытеснить даже самыми инновационными химическими соединениями, выпускаемыми на рынок производителями химических веществ.
Характеристика и свойства H2SO4
Серная кислота – это одна из наиболее сильно действующих минеральных кислот. Она представляет собой маслянистую, тяжелую и бесцветную жидкость с необыкновенно сильными гигроскопическими свойствами. В своей концентрированной форме обладает также сильными окислительными свойствами. Серная кислота очень хорошо растворяется в воде во всех соотношениях, выделяя большое количество тепла. Именно поэтому необходимо помнить о том, чтобы наливать кислоту в воду, а не наоборот. Возможно изготовление серной кислоты даже с концентрацией 99%, однако, потери оксида серы при температуре близкой к температуре кипения приводят к образованию азеотропа с водой концентрацией 98,3%. Из-за этого серную кислоту обычно хранят в виде 98%-ного раствора. Конечно, H2SO4 может иметь разные концентрации. Наиболее широко применяемыми водными растворами серной кислоты являются:
— 10% — т.н. сильно разведенная серная кислота, используемая, обычно, в качестве обезвоживающего средства, регулятора pH, лабораторного реактива,
— 29-32% — применяют в популярных свинцово-кислотных аккумуляторах,
— 62-70% — используют в качестве удобрения,
— 77-80% — применяют в процессе получения H2SO4 „камерным” методом и используют для производства глауберовой соли, т.е. сульфата натрия (Na2SO4),
— 98% — уже упомянутая ранее серная кислота.
Получение серной кислоты
В промышленности серную кислоту получают контактным способом путем окисления диоксида серы, который образуется, в основном, в результате процессов сжигания серы или сульфидов металлов (напр. пирита). Процесс производства серной кислоты при использовании серы можно разделить на три этапа. Первый из них заключается в производстве диоксида серы. Затем диоксид серы окисляют для получения триоксида серы. Последний этап заключается в превращении оксида серы (VI) в серную кислоту.
Сжигание серы проводят при избытке воздуха с целью полного завершения реакции под давлением на уровне около 0,5 МПа. Весь этот процесс осуществляется при температуре около 150oC в баках, выложенных толстым слоем огне- и кислотостойкого кирпича. Расплавленную серу фильтруют с целью удаления примесей (в основном это железо и органические соединения). Часто в процессе применяют также известь, чтобы уменьшить кислотность расплавленной серы, тем самым ограничивая ее коррозийные свойства. Расплавленную серу подают в горелки, где она сгорает. Смесь диоксида серы и воздуха, выходящую из горелки, затем пропускают через фильтр, который удаляет любые загрязнения.
На следующем этапе диоксид серы превращают в триоксид серы в результате реакции с кислородом в присутствии катализатора. Широко используемым катализатором является пятиокись ванадия (V2O5), а в качестве его носителя используют сульфат калия. Функцию подложки для катализатора, как правило, исполняет диоксид кремния или глинокремнеземы, которые характеризуются очень высокой пористостью, обеспечивая тем самым большую площадь для протекания реакции. Скорость протекания процесса зависит также от температуры. На практике ее поддерживают на уровне около 500oC, чтобы обеспечить достаточную скорость реакции при максимально высокой конверсии.
Последний этап производства серной кислоты заключается в абсорбции SO3 в концентрированной H2SO4 или олеуме с целью предотвращения образования трудно поддающегося конденсации т.н. тумана серной кислоты. Серная кислота с концентрацией 98% циркулирует с такой скоростью, что вновь поглощаемый SO3 вызывает очень незначительное повышение ее концентрации. Весь процесс осуществляется при температуре около 70oC, тем самым максимизируя эффективность поглощения SO3. Кроме того, в бак с кислотой добавляют также воду, разбавляющую кислоту до соответствующей концентрации. Поток серной кислоты постоянно сливают и охлаждают с помощью пластинчатых теплообменников перед подачей в резервуары для хранения. Общее преобразование серы в серную кислоту составляет примерно 99%.
Применение серной кислоты
Серная кислота имеет огромное значение во многих отраслях промышленности. Наибольший расход H2SO4 наблюдается в производстве минеральных удобрений. Это, в основном, связано с производством суперфосфатов, а также фосфата и сульфата аммония. Серная кислота имеет также большое значение при производстве других кислот, например, соляной, азотной и фосфорной кислот. Ее используют также в производстве взрывчатых веществ в качестве одного из видов сырья для производства тротила (TNT). В свою очередь, в нефтехимической промышленности H2SO4 применяют, в основном, для осушения масел, керосина и парафина. Она выполняет также роль катализатора в реакции получения изооктана, являющегося одним из основных компонентов бензина. Серную кислоту используют также в горнодобывающей и металлургической промышленностях в процессах обогащения руд меди. H2SO4является также электролитом в популярных свинцово-кислотных аккумуляторах. Кроме того, серная кислота находит широкое применение в производстве моющих средств (напр. лаурилсульфата натрия), а также в косметической промышленности, где ее используют для производства сырья и полуфабрикатов (напр. нитрата серебра), а также перекиси водорода или же душистых веществ.
Такое широкое применение серной кислоты приводит к тому, что в случае ее отсутствия невозможным или просто невыгодным было бы проведение многих основных и весьма важных промышленных процессов.
Серная кислота в Группе РСС
PCC Rokita имеет устойчивую позицию поставщика водной серной кислоты с концентрацией 77%. H2SO4 мы производим в Комплексе Хлора контактным способом, что гарантирует очень высокую чистоту и однородность получаемого продукта. Предложение на поставку серной кислоты Группы РСС адресовано, прежде всего, производителям фосфорных удобрений, бумаги и глауберовой соли, т.е. сульфата натрия (Na2SO4). Последний продукт может быть также использован в производстве древесной массы, стекла, красителей и моющих средств. Сульфат натрия применяют также в медицине в качестве слабительного средства.
Серная кислота – это незаменимое сырье во многих технологических процессах, а ее чрезвычайно разнообразный рынок стоит на пороге многих вызовов. Опасения, связанные с негативным воздействием на окружающую среду, могут сбалансировать или даже ослабить спрос на это популярное сырье. Однако, тот факт, что H2SO4, несмотря на присутствие в химической промышленности уже столько лет, не теряет свою популярность и по-прежнему является одним из самых необходимых химических веществ, используемых в промышленности в массовом масштабе.
www.products.pcc.eu
Производство серной кислоты.
Производство серной кислоты.
Среди минеральных кислот, производимых химической промышленностью, серная
кислота по объему производства и потребления занимает первое место. Объясняется
это двумя причинами: ее дешевизной по сравнению со всеми другими кислотами, и
ее свойствами. Серная кислота не дымит, в концентрированном виде не разрушает
черные металлы, в то же время является одной из сильных кислот, в широком
диапазоне температур
(– 40… – 20 260 – 336,5°С)
находится в жидком состоянии.
Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой с выделением большого количества теплоты. Плотность H2SO4 при 0°С равна 1,85 г/см3, а температура кристаллизации 10,7°С.
Крупнейшими потребителями серной кислоты являются производства минеральных удобрений: суперфосфата, сульфата аммония.
Многие кислоты (фосфорная, уксусная, соляная, концентрированная азотная и др.) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тканей), лаков и красок (для зданий и машин) лекарственных веществ и некоторых пластмасс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, ПАВ, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами.
Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется для получения крахмала, патоки и ряда других продуктов. В электротехнике она используется в качестве электролита в аккумуляторах. Серную кислоту используют для осушки газов и при концентрации кислот. Наконец, серную кислоту применяют как компонент реакционной среды в процессах нитрования, в частности, при получении взрывчатых веществ.
При нитровании, в производстве этилового спирта из этилена, при концентрировании азотной кислоты и в других процессах применяют серную кислоту концентрацией от 92 до 98%, а выводят из процесса разбавленную 50 – 80%-ную кислоту. Чтобы возвратить ее в новый цикл, полученные водные растворы упаривают.
Сырьевая база производства серной кислоты – серосодержащие соединения, из которых можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного (серного) колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии. Некоторые производства используют в качестве сырья сероводород, образующийся при очистке серы в нефтепереработке. Первый обжиг серосодержащего сырья для получения диоксида серы.
Производство серной кислоты включает в себя следующую последовательность стадий:
Обжиг серного колчедана или серы.
Окисление диоксида серы.
Абсорбция триоксида серы.
Исходные вещества – минеральное сырье – содержит примеси, поэтому выходящие со стадии обжига газы подвергаются очистке. Первая стадия – обжиг, специфичен для каждого вида сырья, и далее она будет рассматриваться для колчедана и серы как наиболее распространенных исходных веществ. Стадии окисления и абсорбции в основном одинаковы в разных способах получения серной кислоты. Поэтому эти стадии будут рассмотрены как типовые процессы.
Обжиг серосодержащего сырья.
Обжиг колчедана (пирита) является сложным физико-химическим процессом и включает в себя ряд последовательно или параллельно протекающих реакций:
|
Термическая диссоциация |
|
|
Газофазное горение серы |
|
|
Горение пирротина |
|
|
Или суммарно: |
При небольшом избытке или недостатке кислорода образуется смешанный оксид железа
Обоснование роли параметров и их выбор.
Температура. Термическое разложение пирита начинается уже при температурах около 200°С и одновременно воспламеняется сера. При температурах выше 680°С интенсивно протекают все три реакции.
В промышленности обжиг ведут при 850 – 900°С, когда общая скорость процесса лимитируется массопереносом окислителя (кислорода) к поверхности пирита и продуктов разложения в газовую фазу. В общем виде движущая сила этого процесса может быть выражена уравнением
(1)
Из этого уравнения видно, что факторами увеличения производительности процесса являются интенсификация массопереноса (), увеличение поверхности контакта фаз (F) и концентрации реагентов. Коэффициент массопереноса может быть увеличен повышением температуры, поверхность контакта фаз существенно возрастает с увеличением степени дисперсности твердого материала, а высокие концентрации реагентов обеспечиваются использованием обогащенного пирита и увеличением содержания кислорода в окислителе. Следует, однако, иметь в виду, что чрезмерное повышение температуры способствует размягчению и слипанию частиц твердого сырья, а применение концентрированных реагентов удорожает их стоимость и приводит к чрезмерному росту температуры в условиях автотермического режима. Это обусловливает выбор оптимальной температуры, сочетающей достаточную производительность процесса и использование сырья с соответствующим содержанием активных компонентов при минимуме процессов агломерации твердого материала. На практике процесс проводят при температуре 850 – 900°С.
Давление. В соответствии с уравнением (1) давление является фактором скорости процесса, однако его рост может привести в условиях автотермического режима к чрезмерному увеличению температуры и слипанию частиц твердого материала. Кроме того, увеличение давления приводит к увеличению расходов на компремирование. Поскольку реакция обжига в условиях указанных температур протекает достаточно гладко, то предпочитают работать при атмосферном давлении.
Соотношение воздух-колчедан поддерживается на уровне, обеспечивающем избыток кислорода по сравнению с его стехиометрическим количеством, с целью достижения высоких степеней обжига, однако этот избыток не должен быть чрезмерным, т.к. при значительных избытках рост степени извлечения серы из колчедана перекрывается значительным разбавлением газов обжига и понижением концентрации SO2 в них, что отрицательно влияет на последующий процесс окисления SO2 в SO3.
Ранее доминирующим типом реактора был многополочный реактор, снабженный скребками для выравнивания слоя на каждой полке и организации транспорта твердой фазы с верхних полок на нижние (см. типы реакторов для гетерогенных реакций с участием твердой фазы).
В таком реакторе степень дисперсности колчедана невелика, что существенно ограничивает производительность реактора. Кроме того, в таком реакторе движущиеся скребки в высокотемпературной зоне усложняют его конструкцию, создается неоднородный температурный режим по полкам, в нем трудно организовать отвод тепла из зоны реакции. Трудности теплосъема не позволяют получить обжиговый газ с концентрацией SO2 более 8 – 9%. Основное ограничение – невозможность использования мелких частиц, в то время как для гетерогенного процесса основной способ ускорения реакции – дробление частиц. По этой причине более перспективными являются аппараты к «кипящем слоем» твердых частиц. Их степень дисперсности позволяет на порядок ускорить процесс.
Пылевидный колчедан подается через питатель в реактор. Окислитель (воздух) подается снизу через распределительную решетку со скоростью, достаточной для взвешивания твердых частиц. Их витание в слое предотвращает слипание и способствует хорошему контакту с газом, выравнивает температурный режим по всему слою, обеспечивает подвижность твердого материала и его переток в выходной патрубок для вывода огарка из реактора. В слое подвижных частиц можно расположить теплообменные элементы. Благодаря увеличению глубины обжига содержание SO2 в обжиговом газе увеличивается до 13 – 15%. Основной недостаток печей кипящего слоя – повышенная запыленность обжигового газа из-за механической эрозии подвижных твердых частиц. Это требует более тщательной очистки газа от пыли в циклоне и электрофильтре.
Сжигание серы.
Сера – легкоплавкое вещество: температура ее плавления 113°С. Перед сжиганием ее расплавляют, используя пар, полученный при утилизации тепла ее сжигания. Расплавленная сера отстаивается и фильтруется для удаления имеющихся в природной сере примесей и насосом подается в печь сжигания. Сера горит в основном в парофазном состоянии. Чтобы обеспечить ее быстрое испарение, необходимо ее диспергировать в потоке воздух. Для этого используют форсуночные и циклонные печи. Первые оборудованы горизонтальными форсунками для тонкого распыления жидкости. В циклонной печи жидкая сера и воздух подаются тангенциально и за счет вихревого движения достигается диспергирование жидкости и перемешивание двух потоков. Мелкие капли быстро испаряются и сера в парообразном состоянии сгорает. Горение протекает адиабатически, и температура зависит от концентрации образующегося SO2.
За счет высокой теплоты сгорания серы температура в печи составляет более 1000°С. Этих условий достаточно для испарения жидкой серы. Печь сжигания работает в комплексе с вспомогательным оборудованием для плавления и фильтрования серы и котлом-утилизатором для использования тепла реакции.
Газы обжига колчедана содержат в виде примесей соединения фосфора, селена, теллура, мышьяка и некоторые другие, образующиеся из примесей сырья. Естественная влага сырья также переходит в газ. При горении образуются некоторое количество SO3 и возможно оксиды азота. Эти примеси приводят или к коррозии аппаратуры или к отравлению катализатора, а также ухудшают качество серной кислоты. Их удаляют в промывном отделении. Согласно схеме газ последовательно проходит две промывные башни, орошаемые растворами серной кислоты (60 и 20%-ой). В первой башне обжиговый газ охлаждается с 300 – 500°С до 60 – 70°С и освобождается от остатков пыли и части примесей. Эта башня полая. Обеспыленный газ отмывается 15 – 20%-ой серной кислотой от соединений As, Fe, Se во второй башне с насадкой. Окончательная осушка от влаги осуществляется в 3 – 9 башнях (сушильной), орошаемых концентрированной серной кислотой.
Окисление диоксида серы.
Реакция
является обратимой и экзотермической и протекает с уменьшением объема. Она осуществляется на катализаторах, основой которых является V2O5 с добавлением оксидов щелочных металлов, нанесенных на оксид кремния.
Обоснование роли параметров и их выбор.
Температура проходит максимум производительности, характерный для обратимых экзотермических реакций. Следует иметь в виду, что чрезмерное увеличение температуры может привести к диффузионному торможению процесса и это может повлиять на положение экстремума производительности и его величину.
В значительной степени выбор температуры определяется верхним и нижним пределом этого параметра. При Т<400 0C активность катализаторов весьма мала, а выше 600 0С происходит их термическая дезактивация. Оптимальными являются температуры, лежащие внутри этих пределов.
Давление является фактором скорости процесса и фактором смещения равновесия, однако на практике исходя из соображений экономии энергозатрат, а также благодаря возможности достичь высокой производите и степени превращения за счет использования других факторов предпочитают работать при давлениях, близких к атмосферному. Некоторое избыточное давление необходимо для преодоления гидравлических сопротивлений установки при организации транспортных потоков реагентов.
Соотношение O2:SO2. является фактором смещения равновесия, а также фактором скорости процесса в соответствии с уравнением Борескова
(2)
Однако сверху это соотношение ограничивается замедлением роста скорости при высоких и значительным снижением содержания SO2 в контактных газах, поступающих на абсорбцию, что снижает эффективность последней. На практике используют избыток О2 более чем полтора по отношению к стехиометрическому.
Время контакта выбирается, исходя из максимально достижимой конверсии. Пределом такой конверсии является максимальная степень превращения, при которой скорость процесса близка к нулю. Поэтому за время реакции выбирается то минимальное время, при котором степень конверсии практически близка равновесной. Обычно эта величина равна 90-95 %, а соответствующее ей время – несколько секунд.
Технология контактного окисления SO2.
Чаще всего в промышленности используют полочные аппараты со съемом тепла реакции между полками. Схема теплообменника предполагает максимальное использование тепла реакции для подогрева исходного газа. При этом съем тепла между полками осуществляют в той мере, которая позволяет приближать рабочую температуру к оптимальному значению этого параметра.
Одна из важнейших задач производства серной кислоты состоит в увеличении степени превращения диоксида серы и снижения его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи – метод двойного контактирования и двойной абсорбции (ДКДА). Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2 составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3; в оставшемся реакционном газе соотношение O2 : SO2 существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ опять подают в контактный аппарат, где на достигается 95% степень превращения оставшегося SO2. Суммарная степень превращения SO2 в таком процессе достигает 99,5 – 99,8%.
Абсорбция триоксида серы.
Абсорбция триоксида серы – последняя стадия процесса на которой образуется серная кислота. Взаимодействие SO3 с водой
протекает достаточно интенсивно как в жидкой, так и в газовой фазе. Кроме того H2SO4 может растворять в себе SO3, образуя олеум. Этот продукт удобен для транспортировки, поскольку он не вызывает коррозии даже обычных сталей. В то же время растворы серной кислоты чрезвычайно агрессивны.
Равновесие «газ-жидкость» для «H2O-H2SO4-SO3» представлено на рисунке 1. Особенностью этой системы является то, что в широком интервале концентраций раствора серной кислоты в паровой фазе присутствуют чистые пары воды, а над олеумом – в газовой фазе преобладает SO3. Одинаковый состав жидкой и паровой фаз (азеотропная точка) будет при концентрации серной кислоты 98,3%. Если SO3 поглощать раствором с меньшей концентрацией, то реакция (3) будет протекать и в паровой фазе – будет образовываться туман серной кислоты, который уйдет из абсорбера с газовой фазой. А это – и потери продукта, и коррозия аппаратуры, и выбросы в атмосферу. Если SO3 абсорбировать олеумом, то поглощение будет неполным.
Из этих двух свойств следует двухстадийная схема абсорбции (рисунок 2). Газ, содержащий SO3 после реактора проходит последовательно олеумый (1) и моногидратный (2) абсорберы. Другой компонент реакции (H2O) подается противотоком через сборник в моногидратный абсорбер. За счет интенсивной циркуляции жидкости (абсорбата) в ней можно поддерживать близкую к оптимальной концентрацию H2SO4 – 98,3% (увеличение концентрации за проход жидкости не более 1 – 1,5%). Концентрационные условия абсорбции обеспечиваю полное поглощение SO3 и минимальное образование сернокислого тумана. Кислота из моногидратного абсорбера поступает в олеумный. В нем циркулирует 20% раствор Н2SO4, который частично отбирается как конечный продукт – олеум. Кислота из предыдущего абсорбера – моногидрат – также может быть продуктом. В системе циркуляции предусмотрены холодильники для съема тепла реакции и обеспечения более эффективной абсорбции. При температурах меньше 100°С SO3 поглощается практически полностью, диоксид серы – практически не поглощается.
Перспективы развития сернокислотных производств.
Мощным средством повышения производительности сернокислотных производств является увеличение концентрации диоксида серы. Высококонцентрированные газы, содержащие до 80% SO2 уже начали получать в производствах цветных металлов из их сульфидных руд с применением технического кислорода.
Получение высококонцентрированного сернистого газа позволяет создать энерготехнологические циклические производства серной кислоты из серы и колчедана. Диоксид серы полученный с применением технического кислорода окисляют на 90% в контактном аппарате с «кипящем слоем» катализатора. При абсорбции SO3 получают высококонцентрированный олеум и моногидрат. Газ после абсорбции возвращают на контактирование. В реакторе общая степень превращения составляет 99,995%. Для отвода накапливающегося в результате многократного рецикла азота часть газа после абсорбции пропускают через малогабаритную сернокислотную установку, из которой азот выбрасывается в атмосферу. Интенсивность работы циклической системы, работающей под давлением около 1 МПа, с применением кислорода в десятки раз превышает интенсивность обычных систем. Потери серы с отходящими газами и соответственно выбросы SO2 и SO3 в окружающую среду также снижены в десятки раз.
Схемы предусматривают генерирование водяного пара (4 МПа) за счет тепла газов обжига, который может быть использован как в самой установке для компенсации затрат энергии на работу компрессоров и насосов, так и в других цехах завода. Тепло сернистых газов после прохождения очередного каталитического слоя можно использовать для предварительного подогрева реагентов на входе в контактный аппарат. Тепло сорбции используется для бытовых нужд.
Важнейшими направлениями развития производства серной кислоты являются:
1. Увеличение мощности аппаратуры при одновременной комплексной автоматизации производства.
2. Интенсификация процессов путем применения реакторов «кипящего слоя» (как на стадии обжига, так и при контактном окислении SO2), более активных катализаторов, повышенных давлений и использование технического кислорода в процессе окисления.
3. Разработка энерготехнологических схем с максимальным использованием теплоты экзотермических реакций, в том числе циклических систем под давлением.
4. Увеличение степеней превращения на всех стадиях производства для снижения расходных коэффициентов по сырью и материалам и снижение вредных выбросов.
5.
Утилизация вредных выбросов из отходящих газов, а также
твердых отходов (огарок). Например, нежелательные вредные примеси H2S
и SO2 из разных потоков можно объединить и подвергнуть
концентрированию с целью перевода их в элементарную серу.
Твердый огарок, содержащий оксид железа можно использовать в качестве сорбента
для улавливания газов и очистки сточных вод.
trotted.narod.ru
4. Краткое описание промышленных способов получения серной кислоты. Производство серной кислоты
Похожие главы из других работ:
Автоматизация отделения получения серной кислоты по методу мокрого катализа
1 КОНСТРУКТИВНО-ТЕХНОЛОГИЧЕКАЯ ХАРАКТЕРИСТИКА ПРОЦЕССА ПОЛУЧЕНИЯ СЕРНОЙ КИСЛОТЫ
Процесс получения серной кислоты из сероводорода коксового газа по методу мокрого катализа осуществлен в отечественной и зарубежной промышленности на ряде установок различной производительности — от одной до ста тонн моногидрата в сутки…
Исследование кинетики реакции алкилирования изобутана изобутиленом до изооктана методом математического моделирования
2.3 Технологическая схема и краткое описание процесса производства
Данный процесс осуществляется статическим способом. Он проходит в замкнутых закрытых реакторах при постоянном объеме. При проведении реакции в таких условиях теми параметрами, которые влияют на ход реакции, являются температура…
Получение сернистого ангидрида в производстве серной кислоты
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
Функциональная схема производства серной кислоты. Химическая схема включает в себя реакции: обжиг серного колчедана 4FeS2 + 11О2 = 2Fe2O3 + 8SO2 или серы S2 + 2O2 = 2SO2; окисление диоксида серы SO2 + 1/2O2 = SO3; абсорбция триоксида серы SO3 + Н2O = h3SO4…
Производство полиэтилена методом низкого давления
2. Краткое описание технологии производства и размещения оборудования
полимеризация этилен пожарный циклогексан Полиэтилен и полипропилен получают путем полимеризации соответственно этилена и пропилена методом низкого давления с использованием в качестве катализатора слабого раствора триэтилаллюминия в…
Производство серной кислоты
3. Сырьевые источники получения серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV). Природные залежи самородной серы невелики, хотя кларк ее равен 0…
Производство серной кислоты
10. Конденсация серной кислоты
Конденсация парой серной кислоты. В некоторых случаях, газ, используемый для получения серной кислоты, не содержит вредных примесей (мышьяка, фтора). Тогда экономически целесообразно не подвергать такой газ промывке в специальной аппаратуре…
Производство серной кислоты
1. Производство серной кислоты
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава [3]: При >>1 — это моногидрат серной кислоты (100%-ная кислота), при < — водные растворы моногидрата…
Производство серной кислоты
2. Технологическая схема получения серной кислоты контактным методом на колчедане
На рисунке 6 изображена технологическая схема получения серной кислоты контактным методом на колчедане. Рисунок 6 -Технологическая схема получения серной кислоты контактным методом на колчедане [1] 19 1,2-промывные башни; 3…
Производство серной кислоты
1.2 Способы получения серной кислоты
Еще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом…
Производство серной кислоты при повышенном давлении
1.1 Производство серной кислоты
Сырьевая база производства серной кислоты — это серосодержащие соединения, из которых с помощью обжига можно получить диоксид серы. В промышленности около 80% серной кислоты получают из природной серы и железного колчедана…
Разработка процесса производства изопропилбензола на ОАО «Омский каучук»
1.2. Характеристика промышленных способов алкилирования бензола пропиленом
Известны три основных способа получения изопропилбензола, имеющие промышленное значение: 1. Алкилирование бензола пропиленом в присутствия безводного хлористого алюминия (алкилирование по Фриделю — Крафтсу). 2…
Разработка технологии получения серной кислоты обжигом серного колчедана
1.5 Получение серной кислоты
…
Разработка технологии получения серной кислоты обжигом серного колчедана
1.5.2 Этапы получения серной кислоты
Все промышленные методы синтеза серной кислоты основаны на следующих этапах: 1) первой стадией процесса является окисление сырья с получением обжигового газа, содержащего оксид серы SO2…
Разработка технологии получения серной кислоты обжигом серного колчедана
1.5.3 Методы получения серной кислоты
В промышленности применяют два метода получения серной кислоты, отличающихся способом окисления SO2: -нитрозный — с применением оксидов азота, получаемых из азотной кислоты, -контактный — с использованием твердых катализаторов (контактов)…
Сернокислотное алкилиривание изобутана бутиленом
4. Влияние серной кислоты
Концентрация кислоты. Для С-алкилирования бутан-бутиленовых углеводородов обычно используют серную кислоту, содержащую от 88 до 98 % моногидрата…
him.bobrodobro.ru
Получение серной кислоты
Контактный метод получения серной кислоты.
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы.
Получение h3SO4 из колчедана.
Первой стадией процесса является окисление сырья с получением обжигового газа, содержащего диоксид серы. В зависимости от вида сырья протекают экзотермические химические реакции обжига:
4FeS2 +11O2 = 2Fe2O3 + 8SO2 (I)
S + O2 à SO2 (II)
При протекании реакции (I) помимо газообразного продукта реакции SO2 образуется твердый продукт Fe2O3, который может присутствовать в газовой фазе в виде пыли. Колчедан содержит различные примеси, в частности соединения мышьяка и фтора, которые в процессе обжига переходят в газовую фазу. Присутствие этих соединений на стадии контактного окисления диоксида серы может вызвать отравление катализатора. Поэтому реакционный газ после стадии обжига колчедана должен быть предварительно направлен на стадию подготовки к контактному окислению (вторая стадия), которая помимо очистки от каталитических ядов включает выделение паров воды (осушку), а также получение побочных продуктов (Se и Te).
Если обжиговый газ получают сжиганием серы, то отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию теплоты.
На третей стадии протекает обратимая экзотермическая химическая реакция контактного окисления диоксида серы:
SO2 + 1/2O2 ↔ SO3 (III)
Последняя стадия процесса – абсорбция триоксида серы концентрированной серной кислотой или олеумом.
Важнейшей задачей в производстве серной кислоты является повышение степени превращения SO2 в SO3. Помимо увеличения производительности по серной кислоте выполнение этой задачи позволяет решить и экологические проблемы – снизить выбросы в окружающую среду вредного компонента SO2.
Повышение степени превращения SO2 может быть достигнуто разными путями. Наиболее распространенный из них – создание схем двойного контактирования и двойной абсорбции (ДКДА).
Получение h3SO4 из серы.
Процесс производства серной кислоты из элементарной серы состоит из следующих основных реакций:
подготовка сырья: очистка и плавление серы; очистка, сушка и дозировка воздуха;
сжигание серы: S + O2 = SO2 (1). Процесс ведут с избытком воздуха;
контактное окисление SO2 в SO3: SO2 + 0,5O2 = SO3 (2). Процесс идет на ванадиевом катализаторе при температуре 420-550˚C;
Абсорбция SO3: SO3 + h3O = h3SO4 (3). Абсорбционная колонна орошается 98,3% h3SO4. Перед отправкой на склад кислота разбавляется до ~ 93% h3SO4 в соответствии с требованиями ГОСТ’а.
Получение обжигового газа из серы.
При сжигании серы протекает необратимая экзотермическая реакция (II) с выделением очень большого количества теплоты: ∆H = -362,4 кДж/моль, или в пересчете на единицу массы
362,4/32 = 11,325 кДж/т = 11325 кДж/кгS.
Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6˚C; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция).
Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей – форсуночные и циклонные. В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата.
Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Если воздух берут в стехиометрическом количестве, т. е. на каждый моль серы 1 моль кислорода, то при полном сгорание серы концентрация будет равна объемной доле кислорода в воздухе Cso2 max =21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит ~ 1500ºC. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 1300ºC быстро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14 %SО2.
При подготовке данной работы были использованы материалы с сайта http://www.studentu.ru
coolreferat.com
