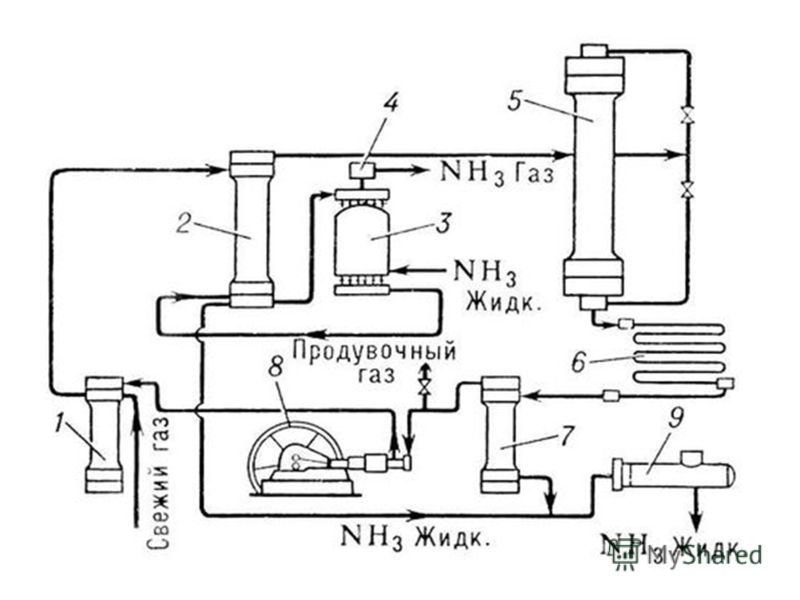
Получение аммиака в промышленности: Получение аммиака в промышленности и в лаборатории из азота
Химики оптимизировали синтез аммиака – одно из самых многотоннажных химических производств
Азот необходим всем живым организмам, поскольку входит в состав многих белков и аминокислот. И хотя атмосфера Земли почти на 80 % состоит из молекулярного азота N2, в такой форме он практически не усваивается организмами. Поэтому человечество производит так много удобрений, которые содержат азот уже в связанной форме, то есть в виде разных химических соединений азота с другими атомами, из которых организмам уже гораздо проще вытащить азот под свои нужды. А большинство азотных удобрений, в свою очередь, получают из аммиака (Nh4), который к тому же используют для синтеза различных охлаждающих агентов (рефрежирантов), пластиков, полимеров, взрывчатых веществ и даже в микроэлектронике. В сумме под эти нужды в мире каждый год производят почти 200 миллионов тонн аммиака – примерно 25 килограммов на каждого жителя планеты, и это самое крупнотоннажное химическое производство.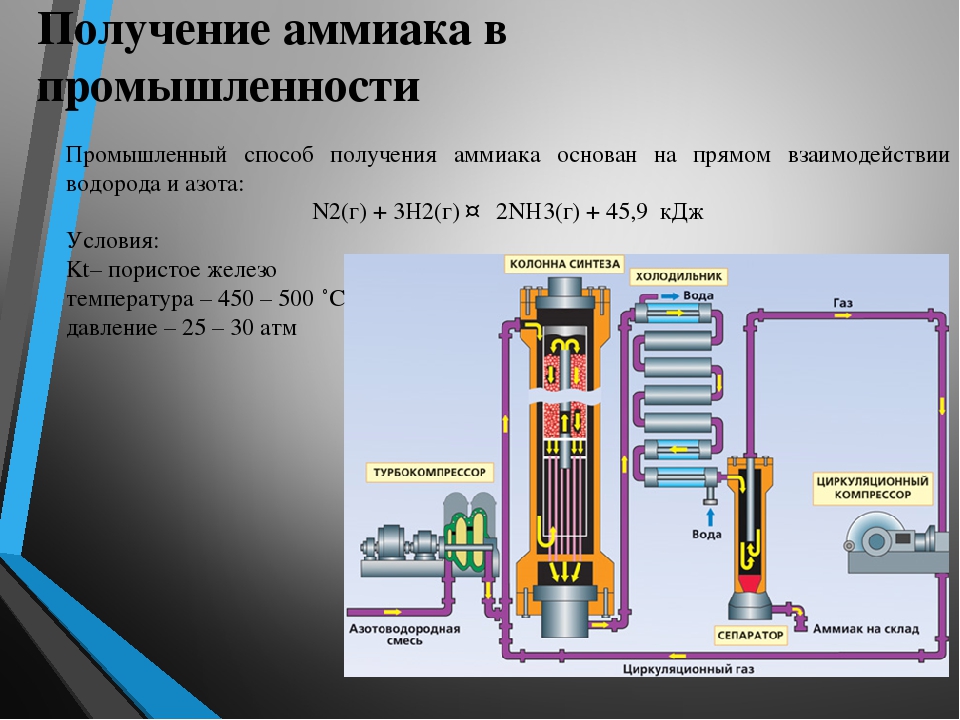
Почти весь аммиак получают в процессе Габера-Боша, предложенном еще в начале XX века и уже через несколько лет принесшему одному из своих разработчиков (Фрицу Габеру) нобелевскую премию по химии. В нем водород (h3) и азот (N2) пропускают при высоком давлении через катализатор, и на выходе получается газообразная смесь исходных реагентов и аммиака, из которой потом нужно выделить чистый Nh4. Сейчас для этого смесь охлаждают с применением большого количества хладагентов, и из-за этого процесс очистки потребляет очень много энергии – более 3 МВт-ч на каждую тонну аммиака, это средний расход электричества в квартире примерно за два года. Поэтому хотя синтез аммиака и отработан вековым опытом и гигантским масштабированием, ученые постоянно ищут новые более экономичные способы разделения продуктов процесса Габера-Боша.
Так, исследователи из РХТУ им. Д.И. Менделеева, а также нижегородских вузов НГТУ им. Р.Е. Алексеева и ННГУ им. Н.И. Лобачевского уже предлагали использовать для этого гибридный способ очистки газов, в котором сочетаются технические возможности мембран и абсорбентов.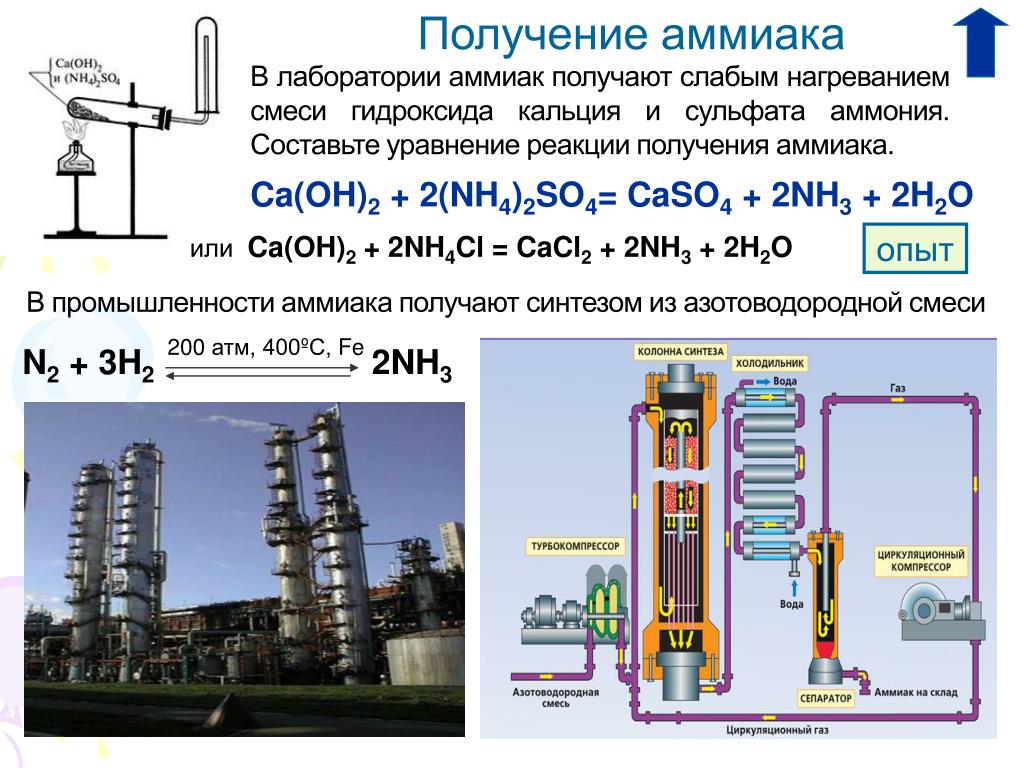 Теперь у них опубликована новая работа, в которой с применением новых абсорбентов исследователи получили аммиак с чистотой, сопоставимой с промышленной.
Теперь у них опубликована новая работа, в которой с применением новых абсорбентов исследователи получили аммиак с чистотой, сопоставимой с промышленной.
«Однажды я выступал с пленарным докладом на научной конференции в Португалии, а после ко мне подошел очень известный ученый в области мембран, профессор Эдвард Касслер (Edward Cussler), он взял меня за руки и показал, сложив ладоши, принцип действия мембраны, а потом рассказал, что заниматься в науке о мембранах нужно только тремя направлениями. Одним из них был аммиак», – рассказывает один из авторов работы, заведующий лабораторией “SMART Полимерных материалов и технологий” РХТУ им. Д.И. Менделеева, профессор Илья Воротынцев – «Мы уже применяли наш гибридный процесс для синтеза хлористого водорода, организовывали по заданию нобелевского лауреата Жореса Ивановича Алферова производство высокочистого аммиака для микроэлектроники (для производства светодиодов), а теперь наши интересы сместились в область более массового производства – в том числе получения аммиака».
Зеленые растворители в качестве абсорбентов
Гибридная технология очистки газов разработана российскими учеными и протекает в аппарате их собственной конструкции. Он разделен мембраной на две части – в верхнюю поступает смесь газов, в данном случае это Nh4, N2, h3, которая пропускается через абсорбент, нанесенный на мембрану. Он накапливает большие количества аммиака и, наоборот, почти не абсорбирует азот и водород, которые выходят обратно из абсорбента в ту же самую полость над мембраной. Молекулы же Nh4 выводятся из абсорбента через мембрану в другую часть аппарата: между полостями над и под мембраной создают большой перепад давления, под действием которого аммиак диффундирует через мембрану в нижнюю часть аппарата, из которой уже отводят поток очищенного газа.
В качестве абсорбента ученые использовали четыре разных вещества, которые, по предварительным данным, выглядели перспективными для очистки аммиака. Все они были глубокими эвтектическими растворителями (ГЭР) – так называют смесь двух веществ, температура плавления которой ниже температуры плавления отдельных компонентов. ГЭР получают из доступных реагентов с помощью простого синтеза, а поскольку они остаются жидкими в широком диапазоне температур сейчас их считают перспективными классом зеленых растворителей. Исследователи работали с тремя уже испытанными ГЭР на основе тиоцианата аммония, которые по данным литературы могут абсорбировать большие количества аммиака, и одним уникальным составом на основе метансульфоната 1-бутил-3-метилимидазолия, который был перспективен уже по данным предварительных экспериментов самих российских ученых.
Все они были глубокими эвтектическими растворителями (ГЭР) – так называют смесь двух веществ, температура плавления которой ниже температуры плавления отдельных компонентов. ГЭР получают из доступных реагентов с помощью простого синтеза, а поскольку они остаются жидкими в широком диапазоне температур сейчас их считают перспективными классом зеленых растворителей. Исследователи работали с тремя уже испытанными ГЭР на основе тиоцианата аммония, которые по данным литературы могут абсорбировать большие количества аммиака, и одним уникальным составом на основе метансульфоната 1-бутил-3-метилимидазолия, который был перспективен уже по данным предварительных экспериментов самих российских ученых.
Исходная газообразная трёхкомпонентная смесь состояла из Nh4, N2, h3 в объёмных отношениях 15.5/62.8/21.7. Лучший результат показал абсорбент на основе ГЭР из тиоцианата аммония смешанного с глицеролом: с ним чистота аммиака на выходе составляла почти 99%. Однако после повышения скорости подачи газовой смеси эффективность этого абсорбента сильно падала, что может быть критично при масштабировании технологии до реального производства.
Вековые традиции, колоссальные возможности
Не только российские ученые пытаются применить мембранный подход к очистке аммиака. Однако большинство других исследований в этой области, по словам авторов работы, носят материаловедческий характер и пока далеки от практической реализации. В новом же исследовании российских химиков не только подобран наиболее перспективный состав абсорбента, но и проведены проточные эксперименты в реальном аппарате со смесью газов, предельно приближенной к составу продуктов процесса Габера-Боша. При этом степень очистки Nh4 составила до 99 %, что близко к современному промышленному способу, дающему чистоту аммиака до 99.8 %, но сопряженному с огромными энергопотерями из-за использования криогенных технологий.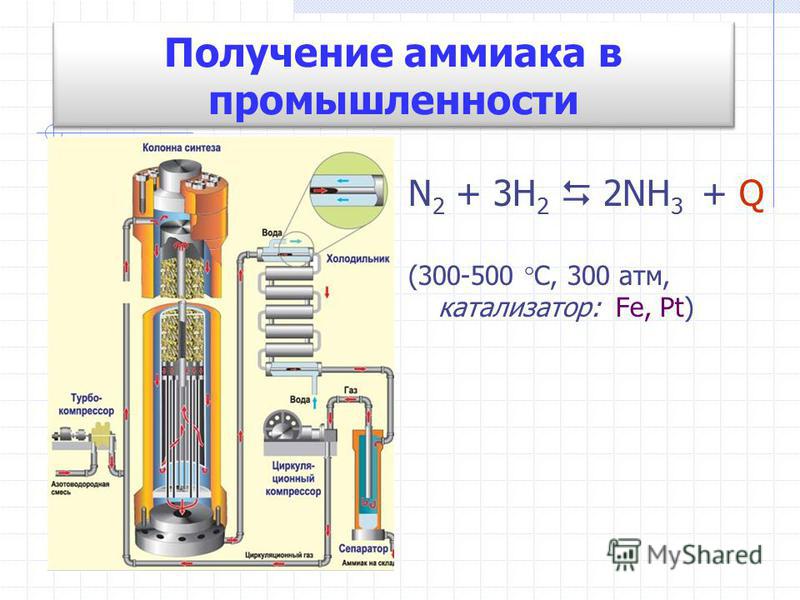
«В этой работе мы определили наиболее перспективные абсорбирующие материалы, а теперь продолжаем изучать процесс и разрабатываем новую конструкцию мембранного модуля, которую будет возможно масштабировать для задач промышленности», – рассказывает Илья Воротынцев. «Конечно, процесс синтеза аммиака остается практически неизменным на протяжении 100 лет, но он сопряжен с такими большими затратами энергии и проводится в таких колоссальных объемах, что снижение энергопотребления не то что на порядок, а даже на проценты может принести колоссальную прибыль, а в нашем методе как раз не требуется никаких хладагентов, и поэтому он гораздо доступней. Да, смена производственной парадигмы – это процесс не мгновенный, но бизнес быстро считает прибыль и убытки, и если будет пример экономически удачной реализации нашего процесса, то это будет мощным толчком к изменениям у всех производителей аммиака».
Получение аммиака в промышленности | Промышленность России и мира.
 ..
..Аммиак— легкий бесцветный газ, имеющий неприятный резкий запах. Он очень важен для химической промышленности, так как в его составе имеется атом азота и три атома водорода. Аммиак применяется в основном для получения азотосодержащих удобрений, сульфата аммония и мочевины, для получения взрывчатых веществ, полимеров и других продуктов, так же аммиак применяется и в медицине.
Получение аммиака в промышленности не простой, трудоемкий и дорогостоящий процесс, основанный на синтезе его из водорода и азота при помощи катализатора, высокой температуры и под давлением. Активированное оксидами калия и алюминия губчатое железо используется как катализатор. Промышленные установки по синтезу аммиака основаны на циркуляции газов. Это выглядит следующим образом: прореагировавшая смесь газов, в которой содержится аммиак, охлаждается и происходит конденсация и отделение аммиака, а азот с водородом, которые не вступали в реакцию перемешиваются с новой порцией газов и вновь подаются на катализатор.
Рассмотрим данный процесс производственного синтеза аммиака, который происходит в несколько стадий, более подробно. На первой стадии производится удаление серы из природного газа при помощи технического устройства десульфуратора. На втором этапе осуществляется процесс конверсии метана при температуре 800 градусов по Цельсию на никелевом катализаторе: Образовавшийся после данной реакции водород пригоден для синтеза аммиака и в реактор подается воздух, содержащий азот. На этой стадии так же происходит частичное сгорание углерода после его взаимодействия с кислородом, который так же содержится в воздухе: 2 h3O + O2->h3О (пар).
Результатом данной стадии производства является получение смеси водяного пара и оксидов углерода (вторичного) и азота. Третья стадия идет в два процесса. Так называемый процесс “сдвига” идет в двух реакторах “сдвига”. В первом применяется катализатор Fe3O4 и реакция идет при высоких температурах, порядка 400 градусов по Цельсию. + 45,9 кДж. (процесс Гербера)
+ 45,9 кДж. (процесс Гербера)
особенности производственного процесса » SpecAvto — Спецавто — Бетононасосы
Аммиак, как известно еще из школьного курса химии, легкий газ, не имеющий цвет, зато обладающий весьма неприятным запахом. Это вещество имеет чрезвычайно важное значение для промышленности: оно не только служит основой для производства азотных удобрений, но и находит широкое применении в медицине, а также в производстве различных взрывчатых веществ.
Процесс получения аммиака в промышленных условиях включает в себя следующие основные стадии.
- Во-первых, с помощью так называемого десульфатора происходит изъятие серы из смеси, основой которой служит природный газ.
- Во-вторых, полученный состав принимает участие в процессе конверсии, неприменным атрибутом которого является применение никелевого катализатора. Данная реакция должна проходить при температуре 8000С, а ее основным результатом является выделение чистого водорода.

- Третья стадия предполагает подачу в реактор, в котором находится выделившийся водород, азота. Эта реакция включает в себя частичное удаление и концентрацию углерода, а также образование водяного пара. Часть азота при этом остается в свободном виде. Необходимыми катализаторами служат оксид железа и медь. Собственно реакция идет как бы в два этапа, температура при этом опускается с четырехсот до 200 градусов по шкале Цельсия.
- В-четвертых, газовую смесь освобождают от четырехвалентного оксида углерода. Для того чтобы избавиться от ненужной примеси, добавляют специальные щелочные растворы, за счет которых данный оксид и поглощается. Остатки углерода, которых, несмотря на все усилия, обычно сохраняется до 0,5%, связывают с атомами водорода, превращая их в метан. Этот процесс идет при показателях температуры реакции в 4000С.
После всех этих преобразований полученная смесь сжимается, что сопровождается резким повышением температуры. Затем газ охлаждается, и аммиак выделяется в виде конденсата.
Как видно из всего вышеизложенного, получение аммиака в промышленных условиях, процесс не только длительный, но и достаточно затратный. В его основе лежит процесс объединения азота и водорода с участием сразу нескольких катализаторов. На предприятиях по производству этого вещества применяется принцип циркуляции газов: полученный в результате охлаждения смеси аммиак отделяется от водорода и азота, атомы которых, не вступившие в реакцию, вновь используются в промышленном процессе.
Метки: водорода, процесс
Аммиак. Свойства аммиака. Получение аммиака. Соли аммония
Аммиак — одно из важнейших соединений азота.
Азот, входящий в состав белков и нуклеиновых кислот, является одним из компонентов, составляющих основу жизни. Поэтому очень важно было научиться синтезировать химические соединения с азотом. Сначала использовали электричество, но этот способ оказался очень дорогим. Более простым способом явилась химическая реакция соединения азота, находящегося в воздухе, с водородом в химическое соединение — аммиак!
Получение аммиака
Получение аммиака в промышленности связано с прямым его синтезом из простых веществ. Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
Как уже отмечалось, источником азота служит воздух, а водород получают из воды.
3H2 + N2 → 2NH3 + Q
Аммиак. Водный раствор
Реакция синтеза аммиака обратима, поэтому важно подобрать условия, при которых выход аммиака в химической реакции будет наибольшим. Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). В ходе реакции объёмы газов (водорода и азота) уменьшаются в 2 раза, поэтому высокое давление позволяет увеличить количество образующегося аммиака. Катализатором в такой реакции может служить губчатое железо. При этом интересно то, что губчатое железо действует как катализатор только при температуре выше 5000C. Но увеличение температуры способствует распаду молекулы аммиака на водород и азот. Для избежания распада молекул, как только смесь газов проходит через губчатое железо, образовавшийся аммиак сразу охлаждают! Кроме того при сильном охлаждении аммиак превращается в жидкость.
Получение аммиака в лабораторных условиях производят из смеси твёрдого хлорида аммония (NH4Cl) и гашенной извести. При нагревании интенсивно выделяется аммиак.
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Свойства аммиака
Аммиак при обычных условиях — газ с резким и неприятным запахом. Аммиак ядовит! При 20 0C в воде растворяется 700 л аммиака. Полученный раствор называют аммиачной водой. Из-за такой растворимости аммиак нельзя собирать и хранить над водой.
Аммиак — активный восстановитель. Такое свойство у него за счёт атомов азота, имеющих степень окисления «-3». Восстановительные свойства азота наблюдаются при горении аммиака на воздухе. Так как для азота наиболее устойчивая степень окисления — 0, то в результате этой реакции выделяется свободный азот.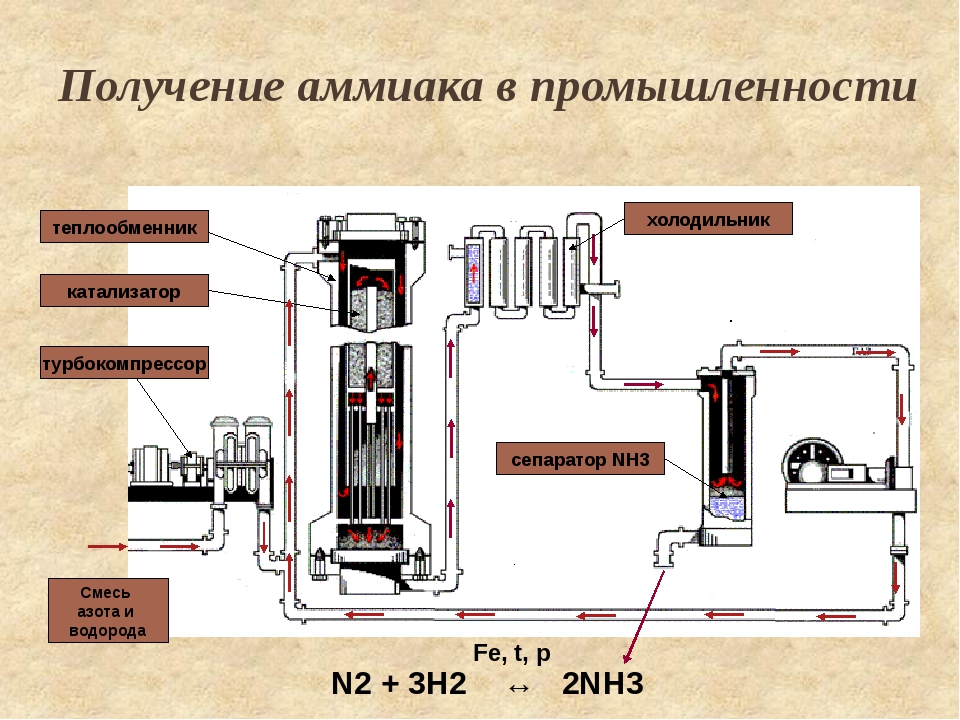
Если в реакции горения использовать катализаторы (платину Pt и оксид хрома Cr2O3), то получают оксид азота.
4NH3 + 5 O2 → 4NO + 6H2O
Аммиак может восстанавливать металлы из их оксидов. Так реакцию с оксидом меди используют для получения азота.
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Реакция гидроксида меди с аммиакомАммиак обладает свойствами оснований и щелочей. При растворении его в воде образуется ион аммония и гидроксид-ион. При этом соединения NH4OH — не существует! Поэтому формулу аммиачной воды лучше записать, как формулу аммиака!
Основные свойства аммиака проявляются также и в реакциях с кислотами.
NH3 + HCl → NH4Cl (нашатырь)
NH3 + HNO3 → NH4NO3 (аммиачная селитра)
Аммиак реагирует с органическими веществами. Например, искусственные аминокислоты получают с помощью реакции аммиака и A-хлорзамещёнными карбоновыми кислотами. Выделяющийся в результате реакции хлороводород (газ HCl) связывают с избытком аммиака, в результате которого образуется нашатырь (или хлорид аммония NH4Cl).
Например, искусственные аминокислоты получают с помощью реакции аммиака и A-хлорзамещёнными карбоновыми кислотами. Выделяющийся в результате реакции хлороводород (газ HCl) связывают с избытком аммиака, в результате которого образуется нашатырь (или хлорид аммония NH4Cl).
Многие комплексные соединения содержат в качестве лиганда аммиак. Аммиачный раствор оксида серебра, который используется для обнаружения альдегидов, представляет собой комплексное соединение — гидроксиддиаммин серебра.
Ag2O + 4NH3 + H2O →2[Ag(NH3)2]OH
Соли аммония
Соли аммония
— твёрдые кристаллические вещества, не имеющие окраски. Почти все они растворяются в воде, и им характерны все те же свойства, которые имеют известные нам соли металлов. Они взаимодействуют со щелочами, при этом выделяется аммиак.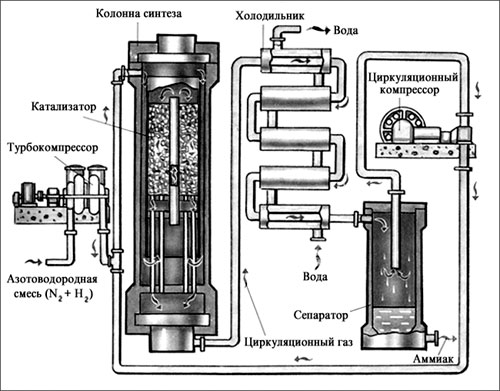
NH4Cl + KOH → KCl + NH3 + H2O
При этом, если дополнительно воспользоваться индикаторной бумагой, то эту реакцию можно использовать — как качественную реакцию на соли аммония. Соли аммония взаимодействуют с другими солями и кислотами. Например,
(NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl
(NH4)2CO3 + 2HCl2 → 2NH4Cl + CO2 + H2O
Соли аммония неустойчивы к нагреванию. Некоторые из них, например хлорид аммония (или нашатырь), — возгоняются (испаряются при нагревании), другие, например нитрит аммония, — разлагаются
NH4Cl → NH3 + HCl
NH4NO2 → N2 + 2H2O
Последняя химическая реакция — разложение нитрита аммония — используется в химических лабораториях для получения чистого азота.
Аммиак — это слабое основание, поэтому соли, образованные аммиаком в водном растворе подвергаются гидролизу. В растворах этих солей имеется большое количество ионов гидроксония, поэтому реакция солей аммония — кислая!
NH4+ + H2O → NH3 + H3O+
Применение аммиака и его солей основано на специфических свойствах. Аммиак служит сырьём для производства азотосодержащих веществ, а также в составе солей широко применяется в качестве минеральных удобрений. Водный раствор аммиака можно купить в аптеках под названием нашатырный спирт.
Аммиак — урок. Химия, 8–9 класс.
Строение молекулы
Формула аммиака — Nh4. Степень окисления азота равна \(–3\). В молекуле три ковалентные полярные связи. У атома азота одна электронная пара остаётся неподелённой и играет важную роль в способности аммиака вступать в химические реакции.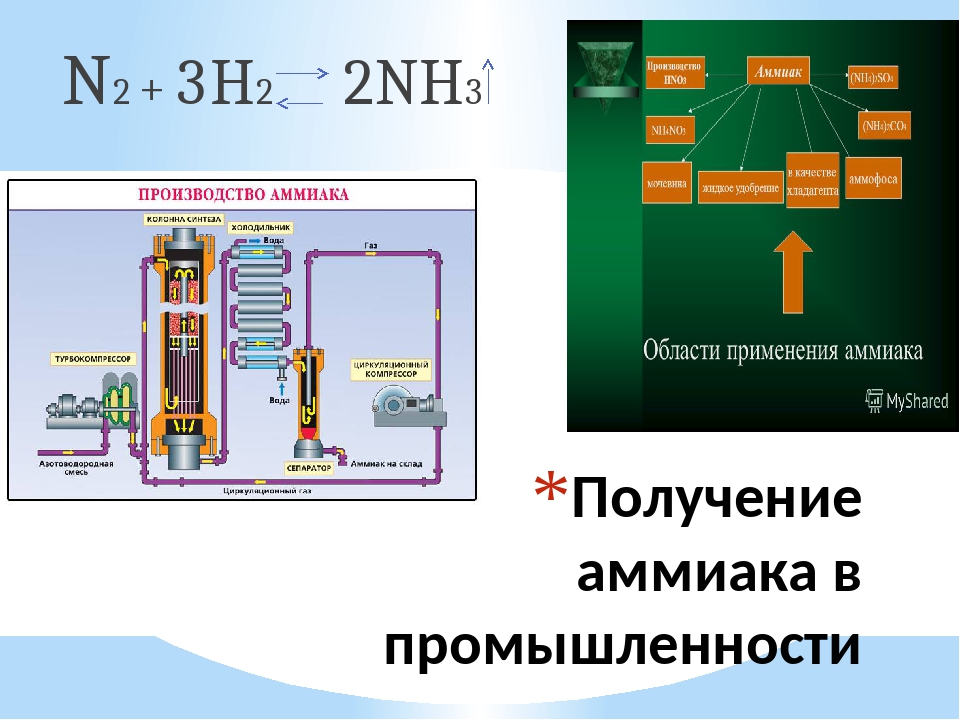
Молекула аммиака имеет форму пирамиды, в вершине которой расположен атом азота, а в основании — три атома водорода.
Рис. \(1\). Молекула аммиака
Общие электронные пары в молекуле смещены к более электроотрицательному атому азота. Он заряжен отрицательно, а атомы водорода — положительно. Поэтому молекула полярна и представляет собой диполь. Благодаря высокой полярности молекулы аммиака способны образовывать водородные связи между собой и с молекулами воды. Образование водородных связей влияет на физические свойства вещества.
Физические свойства
При обычных условиях аммиак представляет собой бесцветный газ с резким неприятным запахом. Он легче воздуха. Ядовит.
Аммиак очень хорошо растворяется в воде — при \(20\) °С в одном объёме воды может раствориться до \(700\) объёмов аммиака. Раствор с содержанием газа \(25\) % называется аммиачной водой, а \(10\)%-ный раствор используется в медицине как нашатырный спирт.
Аммиак легко сжижается при пониженной температуре или при повышенном давления. При испарении жидкого аммиака поглощается много тепла, что позволяет использовать его в холодильных установках.
Химические свойства
1. Восстановительные свойства.
Степень окисления азота в аммиаке — \(–3\), поэтому в окислительно-восстановительных реакциях он выступает в роли сильного восстановителя.
Аммиак окисляется кислородом с образованием азота или оксида азота(\(II\)). Результат реакции зависит от условий её протекания.
При горении аммиака в чистом кислороде образуется азот:
4N−3h4+3O20=2N20+6h3O−2.
Если реакция проводится с катализатором, то образуется оксид азота(\(II\)):
4N−3h4+5O20=k4NO+2+6h3O−2.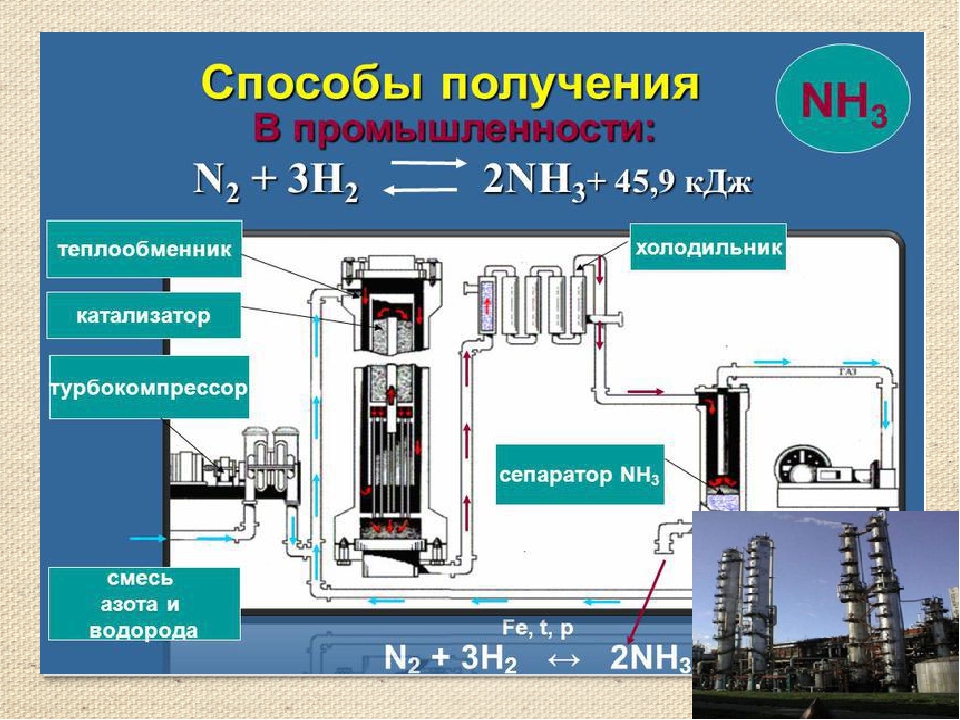
2. Основные свойства.
Если в водный раствор аммиака добавить несколько капель фенолфталеина, то его окраска станет малиновой. Значит, раствор содержит гидроксид-ионы. Образование этих ионов происходит в результате реакции между водой и молекулами аммиака:
Nh4+h3O⇄Nh4⋅h3O⇄Nh5++OH−.
Образующийся в реакции неустойчивый гидрат аммония частично диссоциирует на ионы аммония и гидроксид-ионы.
Аммиак реагирует с кислотами. При этом образуются соли аммония. Так, с соляной кислотой образуется хлорид аммония, а с серной — сульфат аммония:
Nh4+HCl=Nh5Cl,
2Nh4+h3SO4=(Nh5)2SO4.
Получение и применение
В промышленности аммиак синтезируют из азота и водорода:
N2+3h3⇄t,p,k2Nh4.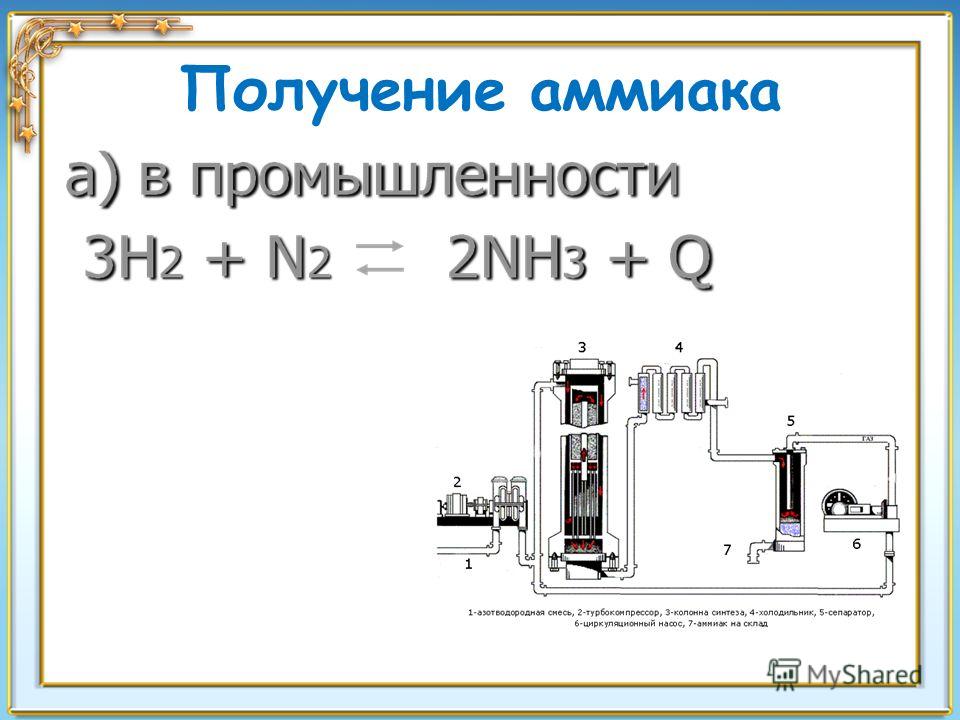
Рис. \(2\). Производство аммиака
Лабораторный способ получения — реакция между солью аммония и гидроксидом кальция:
2Nh5Cl+Ca(OH)2=CaCl2+2Nh4↑+2h3O.
В больших количествах аммиак применяется для производства азотной кислоты и минеральных удобрений, а также красителей и взрывчатых веществ. Используется в холодильных установках. Нашатырный спирт находит применение в медицине и в быту.
Источники:
Рис. 1. Молекула аммиака https://upload.wikimedia.org/wikipedia/commons/1/11/Ammonia-2D-dimensions.png
Рис. 2. Производство аммиака https://cdn.pixabay.com/photo/2014/07/31/21/42/industry-406905_960_720.jpg
Аммиак промышленный синтез — Справочник химика 21
Основным промышленным способом получения аммиака является синтез его из азота и водорода.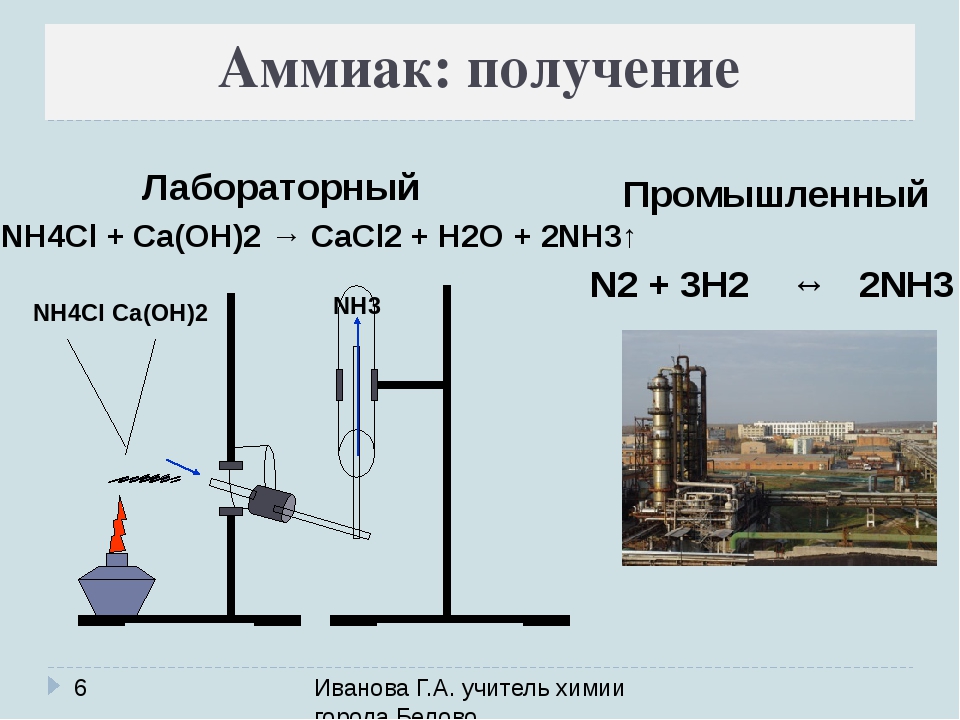 Реакция экзотермическая и обратимая [c.109]
Реакция экзотермическая и обратимая [c.109]Если бы после первой мировой войны промышленный синтез аммиака был запрещен, к каким бы это привело последствиям Как бы изменился мир [c.525]
В промышленности аммиак получают синтезом из простых веществ [c.350]
Как уже отмечалось ранее, в замкнутых энерготехнологических схемах производства аммиака промышленные выбросы уменьшаются. В частности, на стадии синтеза для предотвращения накопления инертных газов прибегают к продувке циркуляционного газа. После выделения аммиака этот газ можно использовать как сырье или топливо на стадиях производства водородсодержащего газа. Состав продувочных газов [в % (об.)] при общем их объеме 8510 м /ч приведен ниже [c.209]
Промышленный синтез аммиака проводят различными способами при разных давлениях (от 100 до 1000 атм) и высоких температурах (400—600°С) в присутствии катализаторов.
 Азот для синтеза аммиака получают из воздуха, а водород — из газов коксового, водяного, воздушного, природного или разложением воды. [c.131]
Азот для синтеза аммиака получают из воздуха, а водород — из газов коксового, водяного, воздушного, природного или разложением воды. [c.131] Ведущими направлениями потребления нефтяного или газового углеводородного сырья в нефтехимической промышленности как в Советском Союзе, так и за рубежом являются 1) производство ацетилена, аммиака, метанола, синтез-газа и других, потребляющее, главным образом, природный газ 2) производство бутадиена, изопрена, бутиленов и других, использующее в основном углеводороды С4 и С5, содержащиеся в природных, попутных и нефтезаводских крекинговых и пиролизных газах 3) производство высших олефинов, диолефинов, спиртов, кислот и других, потребляющее парафины и парафиновые концентраты или дистилляты 4) производство бензола, толуола, ксилолов и других моноядерных ароматических углеводородов, использующее отдельные узкие фракции прямогонных бензинов и бензинов вторичного происхождения 5) производство этилена, пропилена и других ценных углеводородов, потребляющее различные виды газообразного и жидкого нефтяного сырья.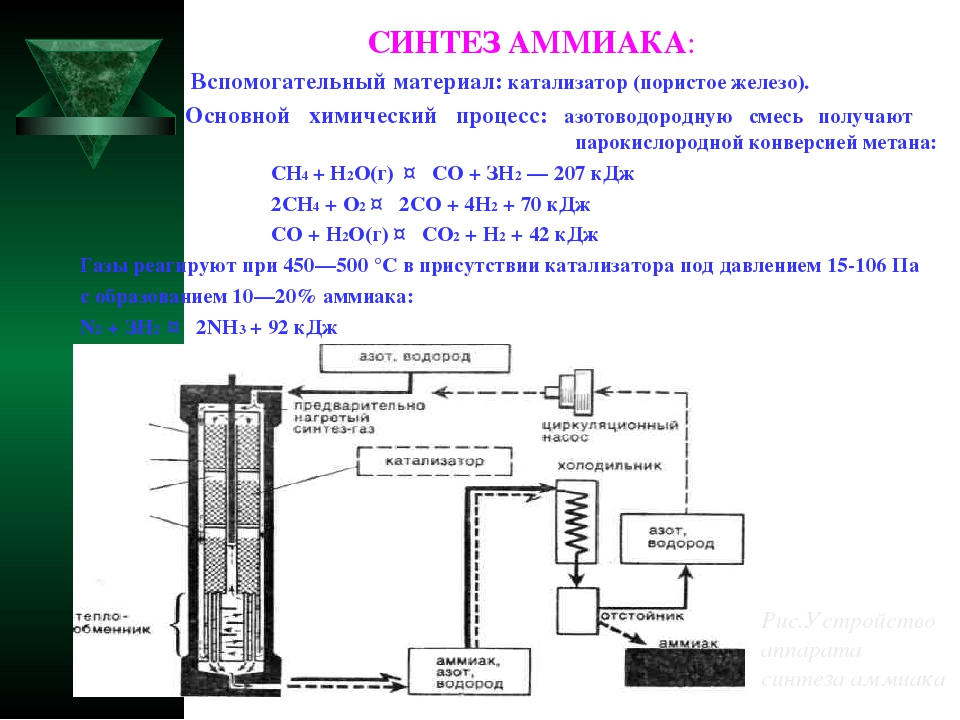 [c.10]
[c.10]
В промышленности синтез аммиака ведут в стальных колоннах обычно при 30 МПа и 450 °С. Катализатором является губчатое железо с активирующими добавками (АЬОз, К2О и др ). Необходимую для реакции азото-водородную смесь получают конверсией прир одного газа (см. разд. 7.7). [c.395]
NO-монооксид азота, бесцветный газ, практически не растворяется в воде, реагирует с кислородом (продукт-NO2), образуется при взаимодействии разбавленной азотной кислоты с диоксидом серы, а в природе-при грозовых разрядах (N3 + Oj 2NO), является промежуточным продуктом в промышленном синтезе азотной кислоты из аммиака [c.137]
Аммиак имеет большое промышленное значение. В основном он используется для производства удобрений и является начальным продуктом для промышленного синтеза многих химических веществ. Азотную кислоту получают исключительно из аммиака. Аммиак производят обычно на крупных предприятиях с производительностью до 1 тыс. т/сут. Для дальнейшей переработки аммиак транспортируют на другие предприятия автомобильным, железнодорожным транспортом или по трубопроводам. Как отмечалось выше, аммиак транспортируют либо в сжиженном виде, либо охлажденным. Отметим, что транспортировка аммиака в охлажденном » виде более безопасна. Мировое производство аммиака примерно совпадает по количеству с мировым производством хлора. [c.385]
т/сут. Для дальнейшей переработки аммиак транспортируют на другие предприятия автомобильным, железнодорожным транспортом или по трубопроводам. Как отмечалось выше, аммиак транспортируют либо в сжиженном виде, либо охлажденным. Отметим, что транспортировка аммиака в охлажденном » виде более безопасна. Мировое производство аммиака примерно совпадает по количеству с мировым производством хлора. [c.385]
Основным промышленным способом получения аммиака является синтез его из азота и водорода. Реакция экзотермическая и обратимая N2 + Зh3 =г 2 Hз, ДЯ° = —92,4 кДж. [c.191]
В промышленности аммиак получают синтезом из простых веществ. В соответствии с принципом Ле Шателье процесс проводят при давлении 5—1000 атм. Для ускорения реакции применяют катализатор (обычно железо) и нагревание до 400—500°С. Аммиак выделяется также при коксовании каменного угля. В лаборатории его получают действием щелочей на аммонийные соли.
 Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений — жидкого аммиака и его водных растворов, ЫН4ЫО3, (ЫН4)г504 и др. Водный раствор аммиака (аммиачная вода) — важный реактив для проведения различных реакций. [c.394]
Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений — жидкого аммиака и его водных растворов, ЫН4ЫО3, (ЫН4)г504 и др. Водный раствор аммиака (аммиачная вода) — важный реактив для проведения различных реакций. [c.394]Катализаторы широко применяются в промышленности (синтез аммиака, производство серной кислоты, гидрирование жиров, крекинг нефти и пр.). Различают гомогенный катализ, при котором катализатор находится в одной фазе с реагирующими веществами, и гетерогенный, при котором реакции происходят на поверхности катализатора. [c.406]
Реакция экзотермична и происходит с уменьшением числа газообразных молекул. В соответствии с принципом Ле Шателье протеканию прямой реакции способствуют низкая температура и высокое давление. При низкой температуре скорость достижения равновесия слишком мала, а при высокой температуре равновесие сдвинуто влево. Поэтому используют оптимальные значения температуры и применяют катализатор для увеличения скорости реакции.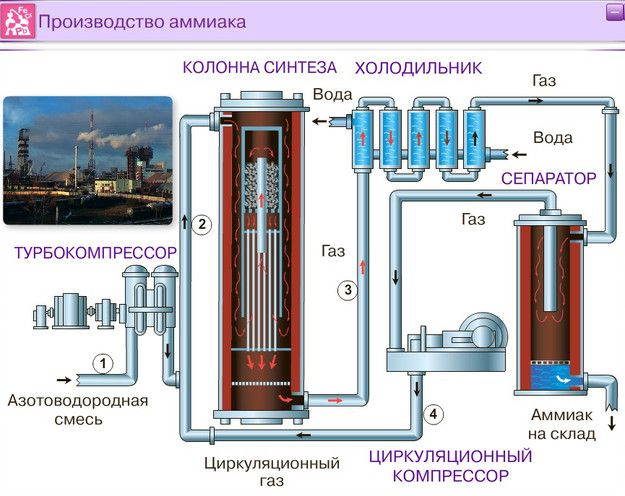 Условия промышленного синтеза аммиака следующие давление 200—1000 атм, 500 °С и в качестве катализатора — железо, активированное оксидом алюминия. Выход составляет ж 10% непрореагировавшие газы возвращаются в установку (рис. 22.3). [c.465]
Условия промышленного синтеза аммиака следующие давление 200—1000 атм, 500 °С и в качестве катализатора — железо, активированное оксидом алюминия. Выход составляет ж 10% непрореагировавшие газы возвращаются в установку (рис. 22.3). [c.465]
Нефтеперерабатывающая и нефтехимическая промышленность становится крупным потребителем водорода. Если раньше водород в основном расходовался в промышленности синтеза аммиака, то уже в 1970 г. нефтеперерабатывающая и нефтехимическая промышленность использовала почти треть производимого водорода (5,6 млн. т/год) и по масштабам потребления стала сравнимой с производством аммиака, что видно из следующих данных [1] [c.6]
Физическая химия веществ, находящихся под действием высокого давления, развивается в настоящее время чрезвычайно быстро, ибо за последние сто с небольшим лет высокое давление сделалось мощным методом воздействия на самые разнообразные свойства веществ. С помощью высокого давления получены весьма ценные результаты в физике, химии, геологии, а также осуществлены важнейшие процессы в промышленности синтез аммиака, полимеризация этилена, синтез алмаза и других сверхтвердых материалов и т. д. [c.5]
д. [c.5]
ЦИИ этилендихлорида с аммиаком используется в различных промышленных синтезах. [c.259]
Синтез аммиака. Реакция синтеза аммиака является одним из самых изученных процессов промышленной химии. Для протекания этой реакции необходимо применение высокого давления (вплоть до 100 МПа). Процесс [c.94]
В-третьих, успех промышленного синтеза аммиака, во многом обеспеченный принципиально новым решением вопроса о конструкциях аппаратов высокого давления, проложил пути перехода от ап- [c.146]
При строгом анализе необходимо принять во внимание теплоту смешения аммиака с неконвертированным синтез-газом. На рис. 35— 38 теплоемкости Н2, N2, МНд и СН4 представлены как функции температуры и давления. Нильсоном [69] была сделана сводка значений теплового эффекта реакции при 500° С, полученных различными авторами. Значения зависят от поправки на теплоту смешения. На практике более удобно применять стандартный тепловой эффект реакции АЯ45о с (450 °С — оптимальная температура промышленного синтеза) и среднюю теплоемкость газовой смеси Ср- АЯ45о с принимается равной 12,95 ккал1моль ЫНд, а Ср вычисляется по формуле [c. 155]
155]
При каких условиях ведут промышленный синтез аммиака [c.111]
В замкнутых системах производства аммиака промышленные выбросы уменьшаются. Ранее на стадии синтеза аммиака для предотвращения накопления инертных газов прибегали к продувке и частичному сбросу в атмосферу циркуляционного газа. В настоящее время этот газ после отделения аммиака используют как сырье или топливо на стадиях производства водородсодержащего газа. [c.197]
Равновесие благоприятствует образованию аммиака при обычной температуре, но скорость реакции очень мала, и эти условия непригодны для промышленного синтеза. [c.223]
Зачем применяют катализатор в промышленном синтезе аммиака [c.152]
Как отмечалось, гетерогенный катализ широко используется в промышленности (синтез и окисление аммиака, синтез метилового спирта, переработка нефтяных продуктов). [c.524]
В данной программе мы обсудим промышленный синтез аммиака и важные применения этого продукта. [c.331]
[c.331]
Какой процесс используется для промышленного синтеза аммиака Укажите название этого процесса, запишите уравнение реакции, на которой он основан, и укажите условия, при которых проводится эта реакция. [c.352]
Опишите промышленный синтез аммиака и обоснуйте условия его. [c.469]
Производство искусственных смол нуждается в таком широком ассортименте исходных мономеров, что трудно выбрать наиболее важные продукты, которые нефтехимическая промышленность способна поставлять для этой цели. Тем не менее в первую очередь следует назвать стирол, хлористый винил и полиэтилен из этилена, фюрмальдегид из синтетического метанола нефтехимического происхождения и мочевину из аммиака, в синтезе которого используется водород, получаемый конверсией нефтяных газов с водяным паром. [c.22]
В процессе промышленного синтеза аммиака [c.
 18]
18]Реакция синтеза аммиака из газообразных азота и водорода является обратимой н протекает по уравнению Зh3 + N2ч=i 2NHз с выделением тепла. Для того чтобы эта реакция была сдвинута в сторону образования аммиака, промышленные установки для производства синтетического аммиака работают под давлением 30— 90 МПа и при температуре 450—500°С. [c.59]
Выход аммиака при синтезе его в электрическом разряде еще очень далек от промышленного выхода, получаемого при обычном синтезе (каталитическая реакция при высоком давлении) и составляюпщго 1 кг1квпг-час, т. е. на два порядка больше лучших выходов при электроразрядном методе. [c.180]
Сложной в теоретическом отношении и чрезвычайно важной для практики оказалась проблема связывания атмосферного азота. В настоящее время, благодаря большому количеству проведенных исследовательских работ, эта проблема успешно решена главным образом путем осуществления реакции промышленного синтеза аммиака из азота и водорода N2- -ЗНаГ 2ЫНзЧ-92 кдж. [c.173]
[c.173]
Впервые явление катализа было открыто в 1806 г. Н. Клеманом и Ш. Дезормом в камерном процессе получения серной кислоты. Они установили каталитическое действие оксидов азота на скорость окисления SO . В конце XIX в. промышленным методом получения серной кислоты стал контактный способ, основанный на окислении SOj кислородом в присутствии платинового катализатора. В настоящее время вместо дорогостоящих платиповых катализаторов успешно работают оксидные смеси (например, VjOj с K2SO4). Каталитическим способом проводят промышленный синтез аммиака (N ) + 3 (Н ) —> 2 (NH.,), где в качестве катализатора используют железо, промо-тированное оксидами алюминия и калия. Синтез азотной кислоты осуществляют с помощью каталитического окисления аммиака в присутствии платинового катализатора. [c.179]
I. Деструктивная гидрогенизация. На основании фундаментальных исследований Бергиуса в лабораториях химического концерна Фарбениндустри (Оппау) были разработаны методы так называемой деструктивной гидрогенизации угля. Для этого оказалось необходимым не только изучить основные химические и каталитические реакции, но и создать совершенно новую технику высоких давлений. Однако эти работы были значительно облегчены благодаря большому опыту, приобретенному в результате развития промышленности синтеза аммиака и метанола. Уже в 1924 г. удалось получить с количественным выходом бензин из смолы полукоксования бурого угля путем ее гидрирования в присутствии молибденовых катализаторов при 450° и 200 ат. Этот способ в 1927 г. был осущест1 лен в крупном масштабе на заводах Лейна. [c.95]
Для этого оказалось необходимым не только изучить основные химические и каталитические реакции, но и создать совершенно новую технику высоких давлений. Однако эти работы были значительно облегчены благодаря большому опыту, приобретенному в результате развития промышленности синтеза аммиака и метанола. Уже в 1924 г. удалось получить с количественным выходом бензин из смолы полукоксования бурого угля путем ее гидрирования в присутствии молибденовых катализаторов при 450° и 200 ат. Этот способ в 1927 г. был осущест1 лен в крупном масштабе на заводах Лейна. [c.95]
Физическая химия позволяет определят[ь наиболее выгодные условия ведения многих технологических процессов, предвидеть их результаты, овладеть теорией этих процессов и научиться ими управлять. Все это имеет фгромное значение для развития химической промышленности (синтеза аммиака, метанола, широкого ассортимента органических веществ, пластических масс, химических волокон, Ьолучения продуктов нефтехимии и лесохимии и др. ), металлургии, нефтяной промышленности, производства строительных материалов, сельского хозяйства, медицины и др. В свою очередь тесное единение развития теории с практикой обогащает физическую химию новыми проблемами и способствует ее развитию. [c.5]
), металлургии, нефтяной промышленности, производства строительных материалов, сельского хозяйства, медицины и др. В свою очередь тесное единение развития теории с практикой обогащает физическую химию новыми проблемами и способствует ее развитию. [c.5]
Равновесие N2 (г) + ЗН2 (г) ч=ь2МНз (г) + 22,08 ктл при повышении температуры смещается влево, при понижении — вправо. Повышение давления благоприятствует образованию веществ, занимающих в данных условиях меньший объем. Понижение давления действует в противоположном направлении. Поэтому увеличение давления при синтезе аммиака сдвигает равновесие вправо, так как при образовании ЫНз число молекул газа уменьшается вдвое, что уменьшает объем системы. Понижение давления способствует разложению аммиака. Синтез ЫНз возможен в стандартных условиях, так как А = —3,98 ккал/моль. Но при такой температуре процесс очень замедлен. Повышение температуры ускоряет процесс, но сдвигает равновесие влево уже при 600—700 С и при 1 атм он становится в прямом направлении невозможным.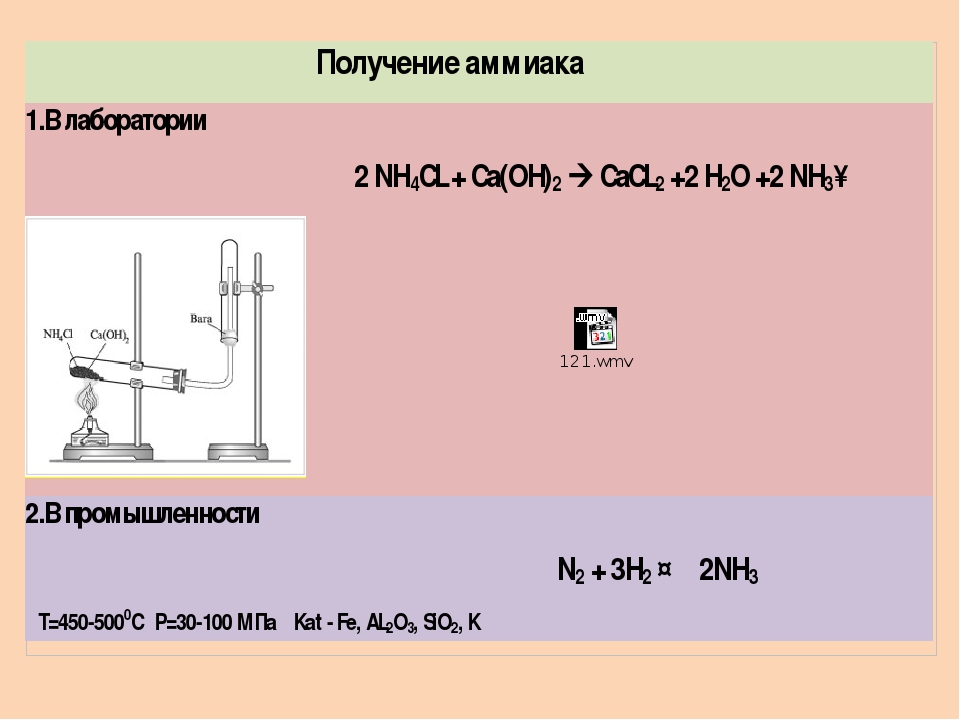 Повышение давления до нескольких сот атмосфер делает эту реакцию возможной при указанной температуре, чем и пользуются в промышленном синтезе аммиака, вводя еще катализаторы для ускорения процесса. [c.30]
Повышение давления до нескольких сот атмосфер делает эту реакцию возможной при указанной температуре, чем и пользуются в промышленном синтезе аммиака, вводя еще катализаторы для ускорения процесса. [c.30]
Только два естественных процесса вызывают пополнение запасов связанного азота — образование NO в плазме фозовых разрядов и деятельность некоторых видов живущих в почве микроорганизмов, способных связывать молекулярный азот. В экологическом равновесии эти процессы компенсируют убыль связанного азота, нЬ при интенсивном ведении хозяйства расход азота превышает его приход, поэтому существует проблема промышленного синтеза связанного азсгта, имеющая огромное хозяйственное значение. В настоящее время ее решают путем производства синтетического аммиака, из которого получают все другие соединения азота. В будущем, возможно, появятся иные промышленные способы связывания азота, в частности, возродится в ином аппаратурном оформлении плазменный синтез NO, который в начале нашего ека некоторое время использовали я промышленности. Кроме того, разрабатываются методы получения соединений аэота, основанные на каталитическом связывании Nj в комплексы некоторых (/-элементов. [c.396]
Кроме того, разрабатываются методы получения соединений аэота, основанные на каталитическом связывании Nj в комплексы некоторых (/-элементов. [c.396]
Применение. Водород в больших количествах применяется в химической промышленности (синтез аммиака, метанола и других веществ), в пищевой промышленностн (производство маргарина), в металлургии для получения железа прямым восстамовлением железной руды. [c.456]
Таким образом, равновесное содержание аммиака резко возрастает с давлением. Это имеет важное значение для промышленного получения аммиака из водорода и азота. При низких температурах порядка комнатной значение константы равновесия синтеза аммиака велико и возможно близкое к количественному превращение азота и водорода в аммиак. Однако скорость реакции при такой температуре слишком низка. При повышении же температуры в силу экзотермичности процесса константа равновесия уменьшается до очень низких значений. Как показывает приведенный расчет, поскольку реакция идет с уменьпгением числа частиц, можно даже при столь малой константе равновесия, как то имеет место при бОО С, получить значительное содержание аммиака в равновесной смеси, повышая давление в реакторе. Это и используется на практике—в промышленности синтез аммиака проводят при повышенных давлениях. [c.259]
Это и используется на практике—в промышленности синтез аммиака проводят при повышенных давлениях. [c.259]
В промышленности аммиак получают синтезом из простых веществ /2N2(г) + 72Н2(г) МНз(г), = 6,19 кДж, [c.381]
Эта реакция представляет значительный интерес, так как она послужила основой для разработки процесса Габера, применяемого в промышленном синтезе аммиака. При низких температурах преобладает прямая реакция, так как процесс эк-зотермичен протеканию реакции благоприятствует также повышение давления, так как в результате реакции происходит уменьшение объема газа. На практике процесс проводится приблизительно при 500 С и давлении от 100 до 1(Ю0 атм. Высокая температура необходима для повышения скорости реакции. В качестве ката- [c.337]
Процесс получения аммиака. Современный процесс производства аммиака
Аммиак — легкий бесцветный газ, имеющий неприятный резкий запах.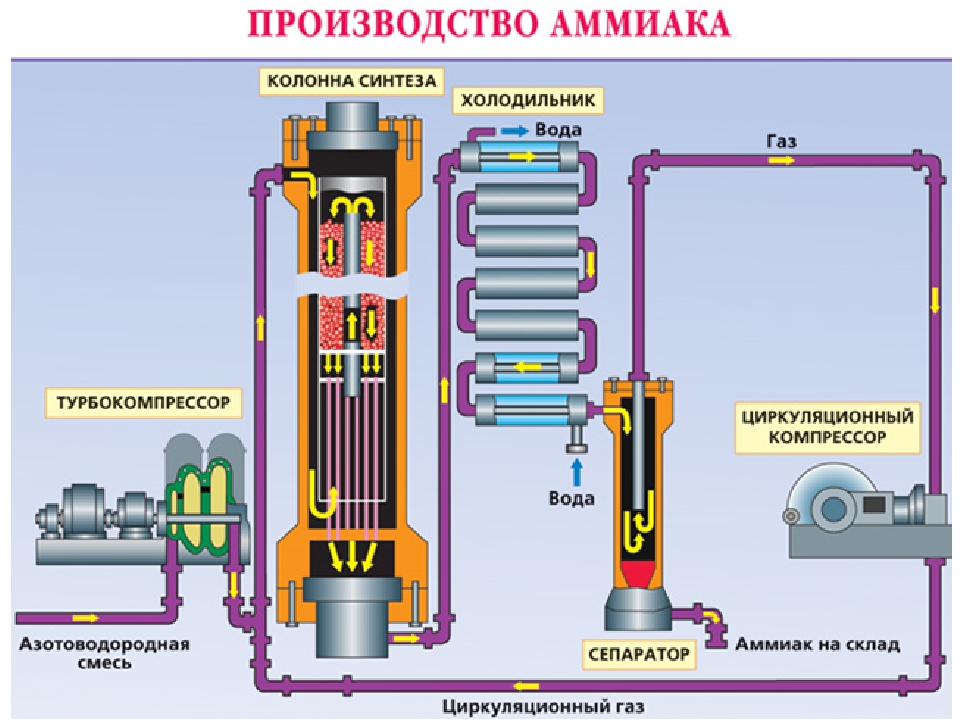 Он очень важен для химической промышленности, так как в его составе имеется атом азота и три атома водорода. Аммиак применяется в основном для получения азотосодержащих удобрений, сульфата аммония и мочевины, для получения взрывчатых веществ, полимеров и других продуктов, так же аммиак применяется и в медицине.
Он очень важен для химической промышленности, так как в его составе имеется атом азота и три атома водорода. Аммиак применяется в основном для получения азотосодержащих удобрений, сульфата аммония и мочевины, для получения взрывчатых веществ, полимеров и других продуктов, так же аммиак применяется и в медицине.
Получение аммиака в промышленности не простой, трудоемкий и дорогостоящий процесс, основанный на синтезе его из водорода и азота при помощи катализатора, высокой температуры и под давлением. Активированное оксидами калия и алюминия губчатое железо используется как катализатор. Промышленные установки по синтезу аммиака основаны на циркуляции газов. Это выглядит следующим образом: прореагировавшая смесь газов, в которой содержится аммиак, охлаждается и происходит конденсация и отделение аммиака, а азот с водородом, которые не вступали в реакцию перемешиваются с новой порцией газов и вновь подаются на катализатор.
Рассмотрим данный процесс производственного синтеза аммиака, который происходит в несколько стадий, более подробно.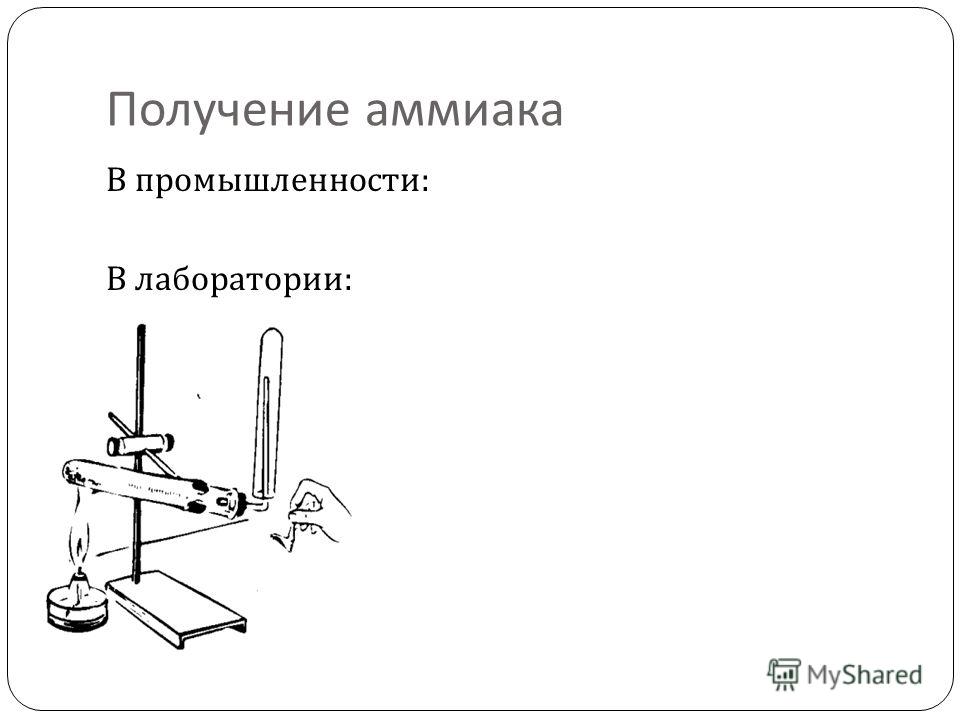 На первой стадии производится удаление серы из природного газа при помощи технического устройства десульфуратора. На втором этапе осуществляется процесс конверсии метана при температуре 800 градусов по Цельсию на никелевом катализаторе: Образовавшийся после данной реакции водород пригоден для синтеза аммиака и в реактор подается воздух, содержащий азот. На этой стадии так же происходит частичное сгорание углерода после его взаимодействия с кислородом, который так же содержится в воздухе: 2 h3O + O2->h3О (пар).
На первой стадии производится удаление серы из природного газа при помощи технического устройства десульфуратора. На втором этапе осуществляется процесс конверсии метана при температуре 800 градусов по Цельсию на никелевом катализаторе: Образовавшийся после данной реакции водород пригоден для синтеза аммиака и в реактор подается воздух, содержащий азот. На этой стадии так же происходит частичное сгорание углерода после его взаимодействия с кислородом, который так же содержится в воздухе: 2 h3O + O2->h3О (пар).
Результатом данной стадии производства является получение смеси водяного пара и оксидов углерода (вторичного) и азота. Третья стадия идет в два процесса. Так называемый процесс “сдвига” идет в двух реакторах “сдвига”. В первом применяется катализатор Fe3O4 и реакция идет при высоких температурах, порядка 400 градусов по Цельсию . Во втором реакторе используется более производительный медный катализатор, и процесс проводится при более низкой температуре. + 45,9 кДж. (процесс Гербера)
+ 45,9 кДж. (процесс Гербера)
Связанные статьи:
| Строительный гипс, состоящий из плотных пород гипса, производят при помощи трех основных операций. Сначала гипсовый камень дробят, затем происходит помол полученного сырья, и… | |
| Химическими отходами называются отходы химической промышленности, которые содержат вредные вещества, представляющие угрозу для человека своим токсическим воздействия на организм. Химическая промышленность – это отрасль промышленности, занимающаяся… | |
Аммиак (NH 3) — соединение азота и водорода. Это лёгкий газ с резким запахом. Получение аммиака в промышленности и лабораториях необходимо для производства удобрений, полимеров, азотной кислоты и других веществ.
В промышленности
Аммиак промышленным путём получают из азота, соединяя его с водородом. Азот берут из воздуха, водород — из воды. Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Впервые метод разработал немецкий химик Фриц Габер. Промышленный способ получения аммиака стали называть процессом Габера.
Реакция проходит с уменьшением объёма и выделением энергии в виде тепла:
3H 2 + N 2 → 2NH 3 + Q.
Реакция обратима, поэтому необходимо соблюсти несколько условий. При высоком давлении и низких температурах объём полученного аммиака увеличивается. Однако низкие температуры замедляют скорость реакции, а повышение температуры способствует увеличению скорости обратной реакции.
Опытным путём были найдены необходимые условия для проведения реакции:
- температура — 500°C;
- давление — 350 атм;
- катализатор — оксид железа Fe 3 O 4 (магнетит) с примесями оксидов серебра, калия, кальция и других веществ.
При таких условиях получившийся газ содержит 30 % аммиака. Чтобы избежать обратной реакции, вещество быстро охлаждают. При низких температурах получившийся газ превращается в жидкость. Неизрасходованные газы — азот и водород — возвращаются обратно в колонну для синтеза. Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
Такой способ помогает быстро получить большие объёмы аммиака, максимально используя сырьё.
Рис. 1. Получение аммиака промышленным путём.
Чтобы найти нужный катализатор, было испробовано 20 тысяч разных веществ.
В лаборатории
Для получения аммиака в лаборатории используется реакция щелочей на соли аммония:
NH 4 Cl + NaOH → NH 3 + NaCl + H 2 O
Также аммиак лабораторным путём можно получить из хлорида аммония, нагретого вместе с гашёной известью, или разложением гидроксида аммония:
- 2NH 4 Cl + Ca(OH) 2 → CaCl 2 + 2NH 3 + 2H 2 O;
- NH 4 OH ↔ NH 3 + H 2 O.
Рис. 2. Получение аммиака в лаборатории.
Полностью осушить аммиак можно с помощью смеси извести с едким натрием, через которую пропускают полученный газ. Для этой же цели жидкий аммиак смешивают с металлическим натрием и подвергают дистилляции.
Аммиак легче воздуха, поэтому для его сбора пробирку держат вверх дном.
Применение
Аммиак используется в разных отраслях:
- в сельском хозяйстве — для производства азотсодержащих удобрений;
- в промышленности — для производства полимеров, взрывчатых веществ, искусственного льда;
- в химии — для изготовления азотной кислоты, соды;
- в медицине — в качестве нашатырного спирта.

Рис. 3. Производство удобрений.
Что мы узнали?
Аммиак получают промышленным и лабораторным путём. Для получения в промышленных масштабах используется азот и водород. Смешиваясь под высокой температурой, давлением и под действием катализатора, простые вещества образуют аммиак. Чтобы реакция при высокой температуре не пошла в обратную сторону, газ охлаждают. В лаборатории аммиак получают при реакции солей аммония со щелочами, гашёной известью или путём разложения гидроксида аммония. Аммиак применяется в химической промышленности, сельском хозяйстве, медицине, химии.
Тест по теме
Оценка доклада
Средняя оценка: 4.2 . Всего получено оценок: 263.
1) 4FeS 2 + 11O 2 → 2Fe 2 O 3 + 8SO 2
2) 2SO 2 + O 2 V 2 O 5 → 2SO 3
3) nSO 3 + H 2 SO 4 → H 2 SO 4 ·nSO 3 (олеум)
Измельчённый очищенный влажный пирит (серный колчедан) сверху засыпают в печь для обжига в «кипящем слое «. Снизу (принцип противотока) пропускают воздух, обогащённый кислородом.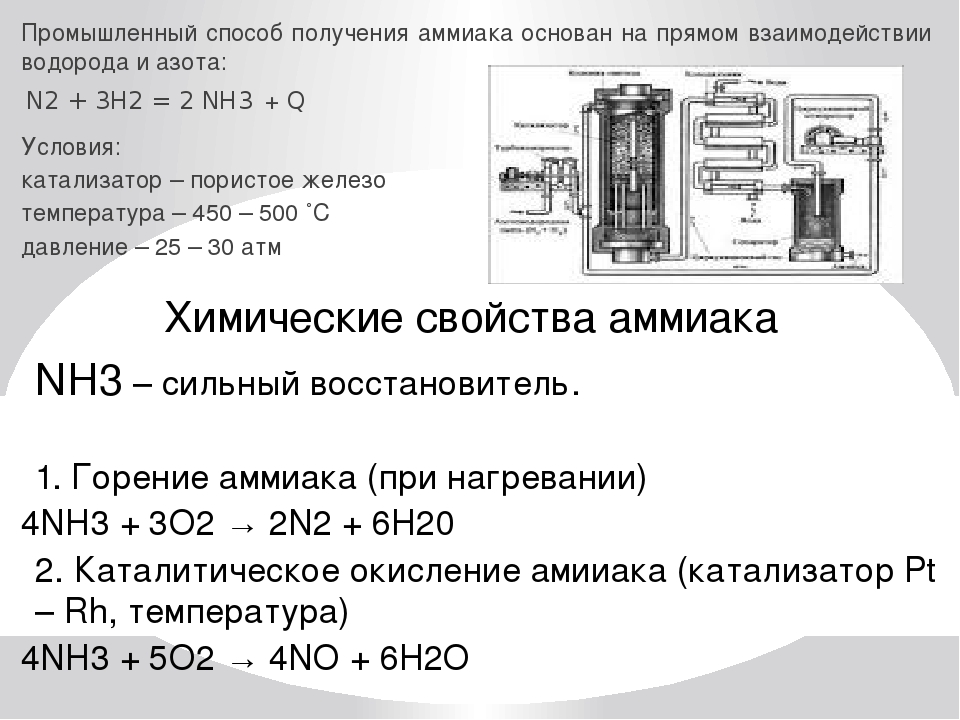
Из печи выходит печной газ, состав которого: SO 2 , O 2 , пары воды (пирит был влажный) и мельчайшие частицы огарка (оксида железа). Газ очищают от примесей твёрдых частиц (в циклоне и электрофильтре) и паров воды (в сушильной башне).
В контактном аппарате происходит окисление сернистого газа с использованием катализатора V 2 O 5 (пятиокись ванадия) для увеличения скорости реакции. Процесс окисления одного оксида в другой является обратимым. Поэтому подбирают оптимальные условия протекания прямой реакции — повышенное давление (т.к прямая реакция идет с уменьшением общего объема) и температура не выше 500 С (т.к реакция экзотермическая).
В поглотительной башне происходит поглощение оксида серы (VI) концентрированной серной кислотой.
Поглощение водой не используют, т.к оксид серы растворяется в воде с выделением большого количества теплоты, поэтому образующаяся серная кислота закипает и превращается в пар. Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 ·nSO 3
Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H 2 SO 4 ·nSO 3
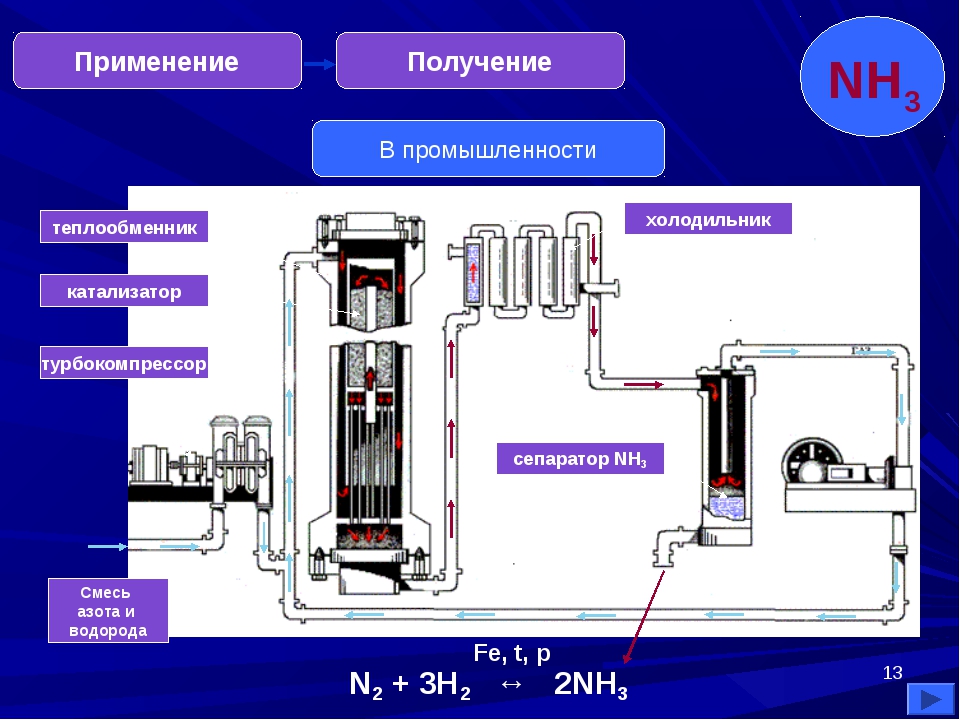
Промышленное получение аммиака
Предварительно получают азотоводородную смесь. Водород получают конверсией метана (из природного газа):
СН 4 + Н 2 О(г) → СО + ЗН 2 — Q
2СН 4 + О 2 → 2СО + 4Н 2 + Q
СО + Н 2 О(г) → СО 2 + Н 2 + Q
Азот получают из жидкого воздуха.
В турбокомпрессоре происходит сжатие смеси до необходимого давления 25·10 6 Па. В колонне синтеза газы реагируют при 450-500 °С в присутствии катализатора (пористое железо с примесями Al 2 O 3 и K 2 O) :
N 2 + 3H 2 ↔ 2NH 3 + 92 кДж (выход 10-20% аммиака)
Образующийся аммиак отделяют от непрореагировавших азота и водорода сжижением в холодильнике, возвращая непрореагировавшую азотоводородную смесь в колонну синтеза.
Процесс непрерывный, циркуляционный.
Применение: производство азотных удобрений, взрывчатых веществ, пластических масс и др.
Производство метилового спирта
До промышленного освоения каталитического способа получения метанол получали при сухой перегонке дерева (отсюда его название «древесный спирт»). В данное время этот способ имеет второстепенное значение.
В данное время этот способ имеет второстепенное значение.
Современный способ:
Сырье: синтез-газ — смесь оксида углерода (II) с водородом (1:2).
Вспомогательные материалы: катализаторы (ZnO и CuO).
Основной химический процесс: синтез-газ при температуре 250 °С и давлении 7 МПа превращается каталитически в метанол:
СО + 2Н 2 ↔ СНзОН + Q
Особенности технологического процесса: при прохождении газовой смеси через слой катализатора образуется 10-15% метанола, который конденсируют, а непрореагировавшую смесь смешивают со свежей порцией синтез — газа и после нагревания снова направляют в слой катализатора (циркуляция). Общий выход — 85%.
Условия проведения синтеза метанола и аммиака при среднем давлении сходны, а сырье (природный газ) общее для обоих процессов. Поэтому чаще всего производства метанола и аммиака объединяют (азотно-туковые заводы).
Аммиак – NH 3
Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей.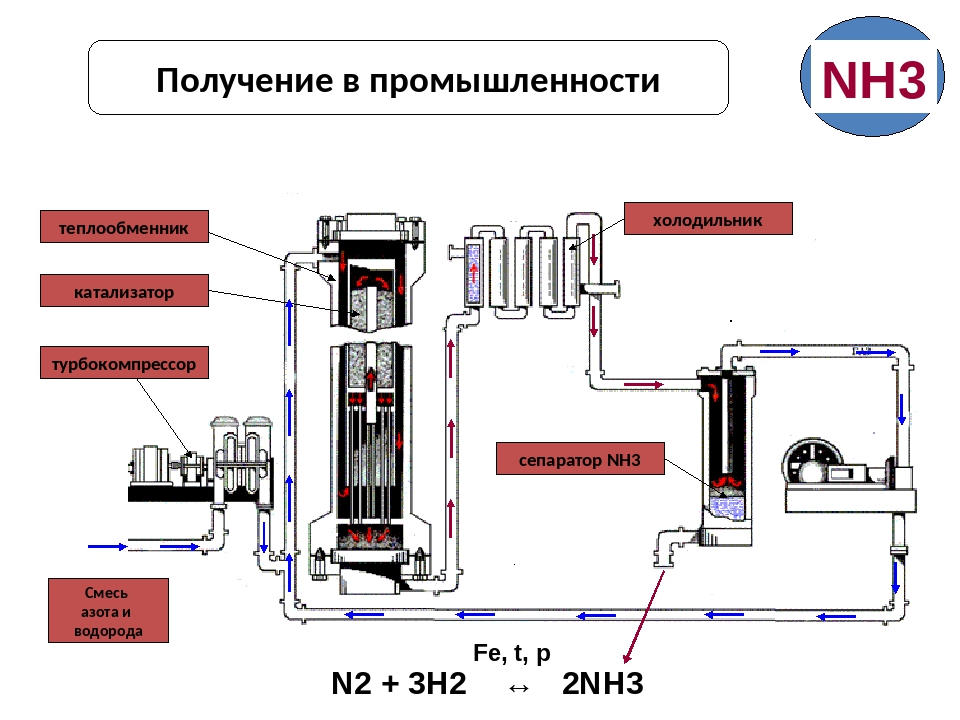 В жарком климате мочевина (NH 2) 2 CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан . Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
В жарком климате мочевина (NH 2) 2 CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан . Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
1. Строение молекулы
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине . Три неспаренныхp-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3.
В лаборатории | В промышленности |
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Внимание ! Гидроксид аммония неустойчивое основание, разлагается: NH 4 OH ↔ NH 3 + H 2 O При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9к Дж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий
физик, разработал физико-химические основы метода). |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с изменением степени окисления атома азота (реакции окисления)
- без изменения степени окисления атома азота (присоединение)
Реакции с изменением степени окисления атома азота (реакции окисления) N -3 → N 0 → N +2 NH 3 – сильный восстановитель. |
с кислородом 1. Горение аммиака (при нагревании) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Каталитическое окисление амииака (катализатор Pt – Rh , температура) 4NH 3 + 5O 2 → 4NO + 6H 2 O Видео — Эксперимент » Окисление аммиака в присутствии оксида хрома» |
с оксидами металлов 2 NH 3 + 3CuO = 3Cu + N 2 + 3 H 2 O |
с сильными окислителями 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании) |
аммиак – непрочное соединение, при нагревании разлагается 2NH 3 ↔ N 2 + 3H 2 |
Реакции без изменения степени окисления атома азота (присоединение — Образование иона аммония NH 4 + по донорно-акцепторному механизму) Видео — Эксперимент «Качественная реакция на аммиак» Видео — Эксперимент «Дым без огня» Видео — Эксперимент «Взаимодействие аммиака с концентрированными кислотами» Видео — Эксперимент «Фонтан» Видео — Эксперимент «Растворение аммиака в воде» |
5. Применение аммиака
Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 . Огромные количества аммиака далее используются для получения азотной кислоты , которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин . Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон , например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка . В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.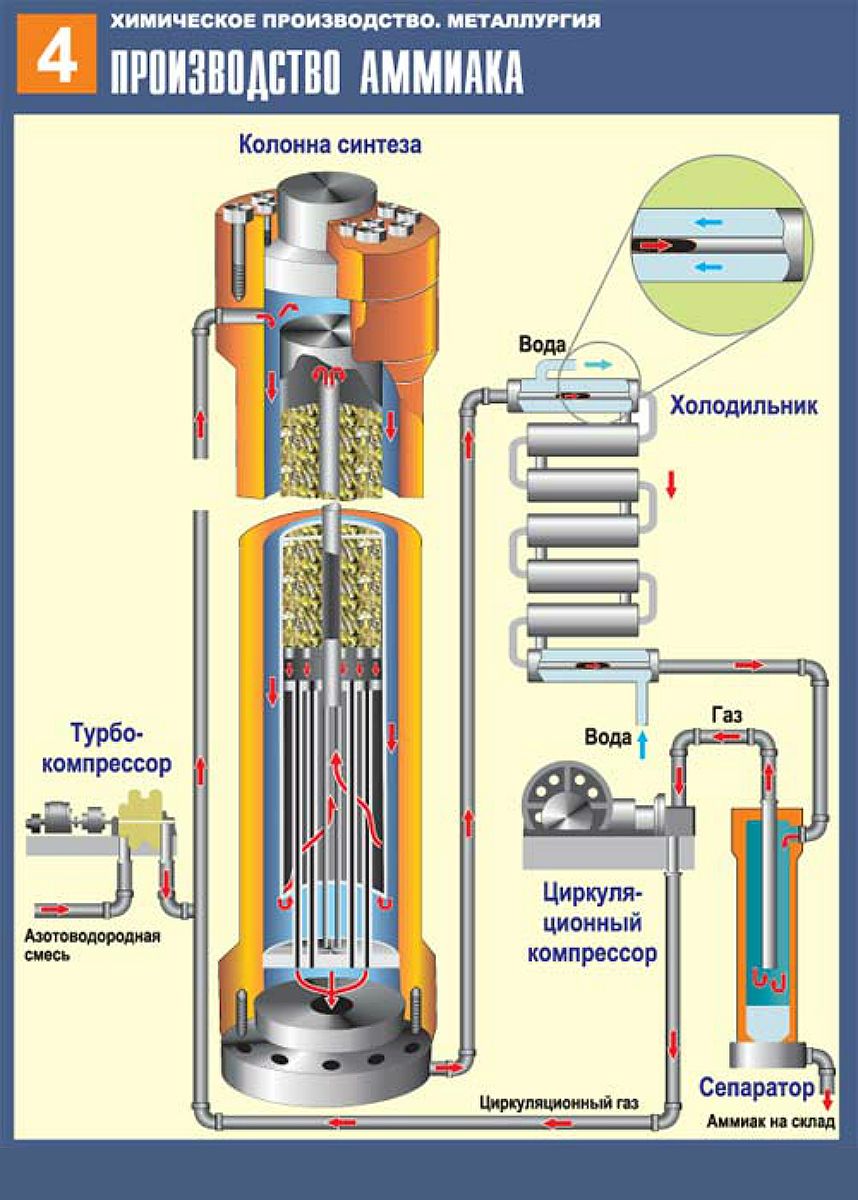 Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 «Горение аммиака»
Тренажёр №2 «Химические свойства аммиака»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Азотная промышленность сегодня — одна из ведущих отраслей.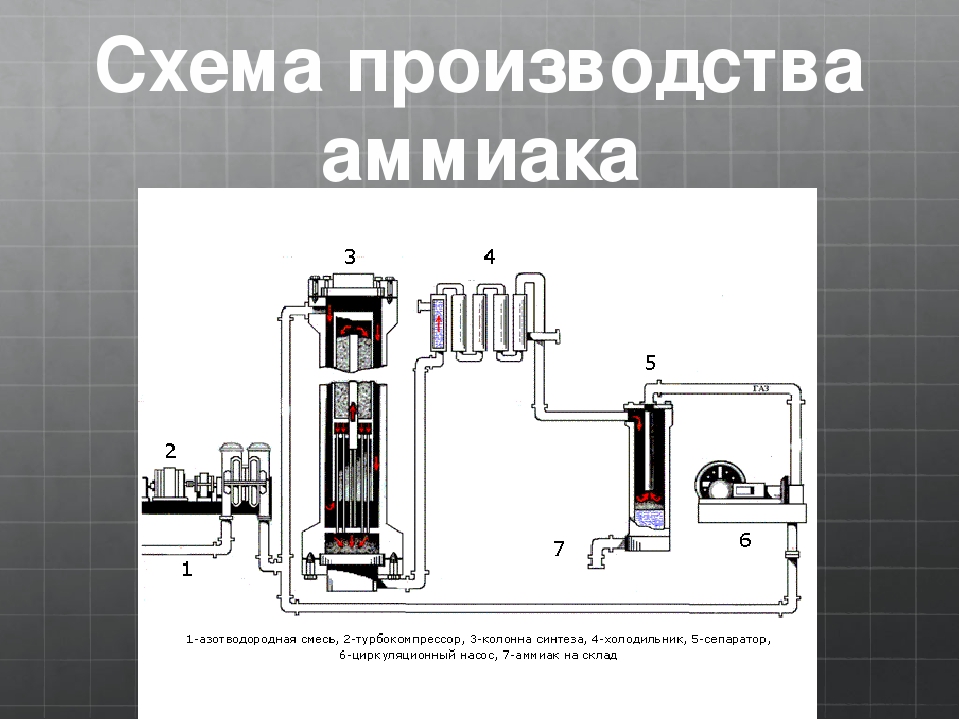 Применение аммиака распространилось на холодильную технику (R717, медицину или сельское хозяйство (удобрения).
Применение аммиака распространилось на холодильную технику (R717, медицину или сельское хозяйство (удобрения).
Первостепенное внимание уделяется именно производству азотных удобрений (а значит — и их основам, в том числе аммиаку, спрос на который вырос за последние два десятилетия на 20%).
Но производство аммиака отличается, в первую очередь, высокой энергоемкостью. Вся история этого производства — борьба за понижение используемых энергий (механической, тепловой, электрической).
Синтез аммиака раскрывает формула:
N2 + 3h3 = 2Nh4 + Q
Реакция экзотермическая, обратимая, с уменьшением объема. Поскольку реакция экзотермическая, понижение температуры сместит равновесие к образованию аммиака, однако значительно снизится. Производство аммиака должно идти при высоких температурах (синтез проходит при 500 градусах Цельсия). Повышение t° приведет к Давление от 15 до 100 Мпа позволяет противодействовать влиянию температуры (низкое давление — от 10 до 15 Мпа, среднее давление — от 25 до 30 Мпа, высокое давление — свыше 50 МПа). Из них предпочтительнее среднее.
Из них предпочтительнее среднее.
Катализатором служит с добавками кальция, кремния, калия, оксидов алюминия.
Вредные примеси вода, сероводород) отрицательно сказываются на скорости течения реакции, отравляя катализатор, снижая тем самым его активность и уменьшая сроки службы. Это означает, что сероводородная смесь должна обязательно пройти тщательную очистку. Но даже после очистки в аммиак превращается лишь часть этой смеси. Поэтому оставшуюся непрореагировавшую долю вновь отправляют в реактор.
Как происходит производство аммиака?
В трубопровод подают уже подготовленную смесь из трех частей водорода и одной азота. Она проходит через турбокомпрессор, где сжимается до указанного выше давления, и направляется в колонну синтеза с катализатором на встроенных полках. Процесс, как мы выяснили, сильно экзотермический. Выделяющимся теплом нагревается азотоводородная смесь. Из колонны выходит около 25 процентов аммиака и непрореагировавшие азот с водородом. Весь состав поступает в холодильник, где смесь охлаждается. Аммиак под давлением становится жидким. Теперь в работу вступает сепаратор, задача которого — отделить аммиак в сборник в нижней части и непрореагировавшую смесь, которая возвращается обратно в колонну. Благодаря такой циркуляции азотоводородная смесь используется на 95 процентов. Жидкий аммиак по аммиакопроводу поступает на специальный склад.
Аммиак под давлением становится жидким. Теперь в работу вступает сепаратор, задача которого — отделить аммиак в сборник в нижней части и непрореагировавшую смесь, которая возвращается обратно в колонну. Благодаря такой циркуляции азотоводородная смесь используется на 95 процентов. Жидкий аммиак по аммиакопроводу поступает на специальный склад.
Все аппараты, использующиеся в производстве, максимально герметичны, что исключает утечку. Используется лишь энергия происходящих внутри экзотермических реакций. Схема замкнутая, малоотходная. Затраты снижены благодаря непрерывному и автоматизированному процессу.
Производство аммиака не может не влиять на окружающую среду. Неизбежны газовые выбросы, включающие в себя аммиак, оксиды углерода и азота и прочие примеси. Выделяется низкопотенциальная теплота. Сбрасывается вода после промывки систем охлаждения и самого реактора.
Поэтому в производство аммиака необходимо включать каталитическую очистку с наличием газа-восстановителя. Снижения количества сточных вод можно добиться заменой на турбокомпрессоры. Низкопотенциальная теплота может быть утилизирована вводом теплоты высокопотенциальной. Однако это увеличит загрязненность дымовыми газами.
Снижения количества сточных вод можно добиться заменой на турбокомпрессоры. Низкопотенциальная теплота может быть утилизирована вводом теплоты высокопотенциальной. Однако это увеличит загрязненность дымовыми газами.
Энерготехнологическая схема, включающая парогазовый цикл, где используются как тепло пара, так и продукты сгорания топлива, одновременно и повысит эффективность производства, и уменьшит выбросы.
Еженедельный обзор природного газа
В новостях:
Производство аммиака в США растет и становится менее углеродоемким
В глобальном масштабе производство аммиака является углеродоемким процессом, и 98% заводов по производству аммиака во всем мире используют ископаемое топливо в качестве сырья, в основном природный газ (72%) и уголь (22%). В производстве аммиака в США, третьем по величине в мире после Китая и России, преобладают менее углеродоемкие предприятия по производству аммиака, работающие на природном газе, на долю которых приходится 92% всего урана.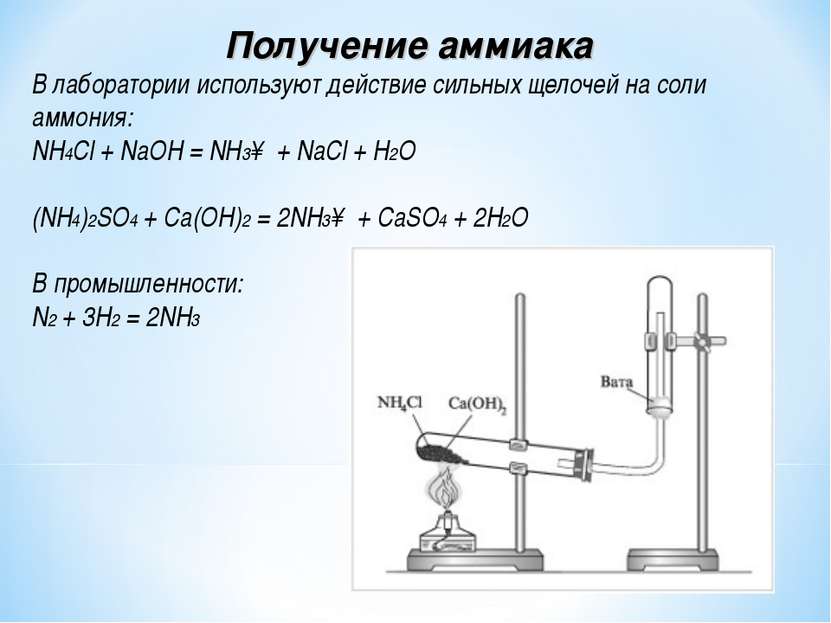 S. Производство аммиака. Недавнее расширение мощностей по производству аммиака в США, которое было вызвано ростом добычи природного газа и, как следствие, низкими ценами на природный газ, позволило отрасли расширить внутреннее производство аммиака, сохранив при этом тенденцию к снижению углеродоемкости.
S. Производство аммиака. Недавнее расширение мощностей по производству аммиака в США, которое было вызвано ростом добычи природного газа и, как следствие, низкими ценами на природный газ, позволило отрасли расширить внутреннее производство аммиака, сохранив при этом тенденцию к снижению углеродоемкости.
Рост производства аммиака и его снижение углеродоемкости соответствуют более широким глобальным целям перехода от топлива на основе углерода. Стремясь обезуглерожить свою экономику, страны всего мира ищут водород в качестве энергоносителя, который заменит природный газ там, где потребности в тепле или сырье не могут быть удовлетворены с помощью биотоплива или электроэнергии.Однако водород создает проблемы, поскольку для его хранения требуется чрезвычайно высокое давление (5000 фунтов на квадратный дюйм или выше) или криогенные температуры (ниже -423 ° F), а для транспортировки трубопроводы из специальной стали. Последние достижения в технологии двигателей и турбин могут привести к использованию аммиака в качестве носителя водорода, потреблению аммиака либо непосредственно для сжигания, либо его реформингу обратно в азот и водород и использованию водорода в качестве промышленного сырья.
В отличие от водорода, аммиак обладает преимуществами существующей широкой базы пользователей и хорошо развитой инфраструктуры.В Соединенных Штатах аммиак используется в основном как удобрение или как сырье при производстве удобрений (например, мочевины), но его использование в химической промышленности растет. Аммиак производится на 32 заводах в 17 штатах и доставляется по стране по трубопроводам, железным дорогам, баржам и грузовикам. Согласно данным Геологической службы США, производство аммиака в США растет с 2015 года, увеличившись на 46% с 11,6 миллионов метрических тонн в год (мт / год) до 17,0 миллионов метрических тонн в год в 2020 году. Поскольку рост внутреннего производства опережает рост спроса, U.Зависимость С. от импортного аммиака снизилась с 40% в 2010 году до 13% в 2020 году.
Чтобы аммиак служил носителем водорода в декарбонизированной экономике, производство аммиака должно стать углеродно-нейтральным. Процесс Габера-Боша, в котором используется водород, полученный при паровой конверсии метана, и азот из воздуха, остается доминирующим методом производства аммиака.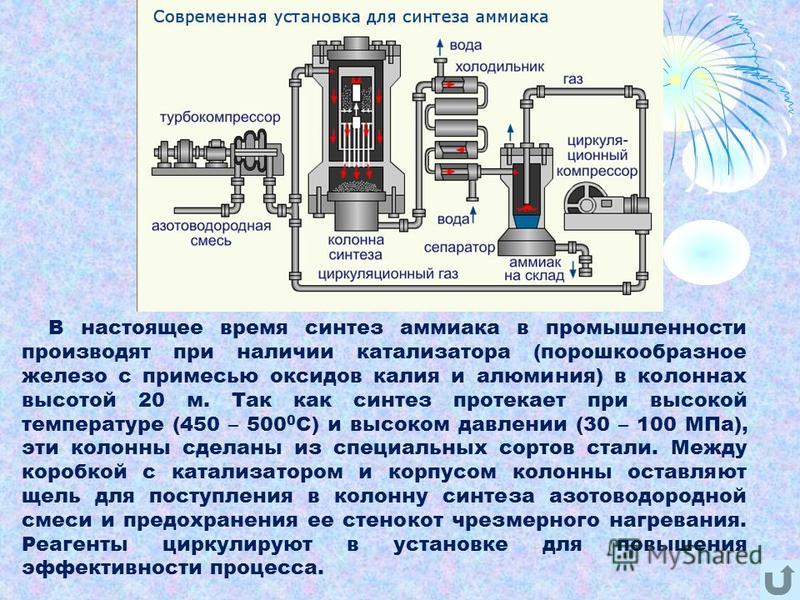 Аммиак, произведенный из природного газа, является основным источником производства аммиака в США, и на производство аммиака приходилось примерно 1,5 миллиарда кубических футов в день (Bcf / d) 6.5% всего промышленного потребления природного газа в США в 2020 году. Хотя уровень выбросов в США чище по сравнению со средним мировым показателем, он составляет около 2,1 тонны углекислого газа на каждую тонну произведенного аммиака, включая выбросы от сжигания природного газа в технологических процессах. тепло и от его использования в качестве сырья в паровой установке риформинга метана.
Аммиак, произведенный из природного газа, является основным источником производства аммиака в США, и на производство аммиака приходилось примерно 1,5 миллиарда кубических футов в день (Bcf / d) 6.5% всего промышленного потребления природного газа в США в 2020 году. Хотя уровень выбросов в США чище по сравнению со средним мировым показателем, он составляет около 2,1 тонны углекислого газа на каждую тонну произведенного аммиака, включая выбросы от сжигания природного газа в технологических процессах. тепло и от его использования в качестве сырья в паровой установке риформинга метана.
Чтобы полностью избежать выбросов углерода, завод должен либо изолировать углекислый газ, в результате чего образуется аммиак синий , либо использовать водород, полученный электролизом воды с использованием возобновляемой электроэнергии, который называется аммиаком зеленый .В настоящее время в Соединенных Штатах есть только одна установка по производству голубого аммиака, угольная компания Dakota Gasification Co. в Беуле, Северная Дакота, которая улавливает и улавливает выбросы углекислого газа, направляя его по трубопроводу на близлежащие нефтяные месторождения для повышения нефтеотдачи.
в Беуле, Северная Дакота, которая улавливает и улавливает выбросы углекислого газа, направляя его по трубопроводу на близлежащие нефтяные месторождения для повышения нефтеотдачи.
На новейшем заводе по производству аммиака в США, заводе Yara / BASF во Фрипорте, штат Техас, строительство которого было завершено в апреле 2018 года, не используется установка парового риформинга метана для подачи водорода для процесса Габера-Боша. Вместо этого он использует излишки водорода из соседних нефтехимических предприятий, таких как установки дегидрирования пропана (PDH) или установки для крекинга этилена, которые обычно сжигают водород для получения технологического тепла.
CF Industries, крупнейший производитель аммиака в стране, планирует построить первый в США завод по производству зеленого аммиака в Дональдсонвилле, штат Луизиана. К 2023 году новый завод будет производить 20 000 т аммиака в год, используя водород, полученный электролизом воды с использованием электроэнергии из возобновляемых источников.
Обзор:
(для недели, закончившейся в среду, 24 марта 2021 г.)
- Спотовые цены на природный газ выросли в большинстве регионов на этой отчетной неделе (со среды, 24 марта по среду, 31 марта).Спотовая цена Henry Hub выросла с 2,45 доллара за миллион британских тепловых единиц (MMBtu) в прошлую среду до 2,49 доллара за MMBtu вчера.
- На Нью-Йоркской товарной бирже (NYMEX) контракт в апреле 2021 года истек в понедельник по цене 2,586 доллара за миллион БТЕ, что на 7 центов за миллион БТЕ по сравнению с прошлой средой. Цена контракта в мае 2021 года увеличилась до $ 2,608 / MMBtu, на 4 ¢ / MMBtu с прошлой среды по вчерашний день. Цена 12-месячной полосы фьючерсных контрактов в среднем с мая 2021 по апрель 2022 года поднялась на 4 цента за миллион БТЕ до 2,782 доллара за миллион БТЕ.
- Чистые закачки в рабочий газ за неделю, закончившуюся 26 марта, составили 14 миллиардов кубических футов (Bcf). Рабочие запасы природного газа составили 1764 Bcf, что на 11% ниже уровня прошлого года и на 2% ниже, чем за пять лет.
 (2016–2021 гг.) В среднем за эту неделю.
(2016–2021 гг.) В среднем за эту неделю. - Сводная цена жидких углеводородов на заводе природного газа (NGPL) в Мон-Бельвье, штат Техас, выросла на 5 центов за миллион БТЕ, составив в среднем 7,51 доллара за миллион БТЕ за неделю, закончившуюся 31 марта. Цены на NGPL двигались в узком диапазоне.Цены на природный бензин, этан, пропан и бутан выросли на 1%. Цена на изобутан оставалась неизменной неделю за неделей.
- По данным Baker Hughes, за неделю, закончившуюся вторник, 23 марта, количество буровых установок на природном газе осталось неизменным и составило 92. Количество нефтесервисных буровых установок выросло на 6 до 324. Количество нефтесервисных буровых установок за последнюю неделю Март был на 144 выше, чем за последнюю неделю июля 2020 года. Это увеличение согласуется с ростом цен на сырую нефть, которые выросли в среднем с 42 долларов.83 за баррель в июле 2020 года до в среднем 66,65 доллара за баррель в марте 2021 года. В Пермском бассейне наблюдался самый сильный рост количества буровых установок, который вырос на 5 в последнюю неделю марта.
 Общее количество буровых установок увеличилось на 6 и теперь составляет 417.
Общее количество буровых установок увеличилось на 6 и теперь составляет 417.
дополнительные сводные данные
Цены / предложение / спрос:
Цены на большинстве рынков немного повышаются каждую неделю из-за неоднозначной погоды в стране . Спотовая цена Henry Hub изменилась незначительно в течение отчетной недели (среда, 24 марта, по среду, 31 марта), поднявшись на 4 цента за миллион британских тепловых единиц (MMBtu) с 2 долларов.45 / MMBtu в прошлую среду до 2,49 / MMBtu вчера после достижения максимума в 2,51 $ / MMBtu в понедельник.
Цены на Северо-Западе выросли на . Устойчивые температуры ниже нормы во всем регионе привели к повышению спроса и цен. На пограничном переходе Сумас, основном пункте доставки природного газа на Северо-Запад, цена выросла на 26 центов за миллион БТЕ с 2,30 доллара за миллион БТЕ в прошлую среду до 2,56 доллара за миллион БТЕ вчера. Температура в Сиэтле оставалась на уровне середины 40 градусов, что в среднем было на 5 градусов по Фаренгейту ниже нормы.
Тенденция к похолоданию в районе Великих озер привела к повышению цен на Среднем Западе в конце отчетной недели . Температура на Среднем Западе вчера резко упала, оставаясь значительно выше нормы в течение большей части отчетной недели. Вчерашняя температура в Чикаго упала до 39 градусов по Фаренгейту, что на 4 градуса ниже нормы, со среднего значения 59 градусов по Фаренгейту (на 16 градусов выше нормы) во вторник. Средняя региональная цена Natural Gas Intelligence на Среднем Западе оставалась относительно неизменной на протяжении большей части недели, колеблясь в пределах 6 центов за миллион БТЕ по сравнению с ценой в 2 доллара в прошлую среду.32 / MMBtu. Региональная цена на Среднем Западе упала до минимума в 2,30 доллара за миллион БТЕ в прошлую пятницу и выросла до 2,38 доллара за миллион БТЕ во вторник, а вчера резко выросла до 2,51 доллара за миллион БТЕ. На Chicago Citygate цена выросла на 21 цент с 2,34 доллара за миллион БТЕ в прошлую среду до 2,55 доллара за миллион БТЕ вчера с минимумом в 2,30 доллара за миллион БТЕ в пятницу.
Цены в Калифорнии немного повышаются, поскольку ограничения, связанные с техническим обслуживанием трубопроводов, остаются . Температуры по всей Калифорнии поднялись выше нормы за неделю, снизив спрос на отопление по сравнению с предыдущей неделей, когда на обоих основных рынках Калифорнии были зарегистрированы температуры ниже нормы.Продолжение технического обслуживания на компрессорной станции Бетани возле района залива, на линии 400 системы PG&E, снизило потоки по трубопроводу до 69% от нормальной мощности и ограничило отбор из хранилищ вдоль трассы трубопровода. Цена на PG&E Citygate в Северной Калифорнии выросла на 2 цента, с 3,62 доллара за миллион БТЕ в прошлую среду до 3,64 доллара за миллион БТЕ вчера, после достижения недельного минимума в 3,59 доллара в пятницу. Цена в SoCal Citygate в Южной Калифорнии выросла на 3 цента с 2,97 доллара за миллион БТЕ в прошлую среду до 3 долларов.00 / MMBtu вчера после падения до $ 2,61 / MMBtu в понедельник.
Прогноз более низких температур до конца недели приводит к росту цен на северо-востоке . В торговом центре Algonquin Citygate, который обслуживает потребителей в районе Бостона, цена выросла на 61 цент с 1,93 доллара за миллион БТЕ в прошлую среду до 2,54 доллара за миллион БТЕ вчера. В торговой точке Трансконтинентальной трубопроводной зоны 6 в Нью-Йорке цена выросла на 64 цента с 1,79 доллара за миллион БТЕ в прошлую среду до 2,43 доллара за миллион БТЕ вчера. В обоих ценовых пунктах в пятницу были зафиксированы самые низкие цены за отчетную неделю — 1 доллар.80 / MMBtu и $ 1,61 / MMBtu, соответственно.
В торговом центре Algonquin Citygate, который обслуживает потребителей в районе Бостона, цена выросла на 61 цент с 1,93 доллара за миллион БТЕ в прошлую среду до 2,54 доллара за миллион БТЕ вчера. В торговой точке Трансконтинентальной трубопроводной зоны 6 в Нью-Йорке цена выросла на 64 цента с 1,79 доллара за миллион БТЕ в прошлую среду до 2,43 доллара за миллион БТЕ вчера. В обоих ценовых пунктах в пятницу были зафиксированы самые низкие цены за отчетную неделю — 1 доллар.80 / MMBtu и $ 1,61 / MMBtu, соответственно.
Цены в добывающем регионе Аппалачского бассейна также растут, чему способствовал ожидаемый рост спроса на северо-востоке . Спотовая цена Marcellus в Зоне 4 в Теннесси увеличилась на 31 цент с 1,68 доллара за миллион БТЕ в прошлую среду до 1,99 доллара за миллион БТЕ вчера. Цена на Dominion South на юго-западе Пенсильвании выросла на 37 центов с 1,75 доллара за миллион БТЕ в прошлую среду до 2,12 доллара за миллион БТЕ вчера. Отражая ту же тенденцию, что и цены в северо-восточном регионе спроса, цены в обоих центрах упали до недельного минимума в пятницу до 1 доллара.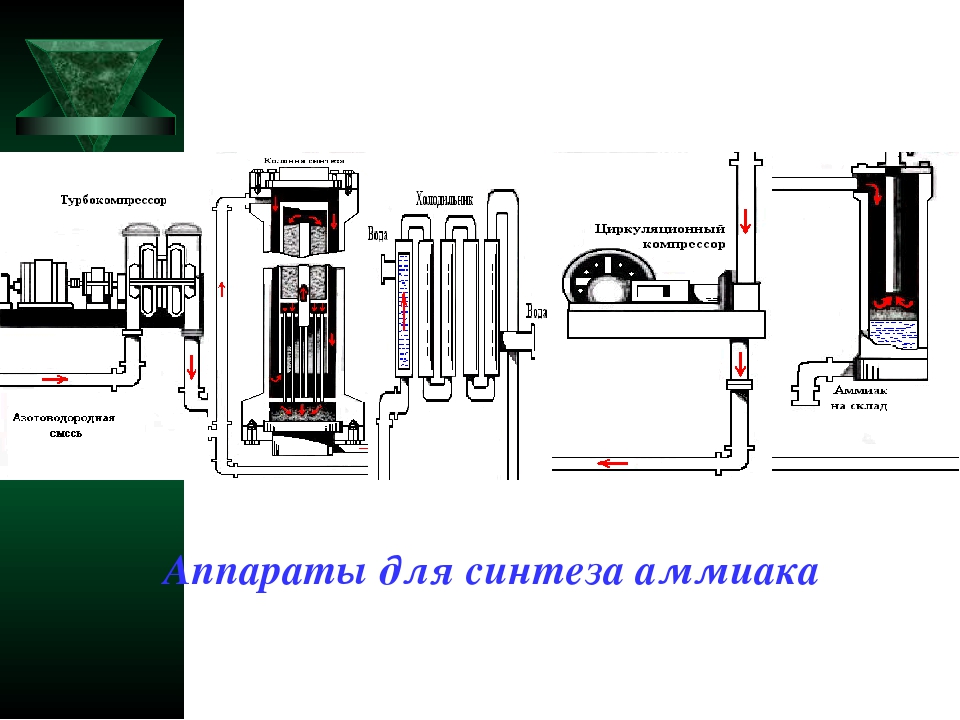 40 / MMBtu в зоне 4 Теннесси и 1,70 $ / MMBtu в Dominion South.
40 / MMBtu в зоне 4 Теннесси и 1,70 $ / MMBtu в Dominion South.
Цены в производственном регионе Перми незначительно снижаются, противодействуя общенациональной тенденции роста цен в этом отчете за неделю . IHS Markit сообщает, что средняя недельная добыча в Западном Техасе продолжает расти, впервые со второй недели февраля превысив примерно 8,5 миллиардов кубических футов в день (Bcf / d). Растущие цены на сырую нефть поддерживают деятельность по бурению в Перми, так как количество нефтесервисных буровых установок в Пермском бассейне растет.Рост направленной активности на сырую нефть, в свою очередь, поддерживает рост добычи природного газа, в результате чего цена в Waha Hub в Западном Техасе упала на 3 цента за миллион БТЕ на этой отчетной неделе, с 2,31 доллара за миллион БТЕ в прошлую среду до 2,28 доллара за миллион БТЕ вчера. Дисконт между ценами на природный газ Waha Hub и Henry Hub увеличился с 14 центов за прошлую среду до 21 за миллион БТЕ вчера.
Производство в США незначительно увеличивается по сравнению с неделей . По данным IHS Markit, средний общий объем поставок природного газа упал на 0.1% по сравнению с предыдущей отчетной неделей. Добыча сухого природного газа выросла на 0,2% по сравнению с предыдущей отчетной неделей, достигнув в среднем 91,3 млрд куб. Футов в сутки, что примерно на 2,0 млрд куб. Футов в сутки ниже, чем в это время в прошлом году. Средний чистый импорт из Канады снизился на 6,7% по сравнению с прошлой неделей.
По данным IHS Markit, средний общий объем поставок природного газа упал на 0.1% по сравнению с предыдущей отчетной неделей. Добыча сухого природного газа выросла на 0,2% по сравнению с предыдущей отчетной неделей, достигнув в среднем 91,3 млрд куб. Футов в сутки, что примерно на 2,0 млрд куб. Футов в сутки ниже, чем в это время в прошлом году. Средний чистый импорт из Канады снизился на 6,7% по сравнению с прошлой неделей.
Спрос в США снова падает неделя за неделей из-за умеренных температур . Согласно данным IHS Markit, общее потребление природного газа в США упало на 6,0% по сравнению с предыдущей отчетной неделей. Увеличилось потребление природного газа на производство электроэнергии 1.4% неделя за неделей. Потребление в промышленном секторе за неделю снизилось на 1,9%. Наибольшее снижение потребления произошло в жилом и коммерческом секторах, где потребление снизилось на 17,1% из-за температуры выше среднего и низкого спроса на отопление в восточной части Соединенных Штатов на протяжении большей части прошлой отчетной недели. Экспорт природного газа в Мексику увеличился на 2,6%. Поставки природного газа на предприятия по экспорту сжиженного природного газа (СПГ) в США (поступления по трубопроводам СПГ) не изменились по сравнению с уровнем 11 на прошлой неделе.6 млрд куб. Футов / сут.
Экспорт природного газа в Мексику увеличился на 2,6%. Поставки природного газа на предприятия по экспорту сжиженного природного газа (СПГ) в США (поступления по трубопроводам СПГ) не изменились по сравнению с уровнем 11 на прошлой неделе.6 млрд куб. Футов / сут.
Экспорт СПГ из США увеличился по сравнению с неделей . Между 25 и 31 марта 2021 г., согласно данным отгрузки, предоставленным Bloomberg Finance, LP
.Хранение:
Чистые вливания в хранилища составили 14 млрд куб. Футов за неделю, закончившуюся 26 марта, по сравнению со средним чистым изъятием за пять лет (2016–2021) в размере 24 млрд куб. Футов и чистым изъятием в прошлом году в размере 20 млрд куб. Футов за ту же неделю.Текущие запасы природного газа составили 1 764 млрд куб. Футов, что на 36 млрд куб. Футов ниже, чем в среднем за пять лет, и на 225 млрд куб. Футов ниже, чем в прошлом году на данный момент.
Согласно опросу аналитиков природного газа The Desk , оценки еженедельного чистого изменения рабочих запасов природного газа варьировались от чистых закачек в 11 млрд куб. Футов до 41 млрд куб. Футов при средней оценке 21 млрд куб. Футов.
Футов до 41 млрд куб. Футов при средней оценке 21 млрд куб. Футов.
Дополнительные данные о хранении и анализ можно найти на панели инструментов по хранению природного газа и в еженедельном отчете по хранению природного газа .
См. Также:
Аммиачная промышленность
В конце 2018 года компанияFertilizers Europe опубликовала важный отчет, в котором исследуются ключевые факторы развития индустрии удобрений и описываются «вероятные события, ожидаемые в период до 2030 года». Эти разработки включают производство «возможно 10%» европейского аммиака из возобновляемой электроэнергии с использованием электролизеров для производства возобновляемого водородного сырья. Это потребует увеличения мощностей по производству зеленого аммиака до более чем миллиона тонн в год в течение десяти лет.
В отчете Feeding Life 2030 также описывается политическая основа, необходимая для «поддержания Видения». В этом видении аммиак находится «на перекрестке питания и энергии» и признан «недостающим звеном» в грядущей трансформации энергии ».
Подробнее
Один из самых интересных вопросов, оставшихся без ответа, относительно зеленого аммиака: а как насчет мочевины?
В прошлом месяце крупное заявление компании Stamicarbon («мирового лидера в области проектирования, лицензирования и разработки установок по производству карбамида») подразумевает ответ: в долгосрочном контексте изменения климата использование мочевины в качестве удобрения может быть просто поэтапным. вне.
Stamicarbon объявил о своей новой программе инноваций на мероприятии «День будущего» в Утрехте в апреле. Его инновационная программа охватывает три области: специальные удобрения, цифровизация и «Возобновляемое производство удобрений (с использованием энергии ветра или солнца для производства удобрений)».
Подробнее
Haldor Topsoe значительно улучшил краткосрочные перспективы экологически чистого аммиака, объявив о демонстрации своей установки синтеза аммиака нового поколения.В этой технологии используется твердооксидная электролизная ячейка для производства синтез-газа (водорода и азота), который питает существующую технологию Haldor Topsoe: завод Haber-Bosch.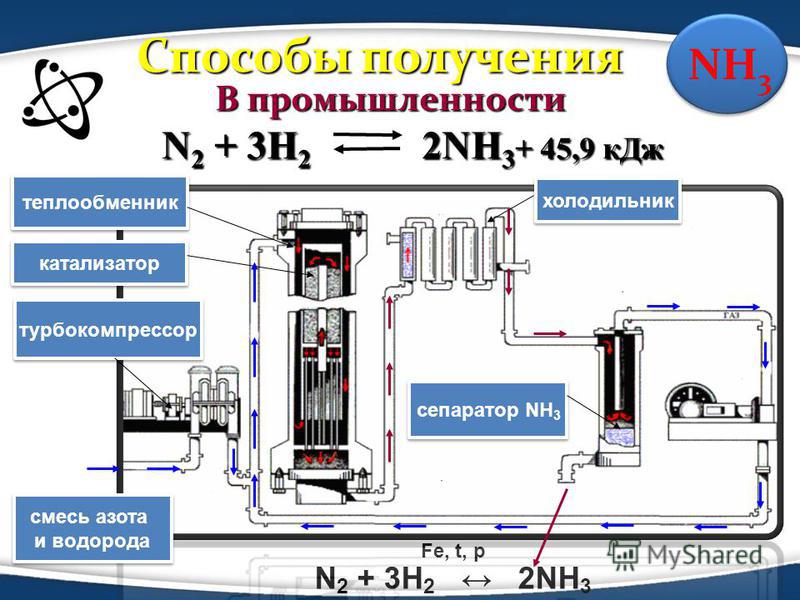 Продукт представляет собой аммиак, полученный из воздуха, воды и возобновляемой электроэнергии.
Продукт представляет собой аммиак, полученный из воздуха, воды и возобновляемой электроэнергии.
Проект «SOC4Nh4» недавно получил финансирование от Датского энергетического агентства, что позволило Haldor Topsoe продемонстрировать систему со своими академическими партнерами и подготовить технико-экономическое обоснование для небольшой экспериментальной установки по производству зеленого аммиака в промышленных масштабах, которую она надеется построить. к 2025 г.У этой технологии есть два аспекта, которые делают ее настолько важной: надежность и эффективность.
Подробнее
На этой неделе Yara объявила о значительном прогрессе в производстве «зеленого аммиака» на своем заводе в Пилбаре, Австралия. Его новым партнером в этом проекте является ENGIE, глобальная группа по энергетике и услугам, которая в прошлом году взяла на себя серьезное обязательство по развитию крупномасштабных проектов по возобновляемым водородам.
Я впервые сообщил о планах Yara по демонстрации солнечного аммиака на заводе Pilbara в сентябре 2017 года. Объявление на этой неделе означает, что проект Pilbara перешел на следующий этап технико-экономического обоснования. Тем не менее, основные элементы проекта уже были спроектированы и построены: во время планового ремонта в прошлом году для технического обслуживания завода была завершена врезка водородного трубопровода, а это означает, что установка Haber-Bosch готова напрямую получать водород, как только Электролизер построен для обеспечения его возобновляемым сырьем.
Объявление на этой неделе означает, что проект Pilbara перешел на следующий этап технико-экономического обоснования. Тем не менее, основные элементы проекта уже были спроектированы и построены: во время планового ремонта в прошлом году для технического обслуживания завода была завершена врезка водородного трубопровода, а это означает, что установка Haber-Bosch готова напрямую получать водород, как только Электролизер построен для обеспечения его возобновляемым сырьем.
Подробнее
В прошлом году компания Yara Sluiskil в Нидерландах модернизировала свой существующий завод по производству аммиака, подключив водородный трубопровод, тем самым снизив свою зависимость от ископаемого топлива.Трубопровод был введен в эксплуатацию в октябре 2018 года и теперь «обеспечивает эффективную и безопасную транспортировку водорода», который ранее был отходом на близлежащей установке крекинга этилена Dow. Уже сейчас проект «обеспечивает сокращение выбросов CO2 на 10 000 тонн» и снижение энергопотребления на «0,15 петаджоулей (ПДж) в год».
Это, возможно, первая модернизация установки по декарбонизации аммиака, и она показывает, что сегодня возможно и доступно сократить выбросы от существующих заводов по производству аммиака.
Подробнее
Миссия осуществима. В крупном отчете , опубликованном в конце 2018 года, делается вывод о том, что декарбонизация производства аммиака к 2050 году технически и экономически осуществима. Среди 172 страниц предположений, анализа и объяснений, Mission Possible исследует пути производства и рынки зеленого аммиака и его производных зеленых азотных удобрений. В нем рассматривается относительно простой вопрос о том, как заменить ископаемое сырье возобновляемым водородом для синтеза аммиака, а также более сложный вопрос о том, как получить или заменить молекулы диоксида углерода, содержащиеся в мочевине, наиболее распространенном азотном удобрении.
Экономические выводы отчета не удивят никого, кто занимается производством аммиака или политикой. Да, зеленый аммиак в настоящее время дороже ископаемого аммиака, хотя это ненадолго. И нет, «ни одно из повышений цен для конечных потребителей не является достаточно большим, чтобы служить аргументом против жесткой политики, направленной на декарбонизацию».
Да, зеленый аммиак в настоящее время дороже ископаемого аммиака, хотя это ненадолго. И нет, «ни одно из повышений цен для конечных потребителей не является достаточно большим, чтобы служить аргументом против жесткой политики, направленной на декарбонизацию».
Подробнее
В конце 2018 года JGC Corporation выпустила пресс-релиз, посвященный «первому в мире» производству аммиака, продемонстрировав на своей пилотной установке в Корияме как «синтез аммиака с водородом, полученным путем электролиза воды с использованием возобновляемых источников энергии, так и производство электроэнергии. через газовые турбины, работающие на синтезированном аммиаке.«
Демонстрируя возможность использования аммиака по обе стороны уравнения возобновляемой энергии — во-первых, производство зеленого аммиака из периодически возобновляемых источников электроэнергии и, во-вторых, сжигание этого безуглеродного топлива для производства электроэнергии — проект демонстрирует роль аммиака в «создание энергетической цепочки .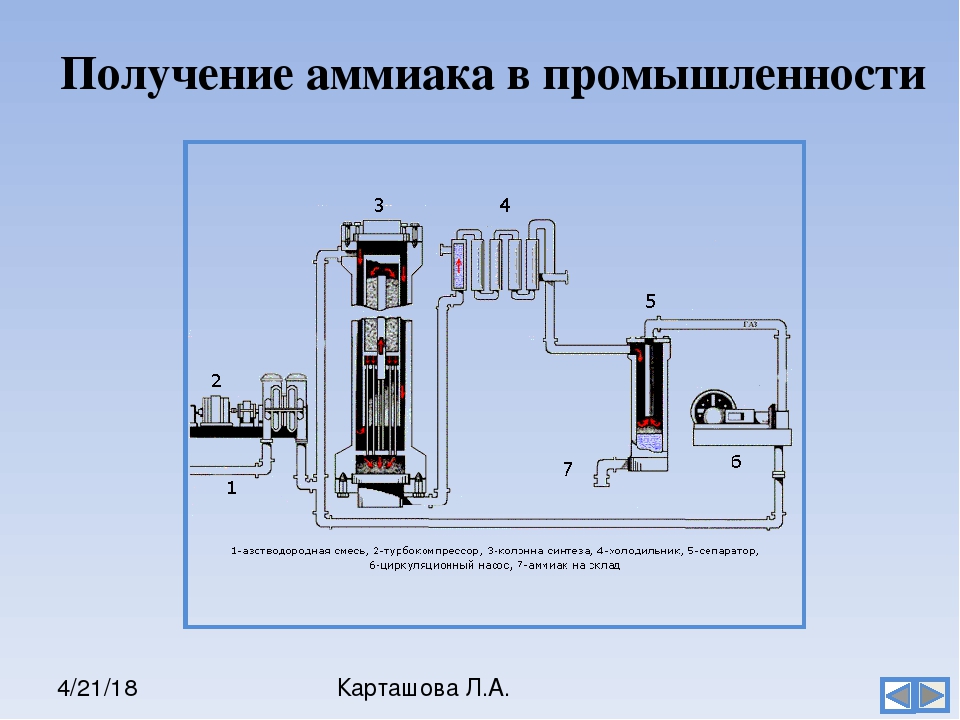 .. которая не выделяет CO2 (без CO2) от производства до производства электроэнергии».
.. которая не выделяет CO2 (без CO2) от производства до производства электроэнергии».
Подробнее
ЭТО ОБНОВЛЕНИЕ ДОСТУПНО ТОЛЬКО ДЛЯ ЧЛЕНОВ САЙТА
В августе 2018 года агентство Reuters сообщило, что дешевый природный газ способствует расширению отрасли по всей Альберте, и сообщило, что CF Industries увеличивает производство аммиака на своем заводе в Medicine Hat.
Подробнее
ЭТО ОБНОВЛЕНИЕ ДОСТУПНО ТОЛЬКО ДЛЯ ЧЛЕНОВ САЙТА
Cronus Chemicals заключила EPC-контракт на строительство завода по производству аммиака 2300 метрических тонн в день в Тусколе, штат Иллинойс.
Подробнее
Движение к мелкомасштабному производству аммиака ускоряется по двум причинам. Во-первых, небольшие аммиачные заводы гибки. И, во-вторых, небольшие аммиачные заводы гибки.
Они обладают гибкостью в отношении исходного сырья, что означает, что они могут использовать небольшие количества малоценных или неокупаемых ресурсов, которые широко доступны в местном масштабе. Это включает сжигаемый природный газ, свалочный газ или энергию ветра.
Это включает сжигаемый природный газ, свалочный газ или энергию ветра.
И они гибкие на рынке, что означает, что они могут обслуживать различные местные потребности, продавая такие продукты, как удобрения, накопители энергии или топливо; или такие услуги, как независимость от ресурсов, стабильность цен или надежность цепочки поставок.
Хотя масштабы этих заводов невелики, влияние этой технологии велико. Как поясняло отраслевое инсайдерское издание Nitrogen + Syngas в своем последнем выпуске, «по мере того, как производство аммиака движется в сторону более экологичных и возобновляемых видов сырья, рынок аммиака сталкивается с потенциально радикальными изменениями.«
Подробнее
На этой неделе DNV GL опубликовала свой годовой прогноз Energy Transition Outlook , содержащий долгосрочный прогноз мирового производства и потребления энергии, а также специальный отчет с описанием своего морского прогноза до 2050 года . Это первый прогноз крупного классификационного общества, в котором аммиак рассматривается как топливо для морских судов.
К 2050 году DNV GL прогнозирует, что 39% мирового энергобаланса судоходства будет состоять из «углеродно-нейтрального топлива», категории, включающей аммиак, водород, биотопливо и другие виды топлива, производимые из электроэнергии.Таким образом, к 2050 году эти виды топлива получат большую долю рынка, чем нефть, СПГ и аккумуляторные батареи. Если аммиак станет предпочтительным углеродно-нейтральным топливом в судоходном секторе, этот новый спрос будет примерно эквивалентен 200 миллионам тонн аммиака в год, что превышает сегодняшнее общее мировое производство.
Подробнее
Еще одна неделя, еще одна пилотная установка по производству зеленого аммиака.
Siemens Gamesa, крупнейший в мире производитель ветряных турбин (по установленной мощности), объявила о партнерстве с местным фондом климатических инноваций Energifonden Skive для исследования производства аммиака с помощью энергии ветра в эко-промышленном центре в долине зеленых технологий Дании.В объявлении описывается соглашение о совместном изучении экологически чистого производства аммиака как способа хранения излишков электроэнергии от ветряных турбин. Цель: создание опытного производства в GreenLab Skive ».
Цель: создание опытного производства в GreenLab Skive ».
Подробнее
На прошлой неделе OCP Group объявила о планах по разработке экологически чистого водорода и зеленого аммиака в качестве экологически безопасного сырья для использования в производстве удобрений. Это включает строительство пилотных заводов как в Германии, которая уже строится, так и в Марокко, строительство которой еще не началось, а также «возможное создание Африканского института солнечного аммиака».«
Подробнее
McKinsey & Company, глобальная консалтинговая компания, недавно опубликовала отчет, в котором анализируется «декарбонизация промышленных секторов» с акцентом на четыре основных источника выбросов: цемент, сталь, аммиак и производство этилена.
«Мы пришли к выводу, что декарбонизация технически возможна … Мы также определяем движущие силы затрат, связанных с декарбонизацией, и влияние, которое она окажет на энергетическую систему в целом». Конечно, «возникают технические и экономические препятствия», но в отчете содержится ценный анализ экономических рычагов, которые потребуются.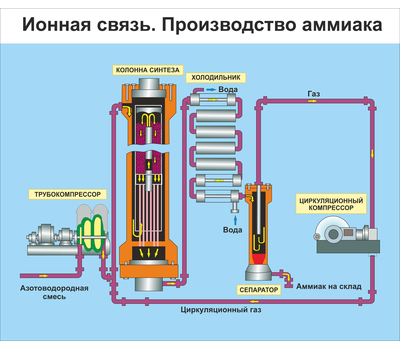
Подробнее
В июне ThyssenKrupp объявила о запуске своей технологии «продвинутого электролиза воды», которая позволяет производить безуглеродный водород из возобновляемых источников электроэнергии и воды. Эта «технология позволяет создавать экономичные водородные установки промышленного масштаба для хранения энергии и производства экологически чистых химикатов».
Две недели спустя, в начале июля, ThyssenKrupp объявила, что продвигается вперед с демонстрационным заводом в Порт-Линкольне, Южная Австралия, который был предложен ранее в этом году.Это будет «один из первых коммерческих заводов по производству« зеленого »аммиака без выбросов CO2 из периодически возобновляемых источников».
Немецкий конгломерат является одним из четырех основных лицензиаров аммиачной технологии, поэтому его действия в области устойчивого производства аммиака имеют глобальное значение.
Подробнее
Два новых пилотных проекта по производству «зеленого аммиака» из возобновляемых источников энергии уже запущены и успешно производят аммиак.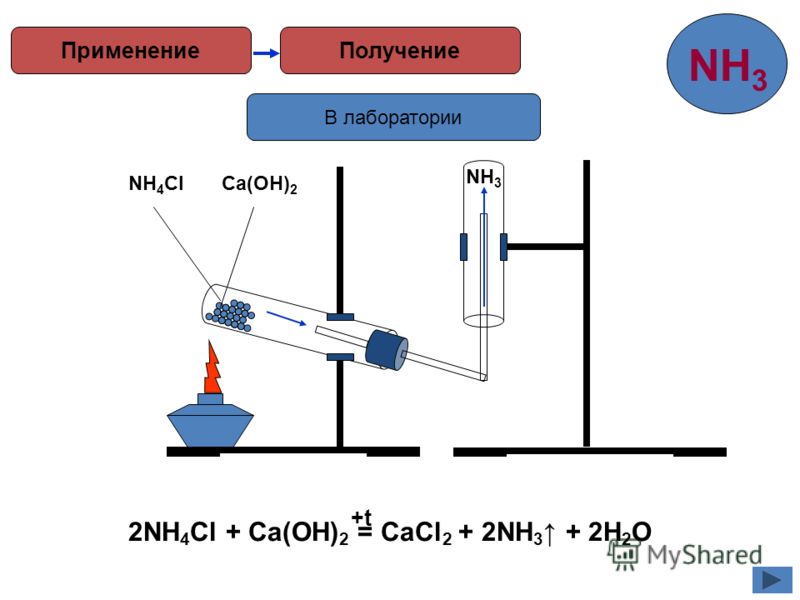
В апреле 2018 года в Институте возобновляемых источников энергии Фукусимы — AIST (FREA) в Японии была запущена экспериментальная установка по производству аммиака для возобновляемых источников энергии.Ранее на этой неделе компания Siemens начала работу на своем демонстраторе зеленого аммиака в лаборатории Резерфорда Эпплтона за пределами Оксфорда в Великобритании.
Коммерческий продукт, производимый этими заводами, — это не аммиак, а знания.
В то время как заводы FREA и Siemens имеют одинаковый масштаб, с соответствующими производственными мощностями по аммиаку 20 и 30 кг в день, у них очень разные цели. В FREA пилотный проект поддерживает разработку катализатора с целью обеспечения эффективного синтеза аммиака при низком давлении.В Siemens пилотный проект позволит получить представление об экономическом обосновании использования аммиака как гибкого для рынка вектора хранения энергии.
Подробнее
После публикации в начале 2017 года влиятельного технико-экономического обоснования производства электроэнергии из аммиака в Нидерландах было объявлено о ряде проектов по экологически чистому аммиаку. Однако, возможно, самой важной публикацией с тех пор является дорожная карта, опубликованная Советом по инновациям Северных Нидерландов. Зеленая водородная экономика в Северных Нидерландах.Его объем, включая разделы, написанные консультантами из ING, Rabobank и Accenture, выходит далеко за рамки стандартного технико-экономического анализа и представляет собой убедительный план скоординированного развития «производственных проектов, рынков, инфраструктуры и социальных вопросов».
Однако, возможно, самой важной публикацией с тех пор является дорожная карта, опубликованная Советом по инновациям Северных Нидерландов. Зеленая водородная экономика в Северных Нидерландах.Его объем, включая разделы, написанные консультантами из ING, Rabobank и Accenture, выходит далеко за рамки стандартного технико-экономического анализа и представляет собой убедительный план скоординированного развития «производственных проектов, рынков, инфраструктуры и социальных вопросов».
Зеленый аммиак широко используется в дорожной карте, которая предусматривает строительство 300000 тонн возобновляемого аммиака в год в Делфзейле к 2024 году, а также крупномасштабный импорт зеленого аммиака, начиная с 2021 года, что обеспечит низкую стоимость доставка и хранение безуглеродного топлива, крекированного до водорода, для электростанции Magnum.
Подробнее
Вторая ежегодная конференция «Электроэнергия к аммиаку», которая состоялась в начале этого месяца в Роттердаме, имела огромный успех.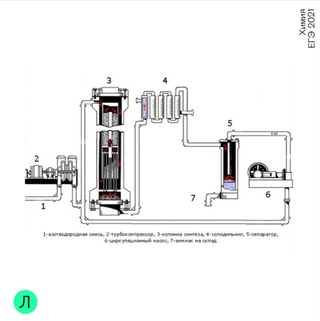 Он снова был организован Proton Ventures, голландской инженерной фирмой и пионером мини-завода по производству аммиака, и на него собралось примерно в два раза больше участников, чем в прошлом году, с таким же чрезвычайно высоким качеством презентаций (для меня всегда большая честь выступать вместе с технических волшебников и экономических новаторов, представляющих мир аммиачной энергетики).
Он снова был организован Proton Ventures, голландской инженерной фирмой и пионером мини-завода по производству аммиака, и на него собралось примерно в два раза больше участников, чем в прошлом году, с таким же чрезвычайно высоким качеством презентаций (для меня всегда большая честь выступать вместе с технических волшебников и экономических новаторов, представляющих мир аммиачной энергетики).
Однако для меня самым захватывающим событием в этом году было то, что впервые на конференции по аммиачной энергетике были представлены все четыре основных лицензиара аммиачной технологии. Благодаря тому, что Casale, Haldor Topsoe, ThyssenKrupp и KBR разрабатывают проекты для интеграции своих технологий синтеза аммиака с электролизерами, работающими на возобновляемых источниках энергии, зеленый аммиак теперь явно рассматривается как коммерческая перспектива.
Подробнее
За последние несколько лет в США были построены, перезапущены и перемещены аммиачные заводы мирового масштаба. Последний из этих мегапроектов начал свою работу в Фрипорте в Техасе в прошлом месяце. В настоящее время в США больше не строятся новые заводы по производству аммиака, и общепринятая мудрость в отрасли состоит в том, что строительство больше не начнется.
Последний из этих мегапроектов начал свою работу в Фрипорте в Техасе в прошлом месяце. В настоящее время в США больше не строятся новые заводы по производству аммиака, и общепринятая мудрость в отрасли состоит в том, что строительство больше не начнется.
Однако разработчики проектов и аммиачные стартапы не получили эту памятку. При сохранении низких цен на природный газ они не прекращают объявлять о планах строительства новых заводов. Разница в том, что следующий транш новых заводов по производству аммиака будет не в мировом масштабе, а в региональном масштабе, с производственными мощностями, составляющими, возможно, лишь одну десятую отраслевого стандарта.Несмотря на использование ископаемого сырья, эти заводы установят новые стандарты эффективности и выбросов для малых предприятий по производству аммиака и продемонстрируют новые бизнес-модели, которые в корне изменят будущий отраслевой ландшафт устойчивых аммиачных технологий.
Подробнее
Самый новый аммиачный завод на планете открылся во Фрипорте, штат Техас.
Этот аммиачный завод мирового масштаба, совместное предприятие Yara и BASF, не использует ископаемое топливо. Вместо этого он будет производить 750 000 метрических тонн аммиака в год, используя водород и азот, доставляемые непосредственно по трубопроводу.Контракт с заводом по водороду структурирован таким образом, что основным источником поставок является побочный водород, а не водород, полученный из ископаемого топлива, и поэтому завод во Фрипорте может заявить, что его аммиак имеет значительно меньший углеродный след.
Этот новый завод по производству аммиака демонстрирует три истины. Во-первых, товарный аммиак с низким содержанием углерода сегодня доступен для закупки в промышленных количествах: это не только технически осуществимо, но и экономически конкурентоспособно. Во-вторых, интенсивность углерода измеряется в оттенках серого, а не в черном и белом.Аммиак не обязательно является безуглеродным или полностью углеродным, но он имеет углеродоемкость, которая может быть определена количественно, а в экономике с ограничением выбросов углерода меньшее содержание углерода означает более высокую надбавку к цене. В-третьих, аммиачная промышленность должна улучшить свой углеродный след, прежде чем она сможет рассчитывать на вознаграждение за производство зеленого аммиака.
В-третьих, аммиачная промышленность должна улучшить свой углеродный след, прежде чем она сможет рассчитывать на вознаграждение за производство зеленого аммиака.
Подробнее
На прошлой неделе Международная морская организация (ИМО) официально приняла свою Первоначальную стратегию по выбросам парниковых газов. Это означает, что судоходная отрасль взяла на себя обязательство «сократить общие годовые выбросы парниковых газов как минимум на 50% к 2050 году» и полностью «поэтапно отказаться от них как можно скорее в этом столетии».«
Это также означает, что мировая промышленность ищет очень большое количество безуглеродного жидкого топлива с инфраструктурой производства и распределения, которая может быть расширена в течение десятилетий. Самый жизнеспособный вариант — аммиак. Сколько потребуется? Примерно один миллион тонн аммиака в сутки.
Подробнее
Шесть месяцев назад, в сентябре 2017 года, я сообщил об объявлении о создании совместного предприятия Bayer и Ginkgo Bioworks на сумму 100 миллионов долларов, целью которого является создание азотфиксирующих микробов, которые можно было бы помещать в покрытия семян и обеспечивать питательными веществами небобовые культуры. Теперь совместное предприятие названо, и Joyn Bio укомплектовывает штат. Для аммиачной промышленности это представляет собой потенциальное сокращение спроса в значительном масштабе в ближайшие десятилетия.
Теперь совместное предприятие названо, и Joyn Bio укомплектовывает штат. Для аммиачной промышленности это представляет собой потенциальное сокращение спроса в значительном масштабе в ближайшие десятилетия.
Подробнее
ОБНОВЛЕНО: 14.05.2018 — см. Журнал изменений
ВЛАДЕЛЕЦ: Greenfield Nitrogen LLC
ПРОЕКТ: Завод аммиака Greenfield
ОБЩАЯ ИНФОРМАЦИЯ: Этап финансирования
После нескольких лет спокойного развития компания Greenfield Nitrogen в марте 2018 года начала свою презентацию по финансированию и к середине мая «собрала около 40 миллионов долларов.«Если компании удастся привлечь капитал в размере 103 миллионов долларов, это будет первый завод, построенный с использованием технологии Linde Ammonia Concept (LAC) для производства аммиака в региональном масштабе.
Подробнее
ЭТО ОБНОВЛЕНИЕ ДОСТУПНО ТОЛЬКО ДЛЯ ЧЛЕНОВ САЙТА
В декабре 2017 года IFFCO Canada возобновила свою деятельность с новыми партнерами по разработке, новым дизайном и новым названием: ProjetBécancour. ag Limited Partnership. Проект, о котором впервые было объявлено в 2012 году, изначально стоил 1 доллар.2-миллиардный завод карбамида, но в настоящее время реконфигурируется как завод по производству метанола и карбамида.
ag Limited Partnership. Проект, о котором впервые было объявлено в 2012 году, изначально стоил 1 доллар.2-миллиардный завод карбамида, но в настоящее время реконфигурируется как завод по производству метанола и карбамида.
Подробнее
Ранее в этом месяце я имел удовольствие выступать на конференции Международной ассоциации удобрений (IFA) по теме «Инновации в аммиаке». Ключевым моментом было преимущество диверсификации технологий: как и в случае любого портфеля, будь то инвестиционный счет или спектр доступных технологий в глобальной отрасли, концентрация в любой области представляет собой риск, а диверсификация представляет собой устойчивость.К сожалению, определенный путь сокращения выбросов в аммиачной промышленности до 2050 года требует все большей зависимости от одной технологии и одного углеродного сырья. Это представляет значительный риск для завтрашних рынков с ограниченными выбросами углерода.
В этой статье представлены пять диаграмм, которые призваны продемонстрировать, почему в отрасли недостаточно внимания к энергоэффективности как единственной мере улучшения технологий, почему лучше оптимизировать, чем максимизировать, и почему эволюция рынка поддерживает инвестиционные решения в устойчивых технологиях синтеза аммиака. .
.
Подробнее
Синтез аммиака: процесс и реакция — стенограмма видео и урока
Процесс Габера
Процесс Габера — это промышленный процесс, в котором для синтеза аммиака используются газообразный азот и газообразный водород. Уравнение, которое представляет процесс Габера, дается следующим образом:
Получение водорода
Итак, как в процессе получается водород?
1.Электролиз воды
Как вы помните, при прохождении электрического тока через воду с использованием инертных электродов на катоде образуется водород, а на аноде — кислород.
2h3 O + Электроэнергия -> 2h3 + O2.
Следует отметить, что этот метод получения водорода для процесса Габера использовался для производства аммиака в 20 веке.
2. Реакция метана и пара
Со временем химики нашли сравнительно более дешевый и более эффективный способ получения водорода.Метод включает использование источника метана, такого как природный газ, который реагирует с высокотемпературным паром при температуре от 700 ° C до 1000 ° C и под давлением 3-25 бар. Наряду с водородом образуется окись углерода и относительно небольшое количество углекислого газа.
Наряду с водородом образуется окись углерода и относительно небольшое количество углекислого газа.
Ch5 + h3 O + heat -> CO + 3h3 (+ небольшое количество CO2)
Затем монооксид углерода и водяной пар вступают в реакцию с использованием никеля в качестве катализатора для получения диоксида углерода и большего количества водорода.
CO + h3 O -> CO2 + h3
Наконец, диоксид углерода и другие примеси удаляются из газового потока с помощью метода, известного как адсорбция при переменном давлении.Это оставляет по существу чистый водород.
Получение азота
Хорошо, а как же процесс получения азота?
1. Фракционная перегонка жидкого воздуха
Азот можно получить путем фракционной перегонки воздуха вокруг нас. Воздух сжимается до 200 ° C. Следующие газы, углекислый газ и вода удаляются фильтрацией. Кислород и азот переходят в жидкое состояние при -183 ° C и -196 ° C соответственно. Эта сжиженная смесь, состоящая из кислорода и азота, затем разделяется фракционной перегонкой. Поскольку жидкий азот кипит при более низкой температуре, чем кислород, он поднимется вверх по фракционирующей колонне, в то время как жидкий кислород остается внизу. Однако этот метод получения азота слишком дорог.
Поскольку жидкий азот кипит при более низкой температуре, чем кислород, он поднимется вверх по фракционирующей колонне, в то время как жидкий кислород остается внизу. Однако этот метод получения азота слишком дорог.
2. Реакция метана и воздуха
Напомним, что воздух на 78% состоит из азота, а почти все остальное — кислород. Если мы сжигаем метан в воздухе, кислород вступает в реакцию с метаном с образованием углекислого газа и воды. Вы можете понять, что присутствующий в воздухе азот остается непрореагировавшим.Если удалить углекислый газ и воду, мы получим азот.
Теперь, когда получены азот и водород, их можно подвергнуть реакции с образованием аммиака. Затем эти газы сжимаются и доставляются в реактор, где одна молекула газообразного азота взаимодействует с тремя молекулами газообразного водорода над мелкодисперсным железом в качестве катализатора с образованием двух молекул аммиака.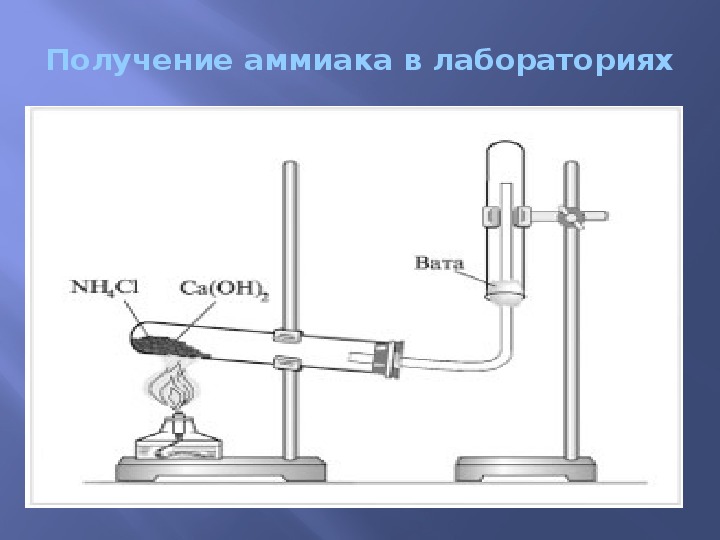 Катализатор — это вещество, которое ускоряет химическую реакцию, но не расходуется на нее.
Катализатор — это вещество, которое ускоряет химическую реакцию, но не расходуется на нее.
Процесс Габера — это обратимая экзотермическая равновесная реакция. Любая экзотермическая реакция выделяет энергию в окружающую среду. При производстве каждой молекулы аммиака в процессе Габера выделяется 46 кДж тепловой энергии.
Необходимые условия
В процессе Хабера используется принцип Ле Шателье для максимального использования аммиака при сохранении производственных и производственных затрат. Принцип Ле Шателье гласит, что если нарушается реакция при равновесии, положение равновесия смещается таким образом, чтобы противодействовать возмущению.
Давление
Принцип Ле Шателье говорит нам, что увеличение давления будет благоприятствовать стороне с меньшим количеством молей. Поэтому имеет смысл проводить реакцию при очень высоком давлении, но мы также должны помнить, что строительство и эксплуатация установки, способной выдерживать такое высокое давление, обходятся дорого. Поэтому используется компромиссное давление около 150-200 атмосфер.
Поэтому используется компромиссное давление около 150-200 атмосфер.
Температура
Теперь давайте рассмотрим оптимальную температуру, необходимую для процесса, чтобы максимизировать выход аммиака. Поскольку прямая реакция является экзотермической (помните, что на каждый моль произведенного аммиака выделяется 46 кДж тепла), было бы разумно проводить реакцию при низкой температуре. Однако компромиссная температура около 450-500 ° C гарантирует, что реакция протекает с достаточным выходом.Эта температура не является ни слишком низкой, ни слишком высокой. Если используется более низкая температура, скорость реакции будет низкой и потребуется много времени, чтобы реакция достигла равновесия.
Выход аммиака по процессу Габера при указанных условиях давления и температуры составляет около 15-20%. Любые неиспользованные азот и водород возвращаются обратно в реактор.
Краткое содержание урока
Аммиак получают в промышленных масштабах по процессу Хабера , химическому методу, в котором для синтеза аммиака используются газообразный азот и газообразный водород. Одна молекула газообразного азота реагирует с тремя молекулами газообразного водорода над мелкодисперсным железом в качестве катализатора с образованием двух молекул аммиака.
Одна молекула газообразного азота реагирует с тремя молекулами газообразного водорода над мелкодисперсным железом в качестве катализатора с образованием двух молекул аммиака.
Газообразный азот можно получить из воздуха путем фракционной перегонки жидкого воздуха. В качестве альтернативы, если кислород, содержащийся в воздухе, вступает в реакцию с природным газом, можно выделить непрореагировавший азот. С другой стороны, водород можно получить либо путем электролиза воды, либо путем реакции природного газа с водяным паром.
И водород, и азот реагируют при 450-500 ° C и давлении 150-200 атмосфер с образованием примерно 15-20% аммиака.
Синтез аммиака — обзор
11.1.2 Принципы синтеза аммиака: процесс Габера или Габера – Боша
Реакция синтеза аммиака представлена уравнением. 11.6, который устанавливает стехиометрию 2 моль (объемов) аммиака, полученного на каждые 4 моль (объема) реагирующих газов.
11,6N2 (г) + 3h3 (г) ⇌2Nh4 (г) ΔH = -92,0 кДж (-22,0 ккал)
Принцип Ле Шателье гласит, что при изменении системы, находящейся в равновесии, происходит сдвиг чтобы уменьшить влияние изменения (количества, давления, температуры и т. д.). Таблица 11.2 показывает, что, согласно принципу Ле Шателье, увеличение давления в этой системе увеличивает равновесную концентрацию аммиака.
д.). Таблица 11.2 показывает, что, согласно принципу Ле Шателье, увеличение давления в этой системе увеличивает равновесную концентрацию аммиака.
Таблица 11.2. Равновесные процентные концентрации аммиака при различных температурах и давлениях a
| Температура, ° C | Абсолютное давление (атм) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10 | 50 | 100 600 | 1000 | ||||||||||
| 200 | 15.3 | 50,7 | 74,4 | 81,5 | 89,9 | 95,4 | 98,3 | |||||||
| 300 | 2,2 | 14,7 | 39,4 | 39,4 | 9103 | 0,4 | 3,9 | 15,3 | 25,1 | 47,0 | 65,2 | 79,8 | ||
| 500 | — | 1,2 | 5,6 | 10. 6 6 | 26,4 | 42,2 | 57,5 | |||||||
| 600 | — | 0,5 | 2,3 | 4,5 | 13,8 | 23,1 | 31,4 | 2,2 | 7,3 | 11,5 | 12,9 | |||
Реакция синтеза аммиака также протекает быстрее при более высоких температурах — условия равновесия достигаются быстрее.В то же время реакция экзотермична до 46 кДж моль -1 (около 54 кДж моль -1 при нормальных температурах конверсии), так что при повышении температуры синтеза равновесие аммиака смещается в сторону слева, опять же в соответствии с принципом Ле Шателье (таблица 11.2). Таким образом, хотя повышение температуры синтеза действительно дает более высокую скорость реакции, позволяя получить больший объем продукции в реакторе того же размера; это также смещает равновесие синтеза (Ур.11.6) слева, что дает меньшую потенциальную конверсию азота в аммиак. К счастью, значительное увеличение давления в системе существенно улучшает равновесное преобразование в аммиак, что делает все упражнение практичным. По этим причинам условия, используемые в большинстве процессов синтеза аммиака, имеют тенденцию к группировке около 100–300 атм и 400–500 ° C в попытке максимизировать конверсию и коэффициенты конверсии при одновременном снижении затрат на сжатие. Процессы синтеза аммиака Claude и Casale с самым высоким давлением работают во Франции при 900 атм и в Италии при 750 атм соответственно.Это одни из самых сложных промышленных процессов. Процесс Клода основан на использовании просверленных никель-хромовых слитков с малым внутренним диаметром (10 см) для сдерживания огромного давления и, в свою очередь, обеспечивает конверсию в аммиак 40% или выше. Более обычные конвертеры имеют высоту от 7 до 10 м, внешний диаметр 3 м и используют стенки из легированной стали толщиной 20 см для сдерживания давления, чтобы обеспечить конверсию аммиака 10–20%.
По этим причинам условия, используемые в большинстве процессов синтеза аммиака, имеют тенденцию к группировке около 100–300 атм и 400–500 ° C в попытке максимизировать конверсию и коэффициенты конверсии при одновременном снижении затрат на сжатие. Процессы синтеза аммиака Claude и Casale с самым высоким давлением работают во Франции при 900 атм и в Италии при 750 атм соответственно.Это одни из самых сложных промышленных процессов. Процесс Клода основан на использовании просверленных никель-хромовых слитков с малым внутренним диаметром (10 см) для сдерживания огромного давления и, в свою очередь, обеспечивает конверсию в аммиак 40% или выше. Более обычные конвертеры имеют высоту от 7 до 10 м, внешний диаметр 3 м и используют стенки из легированной стали толщиной 20 см для сдерживания давления, чтобы обеспечить конверсию аммиака 10–20%.
Успешная конверсия аммиака потребовала открытия катализатора, который будет способствовать достаточно быстрой реакции при 100–300 атм и 400–500 ° C, чтобы использовать умеренно благоприятное равновесие, полученное в этих условиях. Без этого для получения достаточно высоких скоростей потребовались бы более высокие температуры, а менее благоприятное равновесие при более высоких температурах потребовало бы также более высоких давлений, чтобы получить экономичное превращение в аммиак. Первоначальные эксперименты по синтезу проводились с осмиевым катализатором. Позже Габер обнаружил, что восстановленный магнитный оксид железа (Fe 3 O 4 ) был намного более эффективным, и что его активность может быть дополнительно усилена за счет присутствия в качестве промоторов оксида алюминия (Al 2 O 3 ; 3% ) и оксида калия (K 2 O; 1%), вероятно, из-за введения дефектов решетки железа.Железо с различными патентованными вариациями до сих пор составляет основу всех каталитических систем на основе аммиака.
Без этого для получения достаточно высоких скоростей потребовались бы более высокие температуры, а менее благоприятное равновесие при более высоких температурах потребовало бы также более высоких давлений, чтобы получить экономичное превращение в аммиак. Первоначальные эксперименты по синтезу проводились с осмиевым катализатором. Позже Габер обнаружил, что восстановленный магнитный оксид железа (Fe 3 O 4 ) был намного более эффективным, и что его активность может быть дополнительно усилена за счет присутствия в качестве промоторов оксида алюминия (Al 2 O 3 ; 3% ) и оксида калия (K 2 O; 1%), вероятно, из-за введения дефектов решетки железа.Железо с различными патентованными вариациями до сих пор составляет основу всех каталитических систем на основе аммиака.
Еще одним показателем эффективности преобразования аммиака является «объемная скорость», которую можно использовать. Объемная скорость относится к объему реагентов, подаваемых в реактор в час, деленному на объем реактора. Для жидких реакционных потоков эта взаимосвязь очевидна. Для газов, однако, объемная скорость определяется как объем газов с поправкой на 0 ° C и 760 мм рт. Ст. (1 атм), проходящий через объем реактора (или катализатора) в час.Это составляет меру времени контакта газа с катализатором для гетерогенной реакции (уравнение 11.7).
Для жидких реакционных потоков эта взаимосвязь очевидна. Для газов, однако, объемная скорость определяется как объем газов с поправкой на 0 ° C и 760 мм рт. Ст. (1 атм), проходящий через объем реактора (или катализатора) в час.Это составляет меру времени контакта газа с катализатором для гетерогенной реакции (уравнение 11.7).
11,7 объемная скорость = объемная скорость подачи объем реактора объемная скорость = м3газ час − 1 м3 объем катализатора
Для магнитно-оксидного катализатора с двойным промотированием, работающего с мольным соотношением азот: водород 1: 3 при давлении 100 атм и 450 ° C, и объемная скорость 5000 (час -1 ), можно было ожидать приблизительно 13-15% аммиака [10]. Гораздо более низкие конверсии получают из однократно промотированного или непромотированного железа.
Объемная скорость 5000 ч -1 (с поправкой на 0 ° C, 760 мм) соответствует скорости газообмена в пространстве катализатора 132,4 м 3 газа / кубометр пространства катализатора / час при работе условий (450 ° C, 100 атм; уравнение 11. 8), или фактическое время контакта газа с катализатором около 27 секунд. Увеличение объемной скорости одновременно уменьшает время контакта газа с катализатором и процент превращения азота и водорода в аммиак.
8), или фактическое время контакта газа с катализатором около 27 секунд. Увеличение объемной скорости одновременно уменьшает время контакта газа с катализатором и процент превращения азота и водорода в аммиак.
Соотношения пространственной скорости:
11.8 пространственная скорость 1 время контакта
Таким образом, объемная скорость 5000 часов −1 эквивалентна времени контакта 1 / (5000 часов −1 ), или 2 × 10 −4 часов, или 0,72 (2 × 10 -4 ч × 3600 с / ч) с время контакта, если газы находились при 0 ° C (273 K) и давлении 1 атм.
Тогда при постоянной объемной скорости
время контакта давление.
Таким образом, изменение давления только на 100 атмосфер увеличивает время контакта до 100 × 0,72 сек, или 72 сек.
время контакта также 1абсолютная температура
Таким образом, одновременное повышение температуры приводит к уменьшению фактического времени контакта до
72сек × 1 (723K / 273K) = 22. 19сек. 27,2сек. Контакт
19сек. 27,2сек. Контакт
, в условиях работы преобразователя.
Изменений газа в час в условиях работы конвертера, следовательно, будет:
(3600 сек / час) / (27,19 сек / изменение) = 132,4 изменения в час.
Удвоение объемной скорости конвертера может снизить процент превращения аммиака примерно до 10%, что может показаться изменением в неправильном направлении. Однако, если преобразовано 10% от удвоенного первоначального объема реагирующих газов, проходящих через конвертер, это все равно означает, что объем извлеченного аммиака примерно на треть больше или 1000 м3 3 / час NH 3 (10% 10 000 м 3 ), а не 750 м 3 / час NH 3 (15% от 5000 м 3 ), полученное при объемной скорости 5000 часов −1 .Следовательно, высокие объемные скорости 10 000–20 000 ч 90 416 -1 90 419 или более являются обычными для коммерческих конвертеров аммиака.
По этой комбинации причин большинство крупных аммиачных заводов должны рециркулировать большую часть выходящих газов конвертера в виде непрореагировавших азота и водорода. Таким образом, значительная часть проектирования современной установки синтеза аммиака связана с сохранением давления и тепла, чтобы этот рецикл проводился как можно более экономично.
Таким образом, значительная часть проектирования современной установки синтеза аммиака связана с сохранением давления и тепла, чтобы этот рецикл проводился как можно более экономично.
Использование и преимущества аммиака | Факты химической безопасности
Ответы на вопросы
Для чего используется аммиак?
Около 90 процентов производимого аммиака используется в удобрениях, чтобы поддерживать производство продуктов питания для миллиардов людей во всем мире. Аммиак имеет и другие важные применения; например, в бытовых чистящих средствах и при производстве других продуктов.
Что такое аммиак?
Аммиак, также известный как NH 3 , представляет собой бесцветный газ с отчетливым запахом, состоящим из атомов азота и водорода.Он вырабатывается естественным образом в организме человека и в природе — в воде, почве и воздухе, даже в крошечных молекулах бактерий. Для здоровья человека аммиак и ион аммония являются жизненно важными компонентами метаболических процессов.
Что происходит с аммиаком в окружающей среде?
Аммиак встречается в естественных условиях и содержится в почве, воздухе и воде в окружающей среде. Аммиак также возобновляется естественным путем в рамках азотного цикла, который уже происходит при удобрении растений. В результате этого естественного процесса аммиак недолго остается в окружающей среде, а также не накапливается в биоаккумуляторе.
Чем пахнет аммиак?
Аммиак имеет очень отчетливый резкий запах, похожий на запах пота или кошачьей мочи. Крепкие, соленые сыры, такие как бри, также могут пахнуть аммиаком. В сырах даже есть небольшое количество аммиака, являющегося естественным побочным продуктом процесса старения сыра.
Как я могу подвергнуться воздействию аммиака?
Аммиак естественным образом встречается в окружающей среде, поэтому каждый человек в тот или иной момент подвергается воздействию низких уровней. Человек может подвергнуться воздействию более высоких уровней аммиака при использовании чистящих средств, содержащих аммиак, или если он живет на фермах или рядом с ними, где используются удобрения. Также возможно подвергнуться воздействию более высоких уровней аммиака, если человек проводит время в закрытом здании, где содержится много животных.
Также возможно подвергнуться воздействию более высоких уровней аммиака, если человек проводит время в закрытом здании, где содержится много животных.
Как воздействие аммиака может повлиять на мое здоровье?
Воздействие на здоровье людей обычных количеств аммиака, присутствующего в окружающей среде, не обнаружено. Воздействие высоких концентраций аммиака в воздухе может вызывать раздражение кожи, глаз, горла и легких человека, а также вызывать кашель и ожоги.
Для чего используется аммиак?
Около 90 процентов производимого аммиака используется в удобрениях, чтобы поддерживать производство продуктов питания для миллиардов людей во всем мире.Аммиак имеет и другие важные применения; например, в бытовых чистящих средствах и при производстве других продуктов.
Что такое аммиак?
Аммиак, также известный как NH 3 , представляет собой бесцветный газ с отчетливым запахом, состоящим из атомов азота и водорода. Он вырабатывается естественным образом в организме человека и в природе — в воде, почве и воздухе, даже в крошечных молекулах бактерий. Для здоровья человека аммиак и ион аммония являются жизненно важными компонентами метаболических процессов.
Он вырабатывается естественным образом в организме человека и в природе — в воде, почве и воздухе, даже в крошечных молекулах бактерий. Для здоровья человека аммиак и ион аммония являются жизненно важными компонентами метаболических процессов.
Что происходит с аммиаком в окружающей среде?
Аммиак встречается в естественных условиях и содержится в почве, воздухе и воде в окружающей среде. Аммиак также возобновляется естественным путем в рамках азотного цикла, который уже происходит при удобрении растений. В результате этого естественного процесса аммиак недолго остается в окружающей среде, а также не накапливается в биоаккумуляторе.
Чем пахнет аммиак?
Аммиак имеет очень отчетливый резкий запах, похожий на запах пота или кошачьей мочи.Крепкие, соленые сыры, такие как бри, также могут пахнуть аммиаком. В сырах даже есть небольшое количество аммиака, являющегося естественным побочным продуктом процесса старения сыра.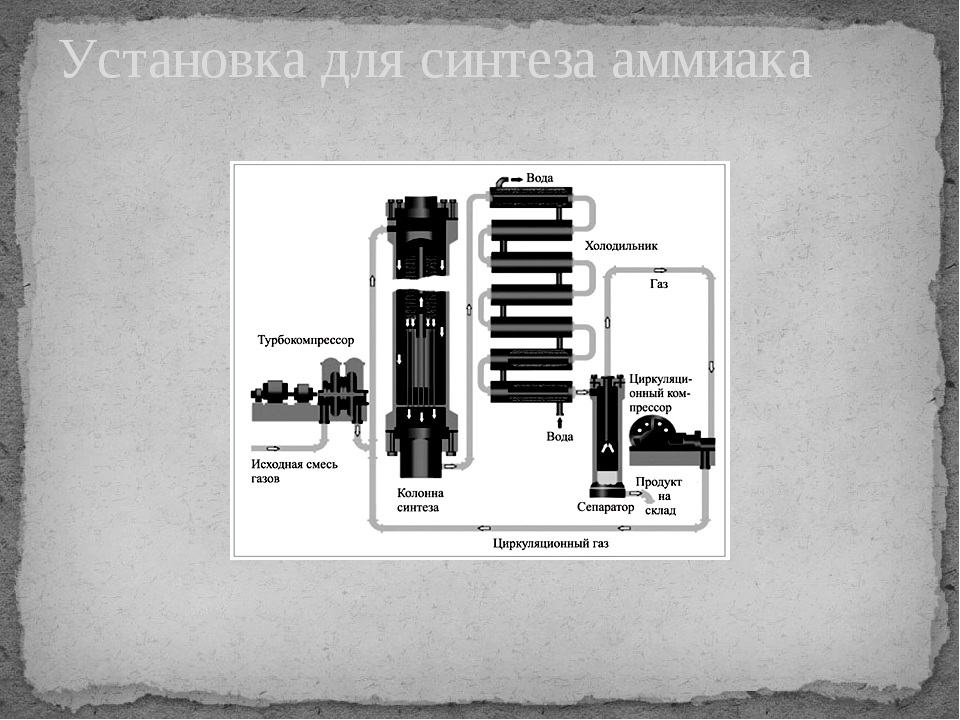
Как я могу подвергнуться воздействию аммиака?
Аммиак естественным образом встречается в окружающей среде, поэтому каждый человек в тот или иной момент подвергается воздействию низких уровней. Человек может подвергнуться воздействию более высоких уровней аммиака при использовании чистящих средств, содержащих аммиак, или если он живет на фермах или рядом с ними, где используются удобрения.Также возможно подвергнуться воздействию более высоких уровней аммиака, если человек проводит время в закрытом здании, где содержится много животных.
Как воздействие аммиака может повлиять на мое здоровье?
Воздействие на здоровье людей обычных количеств аммиака, присутствующего в окружающей среде, не обнаружено. Воздействие высоких концентраций аммиака в воздухе может вызывать раздражение кожи, глаз, горла и легких человека, а также вызывать кашель и ожоги.
Синтез аммиака непосредственно из воздуха и воды при температуре и давлении окружающей среды
Lan, R. , Ирвин, Дж. Т. С. и Тао, С. В. Аммиак и родственные химические вещества как потенциальные материалы для косвенного хранения водорода. Интер. J. Hydrogen Energy 37, 1482–1494 (2012).
, Ирвин, Дж. Т. С. и Тао, С. В. Аммиак и родственные химические вещества как потенциальные материалы для косвенного хранения водорода. Интер. J. Hydrogen Energy 37, 1482–1494 (2012).
CAS Статья Google Scholar
Bastidas, D. M., Tao, S. W. и Irvine, J. T. S. Симметричный твердооксидный топливный элемент, демонстрирующий перовскитные электроды, устойчивые к окислительно-восстановительным процессам. J. Mater. Chem. 16, 1603–1605 (2006).
CAS Статья Google Scholar
Пул, Дж., Лобковский, Э. и Чирик, П. Гидрирование и расщепление диазота до аммиака с циркониевым комплексом. Nature 427, 527–530 (2004).
объявлений CAS Статья Google Scholar
Амар, И. А., Лан, Р., Пети, К. Т. Г. и Тао, С. В. Твердотельный электрохимический синтез аммиака: обзор. J. Solid State Electrochem. 15. С. 1845–1860 (2011).
С. 1845–1860 (2011).
CAS Статья Google Scholar
http: // www.kbr.com/Newsroom/Publications/Articles/Carbon-Dioxide-Capture-and-Storage-in-the-Nitrogen-Syngas-Industries.pdf. (Доступ 28 -е августа 2012 г.).
http://www.decc.gov.uk/assets/decc/11/stats/climate-change/4282-statistical-release-2010-uk-greenhouse-gas-emissi.pdf. (Доступ 28 -е августа 2012 г.).
Во, К. К., Батлер, Д. и Хайден, Б. Э. Механизм отравления катализаторов синтеза аммиака оксигенатами O2, CO и h3O — метод in situ для определения активной поверхности.Катал. Lett. 24. С. 197–210 (1994).
CAS Статья Google Scholar
Дженнингс Дж. Каталитический синтез аммиака: основы и практика. (Спрингер, 1991).
Chatt, J., Pearman, A. & Richards, R. Восстановление монокоординированного молекулярного азота до аммиака в протонной среде. Nature 253, 39–40 (1975).
Nature 253, 39–40 (1975).
объявлений CAS Статья Google Scholar
Яндулов, Д.И Шрок, Р. Каталитическое восстановление диазота до аммиака в единственном центре молибдена. Science 301, 76 (2003).
объявлений CAS Статья Google Scholar
Avenier, P. et al. Диссоциация диазота на изолированном поверхностном атоме тантала. Наука 317, 1056 (2007).
объявлений CAS Статья Google Scholar
Nishibayashi, Y. et al. Бакминстерфуллерены: неметаллическая система фиксации азота.Nature 428, 279–280 (2004).
объявлений CAS Статья Google Scholar
Laplaza, C. & Cummins, C. Расщепление азота трехкоординированным комплексом молибдена (III). Science 268, 861 (1995).
объявлений CAS Статья Google Scholar
Химмель, Х. и Рейхер, М. Активация внутреннего азота атомами чистого металла. Энгью. Chem. Интер.Выпуск 45, 6264–6288 (2006).
и Рейхер, М. Активация внутреннего азота атомами чистого металла. Энгью. Chem. Интер.Выпуск 45, 6264–6288 (2006).
CAS Статья Google Scholar
Шрок Р. Каталитическое восстановление диазота до аммиака молибденом: теория против эксперимента. Энгью. Chem. Интер. Выпуск 47, 5512–5522 (2008).
CAS Статья Google Scholar
Пикетт, К. и Талармин, Дж. Электросинтез аммиака. Nature 317, 652–653 (1985).
объявлений CAS Статья Google Scholar
Фуруя, Н.И Йошиба, Х. Электровосстановление азота до аммиака на газодиффузионных электродах, модифицированных Fe-фталоцианином. J. Electroanalytical Chem. 263, 171–174 (1989).
CAS Статья Google Scholar
Фуруя Н. и Йошиба Х. Электровосстановление азота до аммиака на газодиффузионных электродах, модифицированных фталоцианинами металлов. J. Electroanalytical Chem. 272, 263–266 (1989).
J. Electroanalytical Chem. 272, 263–266 (1989).
CAS Статья Google Scholar
Норби, Т.Твердотельные протонные проводники: принципы, свойства, развитие и перспективы. Ионика твердого тела 125, 1–11 (1999).
CAS Статья Google Scholar
Кройер, К. Д. Протонная проводимость: материалы и применения. Chem. Матер. 8, 610–641 (1996).
CAS Статья Google Scholar
Ивахара, Х., Эсака, Т., Учида, Х. и Маеда, Н. Протонная проводимость в спеченных оксидах и ее применение в паровом электролизе для производства водорода.Ионика твердого тела 3–4, 359–363 (1981).
Артикул Google Scholar
Тао, С. В. и Ирвин, Дж. Т. С. Стабильный, легко спекаемый протонпроводящий оксидный электролит для топливных элементов и электролизеров при умеренных температурах. Adv. Матер. 18, 1581–1584 (2006).
Adv. Матер. 18, 1581–1584 (2006).
CAS Статья Google Scholar
Марнеллос, Г. и Стоукидес, М. Синтез аммиака при атмосферном давлении.Science 282, 98–100 (1998).
объявлений CAS Статья Google Scholar
Скодра А. и Стоукидес М. Электрокаталитический синтез аммиака из пара и азота при атмосферном давлении. Ионика твердого тела 180, 1332–1336 (2009).
CAS Статья Google Scholar
Мураками Т., Нохира Т., Гото Т., Огата Ю. Х. и Ито Ю. Электролитический синтез аммиака из воды и газообразного азота в солевом расплаве при атмосферном давлении.Электрохим. Acta 50, 5423–5426 (2005).
CAS Статья Google Scholar
Murakami, T. et al. Электролитический синтез аммиака из воды и азота при атмосферном давлении с использованием алмазного электрода, легированного бором, в качестве неплавящегося анода. Электрохим. & Solid State Lett. 10, E4 – E6 (2007).
Электрохим. & Solid State Lett. 10, E4 – E6 (2007).
CAS Статья Google Scholar
Амар, И.А., Лан, Р., Пети, К. Т. Г., Арриги, В. и Тао, С. В. Электрохимический синтез аммиака на основе карбонатно-оксидного композитного электролита. Ионика твердого тела 182 (2011), 133–138.
CAS Статья Google Scholar
Перман, Э. и Аткинсон, Г. Разложение аммиака при нагревании. Труды Лондонского королевского общества 74, 110–117 (1904).
объявлений Статья Google Scholar
Кунду, П.П. и Пал, А. Катионообменные полимерные мембраны для топливных элементов. Обзоры в химической инженерии 22, 125–153 (2006).
CAS Статья Google Scholar
Кордали В., Кириаку Г. и Ламброу К. Электрохимический синтез аммиака при атмосферном давлении и низкой температуре в ячейке с твердым полимерным электролитом.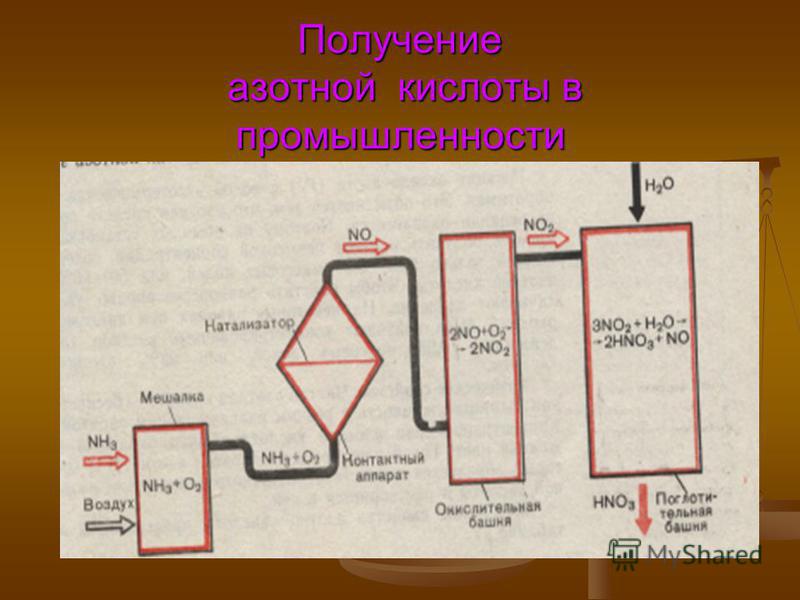 Chem. Comm. 1673–1674 (2000).
Chem. Comm. 1673–1674 (2000).
Чжан, З. Ф., Чжун, З. П., Лю Р. К. Катодные характеристики катодного катализа SmBaCuMO5 + δ (M = Fe, Co, Ni) в синтезе аммиака.J. Rare Earths 28, 556–559 (2010).
CAS Статья Google Scholar
Skulason, E. et al. Теоретическая оценка возможных электрокатализаторов на основе переходных металлов для восстановления N2. Phys. Chem. Chem. Phys. 14. С. 1235–1245 (2012).
CAS Статья Google Scholar
Бернс Р. и Харди Р. Фиксация азота у бактерий и высших растений. Молекулярная биология, биохимия и биофизика 21, 1–189 (1975).
Google Scholar
Benemann, J. & Valentine, R. Пути фиксации азота. Успехи микробной физиологии 8, 59–104 (1972).
CAS Статья Google Scholar
Хунсирикарн К. , Гудвин Дж. Мл., Гринуэй С. и Крегер С. Влияние аммиака на проводимость мембран Nafion. J. Источники энергии 195, 30–38 (2010).
, Гудвин Дж. Мл., Гринуэй С. и Крегер С. Влияние аммиака на проводимость мембран Nafion. J. Источники энергии 195, 30–38 (2010).
объявлений CAS Статья Google Scholar
Москвич, Ю.Н., Поляков А.М., Суховский А.А. ЯМР-исследование ионных движений и механизмов проводимости в протонных проводниках MHSeO4 и M3H (AO4) 2. Сегнетоэлектрики, 81, 1161–1164 (1988).
Артикул Google Scholar
Pawowski, A., Pawlaczyk, C. & Hilczer, B. Электропроводность в кристаллической группе Me3H (SeO4) 2 (Me: NH 4+ , Rb + , Cs + ). Ионика твердого тела 44, 17–19 (1990).
Артикул Google Scholar
Бинньюис, М.& Milke, E. Термохимические данные элементов и соединений. (Интернет-библиотека Wiley, 1999).
Янг, С. К., Тревино, С. и Бек Тан, Н. С. Исследование структурных изменений мембран нафиона, вызванных набуханием с помощью различных растворителей, с помощью малоуглового рассеяния нейтронов. Journal of Polymer Science Part B: Polymer Physics 40, 387–400 (2002).
Journal of Polymer Science Part B: Polymer Physics 40, 387–400 (2002).
объявлений CAS Статья Google Scholar
Халсайд, Р., Ви, П. Дж. С. и Тунольд, Р. Влияние аммиака на характеристики топливных элементов с полимерным электролитом с мембраной. J. Источники энергии 154, 343–350 (2006).
объявлений CAS Статья Google Scholar
Харгривз, Дж. С. Дж. И Маккей, Д. Сравнение реакционной способности решеточного азота в катализаторах Co3Mo3N и Ni2Mo3N. J. Mol. Катал. A-Chem. 305. С. 125–129 (2009).
CAS Статья Google Scholar
Факты об аммиаке
Техническая информация
Копия фактов об аммиаке (техническая информация) доступна в формате Adobe Portable Document Format (PDF, 63 КБ, 3pg.)
Примечание для читателя: Этот информационный бюллетень предназначен для обеспечения общей осведомленности и просвещения по конкретному химическому веществу. Для получения информации о готовности и реагировании (например, для служб быстрого реагирования и персонала скорой медицинской помощи), пожалуйста, обратитесь к следующим ресурсам Департамента:
Для получения информации о готовности и реагировании (например, для служб быстрого реагирования и персонала скорой медицинской помощи), пожалуйста, обратитесь к следующим ресурсам Департамента:
Что такое аммиак?
Аммиак (NH 3 ) — один из наиболее часто производимых промышленных химикатов в США. Он используется в промышленности и торговле, а также естественным образом присутствует в организме человека и окружающей среды.Аммиак необходим для многих биологических процессов и служит предшественником для синтеза аминокислот и нуклеотидов. В окружающей среде аммиак является частью круговорота азота и вырабатывается в почве в результате бактериальных процессов. Аммиак также производится естественным путем при разложении органических веществ, в том числе растений, животных и животных отходов.
Некоторые химические / физические свойства аммиака:
- При комнатной температуре аммиак представляет собой бесцветный, сильно раздражающий газ с резким удушающим запахом.

- В чистом виде он известен как безводный аммиак и гигроскопичен (легко впитывает влагу).
- Аммиак обладает щелочными свойствами и вызывает коррозию.
- Газообразный аммиак легко растворяется в воде с образованием гидроксида аммония, щелочного раствора и слабого основания.
- Аммиак легко сжимается и под давлением образует прозрачную жидкость.
- Аммиак обычно поставляется в виде сжатой жидкости в стальных контейнерах.
- Аммиак не является легковоспламеняющимся, но емкости с аммиаком могут взорваться при воздействии высокой температуры.
Как используется аммиак?
Около 80% производимого промышленностью аммиака используется в сельском хозяйстве в качестве удобрений. Аммиак также используется в качестве хладагента, для очистки водоснабжения и при производстве пластмасс, взрывчатых веществ, текстиля, пестицидов, красителей и других химикатов. Он содержится во многих бытовых и промышленных чистящих средствах. Растворы для очистки бытового аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака.Растворы аммиака для промышленного использования могут иметь концентрацию 25% и выше и вызывают коррозию.
Растворы для очистки бытового аммиака производятся путем добавления газообразного аммиака в воду и могут содержать от 5 до 10% аммиака.Растворы аммиака для промышленного использования могут иметь концентрацию 25% и выше и вызывают коррозию.
Как люди могут подвергаться воздействию аммиака?
Большинство людей подвергаются воздействию аммиака при вдыхании газа или паров. Поскольку аммиак существует в природе и также присутствует в чистящих средствах, воздействие может происходить из этих источников. Широкое использование аммиака на фермах, а также в промышленных и коммерческих зонах также означает, что воздействие может произойти в результате случайного выброса или преднамеренного террористического нападения.
Безводный газообразный аммиак легче воздуха и поднимается вверх, поэтому обычно он рассеивается, а не оседает в низинах. Однако в присутствии влаги (например, при высокой относительной влажности) сжиженный безводный газообразный аммиак образует пары, которые тяжелее воздуха. Эти пары могут распространяться по земле или в низинные районы с плохой циркуляцией воздуха, где люди могут подвергнуться воздействию.
Эти пары могут распространяться по земле или в низинные районы с плохой циркуляцией воздуха, где люди могут подвергнуться воздействию.
Каков механизм действия аммиака?
Аммиак немедленно вступает во взаимодействие с влагой, имеющейся в коже, глазах, полости рта, дыхательных путях и особенно на слизистых поверхностях, с образованием очень едкого гидроксида аммония.Гидроксид аммония вызывает некроз тканей за счет разрушения липидов клеточной мембраны (омыление), что приводит к разрушению клеток. Когда клеточные белки распадаются, вода извлекается, что приводит к воспалительной реакции, которая вызывает дальнейшее повреждение.
Каковы непосредственные последствия воздействия аммиака на здоровье?
Вдыхание: Аммиак вызывает раздражение и разъедание. Воздействие высоких концентраций аммиака в воздухе вызывает немедленное жжение в носу, горле и дыхательных путях.Это может вызвать бронхиолярный и альвеолярный отек и разрушение дыхательных путей, что приведет к дыхательной недостаточности или отказу.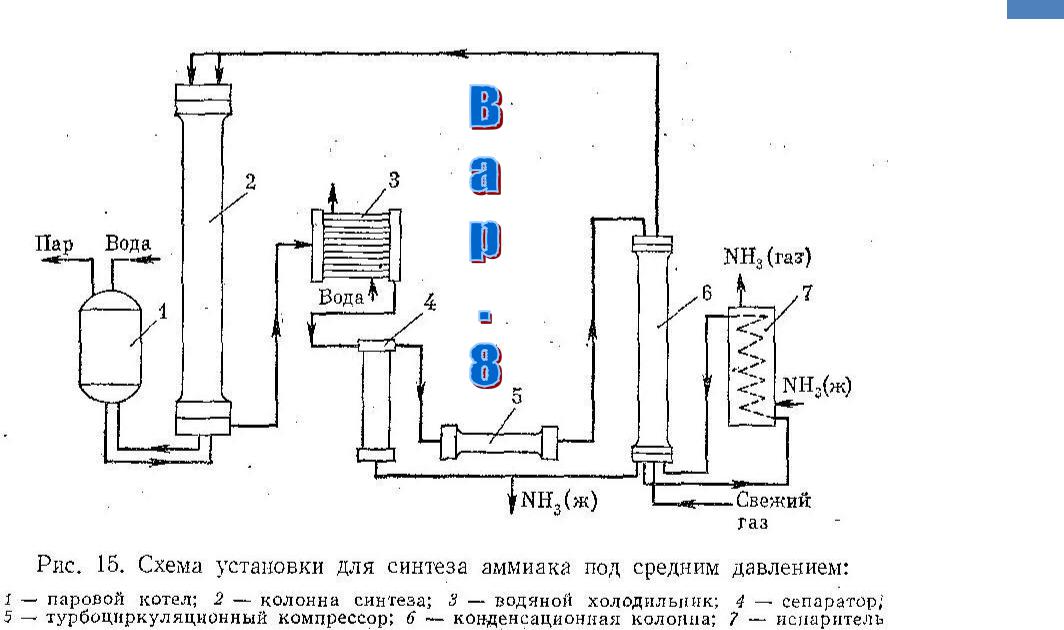 Вдыхание более низких концентраций может вызвать кашель, раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осведомленность о длительном воздействии низких концентраций.
Вдыхание более низких концентраций может вызвать кашель, раздражение носа и горла. Запах аммиака обеспечивает адекватное раннее предупреждение о его присутствии, но аммиак также вызывает обонятельную усталость или адаптацию, снижая осведомленность о длительном воздействии низких концентраций.
Дети, подвергшиеся воздействию паров аммиака тех же концентраций, что и взрослые, могут получить большую дозу, поскольку у них большее соотношение площади поверхности легких к массе тела и повышенное соотношение минутных объемов к массе.Кроме того, они могут подвергаться воздействию более высоких концентраций, чем взрослые особи в том же месте, из-за их меньшего роста и более высоких концентраций паров аммиака, первоначально обнаруживаемых у земли.
Контакт с кожей или глазами: Воздействие низких концентраций аммиака в воздухе или растворе может вызвать быстрое раздражение кожи или глаз. Более высокие концентрации аммиака могут вызвать тяжелые травмы и ожоги. Контакт с концентрированными растворами аммиака, такими как промышленные чистящие средства, может вызвать коррозионные повреждения, включая ожоги кожи, необратимое повреждение глаз или слепоту. Полная степень повреждения глаза может быть не очевидна в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Полная степень повреждения глаза может быть не очевидна в течение недели после воздействия. Контакт со сжиженным аммиаком также может вызвать обморожение.
Проглатывание: Воздействие высоких концентраций аммиака при проглатывании раствора аммиака приводит к коррозионным повреждениям полости рта, горла и желудка. Проглатывание аммиака обычно не приводит к системному отравлению.
Как лечится воздействие аммиака?
Противоядия от отравления аммиаком не существует, но его эффекты можно лечить, и большинство людей выздоравливает.Немедленное обеззараживание кожи и глаз обильным количеством воды очень важно. Лечение состоит из поддерживающих мер и может включать введение увлажненного кислорода, бронходилататоров и обеспечение проходимости дыхательных путей. Проглоченный аммиак разбавляют молоком или водой.
Помогут ли лабораторные тесты в принятии решения о лечении, если кто-то подвергся воздействию аммиака?
Лабораторные исследования на воздействие аммиака бесполезны при принятии решений об оказании неотложной помощи.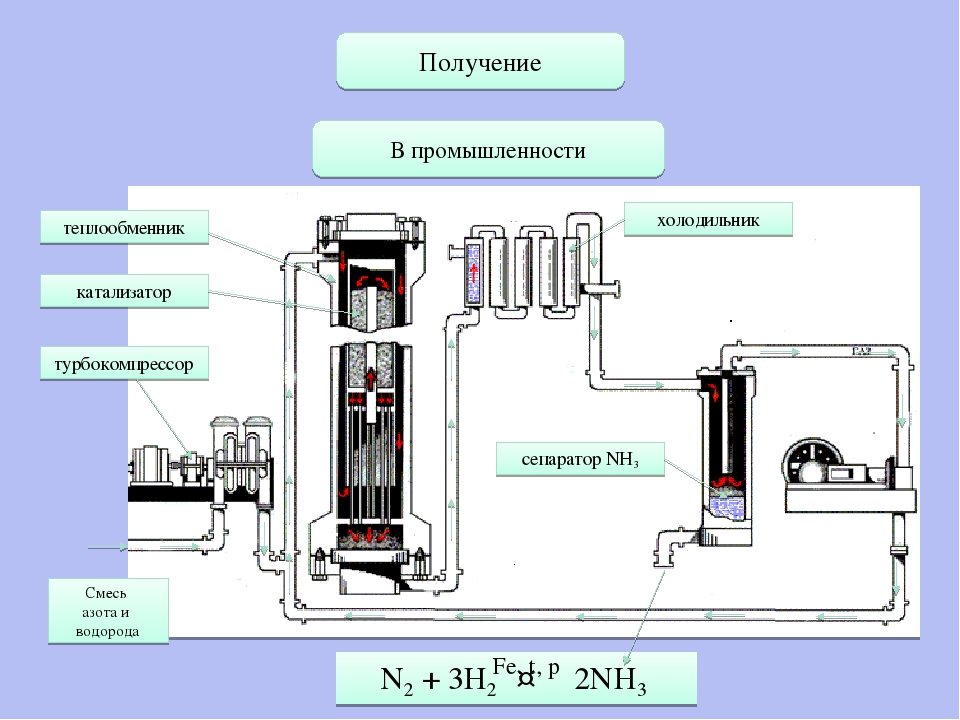 Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно содержится в организме, эти результаты не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро выводится из организма, либо метаболизируется до соединений, обнаруживаемых эндогенно в заметных количествах. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не показали никакого или минимального изменения по сравнению с предыдущими уровнями. Воздействие высоких концентраций является немедленным и явно токсичным, что, как правило, является достаточным основанием для постановки диагноза.
Доступны медицинские тесты, которые могут обнаружить аммиак в крови или моче. Однако, поскольку аммиак обычно содержится в организме, эти результаты не могут служить биомаркерами воздействия. После воздействия низких уровней аммиак либо быстро выводится из организма, либо метаболизируется до соединений, обнаруживаемых эндогенно в заметных количествах. Клинические показатели уровня аммиака или азота в организме после воздействия экзогенного аммиака не показали никакого или минимального изменения по сравнению с предыдущими уровнями. Воздействие высоких концентраций является немедленным и явно токсичным, что, как правило, является достаточным основанием для постановки диагноза.
Как я могу получить дополнительную информацию об аммиаке?
Позвоните по следующим номерам или посетите веб-сайты, указанные в разделе «Источники».
- Горячая линия общественного реагирования центров по контролю и профилактике заболеваний (1-888-246-2675)
- Агентство регистрации токсичных веществ и заболеваний (1-888-422-8737)
- Региональный токсикологический центр (1-800-222-1222)
Источники:
Агентство регистрации токсичных веществ и заболеваний. 2004. ToxFAQ по аммиаку.Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
2004. ToxFAQ по аммиаку.Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/tfacts126.html
Агентство регистрации токсичных веществ и заболеваний. 2004. Руководство по медицинскому менеджменту (MMG) для аммиака. Отдел токсикологии Министерства здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.atsdr.cdc.gov/MHMI/mmg126.html
Центры по контролю и профилактике заболеваний.2003. Таблицы готовности к чрезвычайным ситуациям в области общественного здравоохранения и ответных мер. Министерство здравоохранения и социальных служб США. Служба общественного здравоохранения: Атланта, Джорджия. По состоянию на 6 мая 2004 г. http://www.bt.cdc.gov/agent/ammonia/index.asp
Этот информационный бюллетень основан на самой последней информации. Он может обновляться по мере поступления новой информации.

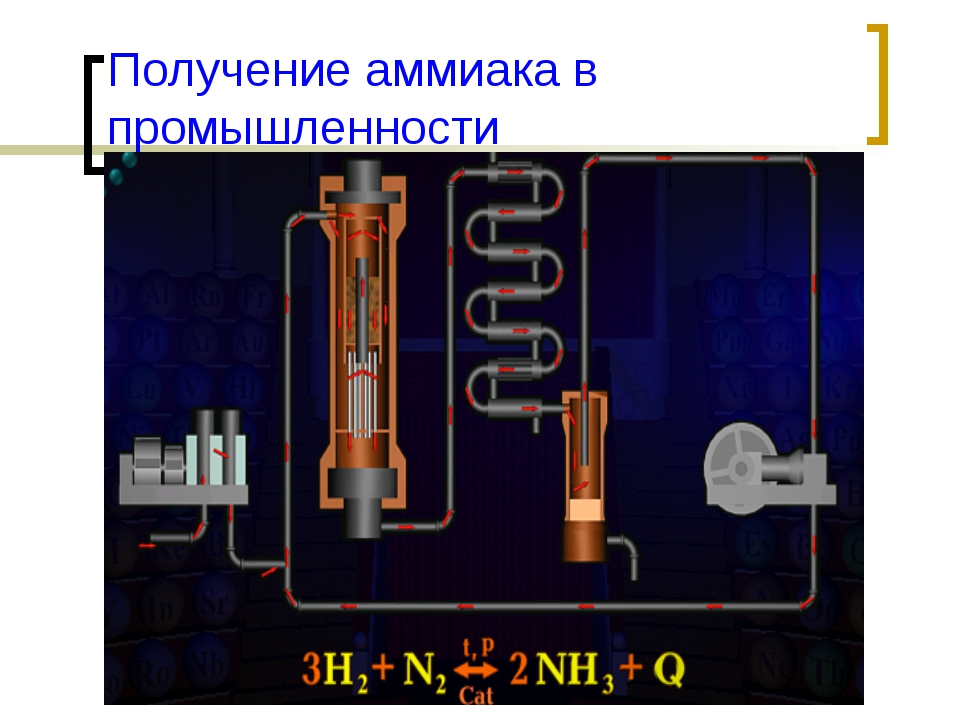


 (2016–2021 гг.) В среднем за эту неделю.
(2016–2021 гг.) В среднем за эту неделю. Общее количество буровых установок увеличилось на 6 и теперь составляет 417.
Общее количество буровых установок увеличилось на 6 и теперь составляет 417.