Производство кислота серная – Производители серной кислоты: 28 заводов из России На карте
Производство серной кислоты
.
Серную кислоту производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2 .
1) Измельчение пирита.
Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита.
После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют.
III. Химизм производства.
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
t = 800°C
4FeS2 + 11O2
2Fe2 O3 + 8SO2 + Q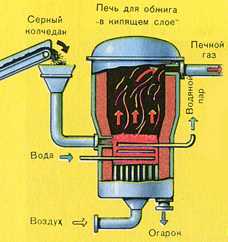
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2 O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
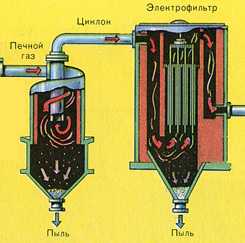
Из печи выходит печной газ, состав которого: SO2
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2 .
ВТОРАЯ СТАДИЯ — окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2
2SO3 + QСложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO
а) температура:
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2 ), а справа — 2V SO3 . Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO
Температура 400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3 . Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3 .
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ — поглощение SO3 серной кислотой.
Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2 O
H2 SO4 . Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: HУравнение реакции этого процесса nSO3 + H2 SO4
H2 SO4 ·nSO3Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO2 , путем обжига FeS2 , затем SO3 , после чего на третьей стадии получают серную кислоту.
mirznanii.com
2. Технология производства серной кислоты
Под названием «серная кислота» в технике подразумеваются любые смеси триоксида серы с
Промышленность выпускает несколько сортов серной кислоты, отличающихся концентрацией основного вещества я содержанием примесей. Основные сорта серной кислоты; 65-процентная —— камерная, 75-процентная — башенная, 98-процентная — купоросное масло, олеум, 100-про-центвая — химически чистая, аккумуляторная и др.
Высокая активность серной кислоты и сравнительно небольшая стоимость определяют огромные масштабы производства и чрезвычайно разнообразное применение почти о всех отраслях народного хозяйства.
Наиболее крупным потребителем серной кислоты является производство минеральных удобрений — суперфосфата, сульфата аммония и др. В металлообрабатывающей промышленности серная кислота применяется для снятия ржавчины с поверхности черных металлов при подготовке их к защитным или декоративным покрытиям лаками и цветными металлами. Большое количество серной кислоты расходуется на очистку нефтепродуктов. Производство красителей, лаков, красок, лекарственных веществ, некоторых пластических масс, многих ядохимикатов, эфиров, спиртов было бы невозможно в современных масштабах без серной кислоты. Разбавленные растворы серной кислоты или ее солей применяют в производстве искусственного шелка, в текстильной промышленности. В пищевой промышленности серная кислота используется для приготовления крахмала, патоки и других продуктов.
В процессах нитрирования для производства многих органических соединений, в том числе и большинства взрывчатых веществ, также применяется серная кислота.
Сырье. Исходным сырьем для производства серной кислоты служит любое сырье, содержащее серу: различные колчеданы, отходящие газы металлургических процессов, топочное газы, чистая сера и др.
Получение серной кислоты. Технологический процесс получения серной кислоты состоит из трех стадий.
Первой стадией производственного процесса является получение сернистого газа S02.
Сернистый газ выделяют из топочных газов или отходящих газов металлургических процессов сжиганием серы. При сжигании чистой серы, не содержащей ядовитых для катализатора примесей (мышьяк), получается газ, который может быть использован непосредственно (без очистки) для производства.
При сжигании кусковой серы применяются вращающиеся барабанные печи и неподвижные отражательные печи. Сжигание жидкой серы в распыленном состоянии проводят в неподвижных цилиндрических печах с разбрызгивающими форсунками.
При получении сернистого газа из колчедана его подвергают подготовке (дробление, просеивание, обогащение) и обжигу. Для обжига применяют печи различного типа (механические полочные, обжиг в кипящем слое и др.)
При сжигании колчедана с отходящим печным газом уносится некоторая часть колчедана и огарка в виде мельчайшей пыли. Отложение пыли на поверхности катализатора в контактных аппаратах ведет к понижению активности катализатора, а следовательно, и к понижению производительности аппарата.
В зависимости от вида катализатора и характера процесса существует два способа получения серной кислоты: башенный (нитрозный) и контактный.
Башенный (нитрозный) способ. В производстве H2S04 по нитрозному способу обжиговый газ предварительно освобождается только от механических примесей. Дополнительной очистки газа от химических примесей-ядов (мышьяка, селена и др.) не требуется. Очищенный от пыли таз поступает в систему при температуре 350 °С. Газ проходят последовательно через все башни системы, где про-исходит образование серной кислоты путем поглощения S03 водой. В качестве катализатора применяют раствор оксидов азота в серной кислоте (нитроза).
Контактный метод. Контактный метод производства был предложен в 1881 г. и реализован в промышленности 1875 г. В настоящее время он является основным при производстве серной кислоты.
Быстрое развитие контактного метода производства объясняется возможностью получения чистой концентрированной кислоты и олеума — продуктов, имеющих большое промышленное значение.
Производство серной кислоты контактным методом состоит из следующих основных стадий:
Очистка газов от примесей, вредных для процесса контактного окисления SO2 в S03.
Окисления S02 в SO3 на поверхности твердого катализатора.
Поглощение триоксид серы серной кислотой с получением концентрированной H2S04 и олеума (H2S04 + S03).
Нитрозный способ дает кислоту, загрязненную примесями и разбавленную, что ограничивает ее использование. При необходимости концентрирования этой кислоты резко возрастает расход топлива (для упаривания воды). Неполный возврат окислов азота приводит к постоянным затратам на дорогостоящую азотную кислоту, продукт более транспортабельный. Но расход колчедана, электроэнергии при данном способе несколько выше, чем при контактном, хотя башенные установки дешевле контактных, аппаратура контактного сернокислотного производства эксплуатируется более длительный срок и требует меньших затрат на ремонт.
studfiles.net
Серная кислота производство — Справочник химика 21
Хранение и разливка серной кислоты. Производство серной кислоты является непрерывным, поэтому готовая продукция — кислота поступает на хранение также непрерывно. Отгрузка же серной кислоты производится периодически, в связи с чем на каждом сернокислотном заводе имеется склад готовой продукции. [c.32]Такие важнейшие производственные процессы в области химической технологии, как синтез и окисление аммиака, контактное получение серной кислоты, производство этанола из природного газа, крекинг нефти, получение чугуна в доменных печах, производство алюминия и многие другие всецело основаны на результатах физико-химического исследования реакций, лежащих в основе этих процессов. [c.6]
Помимо хлора и серной кислоты, производство широкого ассортимента красителей требовало и других разнообразных химикатов, в особенности дешевой соды. Старый леблановский способ получения соды был единственным способом, применявшимся в производстве до 1870 г. В 1863 г. бельгийский химик Э. Сольвей (1838—1922) на основе открытой еще в 1811 г. (физиком и химиком О. Ж- Френелем) реакции хлорида натрия с гидрокарбонатом аммония разработал аммиачный способ производства соды, оказавшийся более дешевым и дающим более чистый продукт. Промышленное производство соды по этому методу началось в 1873 г. Каустическая сода (едкий натр) также стала производиться по новому методу — электролизом хлорида натрия. Получавшийся при этом хлор частично использовался для производства соляной кислоты. [c.268]
Общая характеристика элементов главной подгруппы VI группы периодической системы. Сера. Сероводород, сулы )иды. Оксиды серы (IV) и (VI), получение, свойства. Сернистая и серная кислоты, их свойства. Соли сернистой и серной кислот. Производство серной кислоты. [c.503]
Установлена возможность использования смесей моно- и дисульфокислот фенольных соединений, полученных сульфированием кубового остатка производства дифенилолпропана отработанной серной кислотой производства хлорамина-Б, в качестве сырья и полупродуктов для синтеза некоторых видов фенолоформальдегидных смол. [c.22]
Новые нефтехимические производства также являются крупными потребителями серной кислоты (производство спиртов), олеума или серного ангидрида (производство синтетических моюш,их веш еств, например сульфо-нолов). [c.536]
Так как гомологи этилена в общем лучше и полнее абсорбируются серной кислотой, производство, например, изопропилового спирта легче, чем синтез этанола. Кстати, первое промышленное получение изопропилового спирта было налажено в США [c.264]
Органические вещества, содержащиеся в отработанной серной кислоте производств бромэтила, метилметакрилата оказывают ингибирующее действие. [c.14]
При переработке книги авторы стремились не только осветить вопросы внедрения новой техники, методы интенсификации существующих и создания новых производств, но и, по возможности, показать перспективы дальнейшего развития основной химической промышленности на ближайшие годы. Наиболее существенно переработаны главы, посвященные технологии серы и серной кислоты, производству газов (азота, водорода, кислорода), технологии связанного азота, производству электролитического хлора и щелочей, переработке хлора, производству минеральных удобрений. Некоторые из этих разделов книги заново написаны или переработаны специалистами, дополнительно привлеченными в состав авторского коллектива. [c.9]
Максимальная утилизация производственных отходов с получением ценных продуктов, сводящая к минимуму образование сточных вод. Примером утилизации отходов является использование отработанной серной кислоты производства капролактама, содержащей органические примеси, для получения сульфата аммония натрия. До организации производства сульфата аммо- [c.258]
В этом случае использование кинофрагмента служит основой для более глубокого понимания сущности процессов и способствует уяснению вопросов промышленной переработки каменного угля. Кинофрагмент используют как источник новых знаний без предварительного изучения содержащихся в нем сведений на уроках, с последующим анализом и развитием полученных знаний. С таким назначением могут быть использованы фильмы Фтор и его соединения , Строение и свойства кристаллов , Стекло и цемент , Коррозия металлов (раздельно первая и вторая части), Применение кислорода в производстве стали телепередачи-экскурсии Водоочистительная станция , Производство серной кислоты , Производство алюминия и др. [c.143]
Несмотря на существенные преимущества контактного метода, башенная кислота сохраняет еще свое значение для производств, не требующих концентрированной и чистой серной кислоты (производство минеральных удобрений и др.). В случае необходимости башенную кислоту концентрируют путем упаривания. [c.64]
В качестве сульфирующего агента для синтеза сульфокислот предложено использовать отработанную серную кислоту производства хлорамина-Б, расположенного на одном с производством дифенилолропана предприятии (ОАО Уфахимпром ). Отработанная серная кислота содержит не менее 65% серной кислоты, до 12% бензол сульфокислоты и до 0,1% хлористого водорода, является крупнотоннажным промышленным отходом производства, который, по действующей технологии, после нейтрализации едким натром сбрасывается на биоочистные сооружения. [c.17]
Серная кислота производства диоксида титана, [c.95]
Проведенные исследования позволяют решить ряд практических вопросов. Так, использование НСО позволяет выделить h3 I OOH из отработанной серной кислоты производства молох лор уксусной кислоты. [c.51]
MOHO- и дисульфокислот фенольных соединений и
www.chem21.info
Производство серной кислоты
1. Товарные и определяющие технологию свойства серной кислоты.
Серная кислота — один из основных многотоннажных продуктов химической промышленности. Ее применяют в различных отраслях народного хозяйства, поскольку она обладает комплексом особых свойств, облегчающих ее технологическое использование. Серная кислота не дымит, не имеет цвета и запаха, при обычной температуре находится в жидком состоянии, в концентрированном виде не корродирует черные металлы. В то же время, серная кислота относится к числу сильных минеральных кислот, образует многочисленные устойчивые соли и дешева.
В технике под серной кислотой понимают системы, состоящие из оксида серы (VI) и воды различного состава: п SО3 · т Н2 О.
При п = т = 1 это моногидрат серной кислоты (100 % -ная серная кислота), при т > п – водные растворы моногидрата, при т < п – растворы оксида серы (VI) в моногидрате (олеум).
Моногидрат серной кислоты – бесцветная маслянистая жидкость с температурой кристаллизации 10,37 о С, температурой кипения 296,2 о С и плотностью 1,85 т/м3 . С водой и оксидом серы (VI) он смешивается во всех отношениях, образуя гидраты состава Н2 SО4 · Н2 О, Н2 SО4 · 2Н2 О, Н2 SО4 · 4Н2 О и соединения с оксидом серы Н2 SО4 · SО3 и Н2 SО4 ·2SО3 .
Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе ее товарных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации.
Температура кипения серной кислоты также зависит от ее концентрации, то есть состава системы «оксид серы (VI) – вода». С повышением концентрации водной серной кислоты температура ее кипения возрастает и достигает максимума 336,5 о С при концентрации 98,3 %, что отвечает азеотропному составу, а затем снижается. Температура кипения олеума с увеличением содержания свободного оксида серы (VI) снижается от 296,2 о С (температура кипения моногидрата) до 44,7 о С, отвечающей температуре кипения 100 %-ного оксида серы (VI).
При нагревании паров серной кислоты выше 400 о С она подвергается термической диссоциации по схеме:
400о С 700 о С
2 Н2 SО4 <=> 2Н2 О + 2SО3 <=> 2Н2 О + 2SО2 + О2 .
Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в три раза и составляет в настоящее время более 160 млн. т в год.
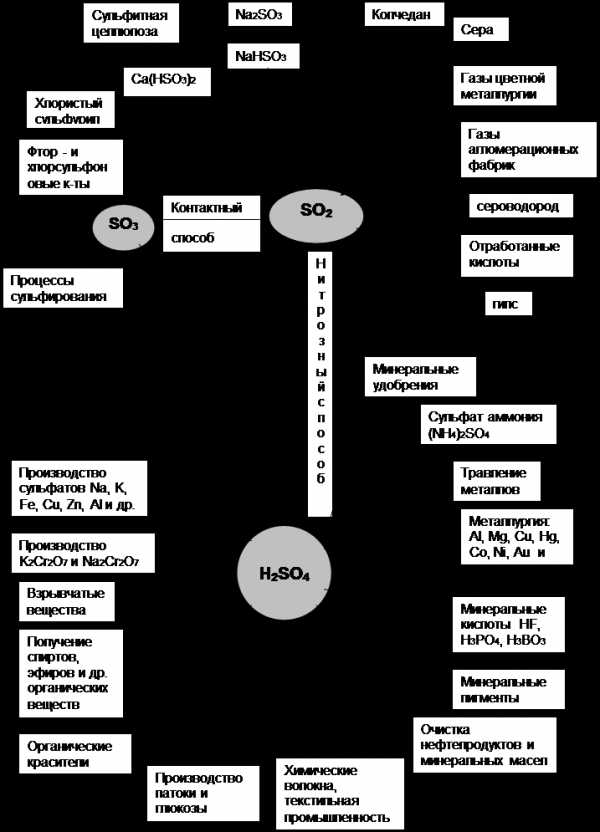
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), а также в производстве красителей (от 2 до 16 %), химических волокон ( от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности. На рис. 1 представлено применение серной кислоты и олеума в народном хозяйстве.
Рис. 1. Применение серной кислоты.
2. Сырьевые источники получения серной кислоты.
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серусодержащие соединения, из которых может быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя кларк ее равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов металлов и сульфатов метало, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы в топочных газах и газах цветной металлургии и в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники производства серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает.
В общей схеме сернокислотного производства существенное значение имеют две первые стадии – подготовка сырья и его сжигание или обжиг. Их содержание и аппаратурное оформление существенно зависят от природы сырья, которая в значительной степени, определяет сложность технологического производства серной кислоты.
3. Краткое описание современных промышленных способов получения серной кислоты. Пути совершенствования и перспективы развития производства.
Производство серной кислоты из серусодержащего сырья включает несколько химических процессов, в которых происходит изменение степени окисления сырья и промежуточных продуктов. Это может быть представлено в виде следующей схемы:
где I – стадия получения печного газа (оксида серы (IV)),
II – стадия каталитического окисления оксида серы (IV) до оксида серы (VI) и абсорбции его (переработка в серную кислоту).
В реальном производстве к этим химическим процессам добавляются процессы подготовки сырья, очистки печного газа и другие механические и физико-химические операции. В общем случае производство серной кислоты может быть выражено в следующем виде:
Сырье
подготовка сырья сжигание (обжиг) сырья очистка печного газа контактирование абсорбцияконтактированного газа
СЕРНАЯ КИСЛОТАКонкретная технологическая схема производства зависит от вида сырья, особенностей каталитического окисления оксида серы (IV), наличия или отсутствия стадии абсорбции оксида серы (VI).
В зависимости от того, как осуществляется процесс окисления SО2 в SО3 , различают два основных метода получения серной кислоты.
В контактном методе получения серной кислоты процесс окисления SО2 в SО3 проводят на твердых катализаторах.
Триоксид серы переводят в серную кислоту на последней стадии процесса – абсорбции триоксида серы, которую упрощенно можно представить уравнением реакции:
SО3 + Н2 О
Н2 SО4При проведении процесса по нитрозному (башенному) методу в качестве переносчика кислорода используют оксиды азота.
Окисление диоксида серы осуществляется в жидкой фазе и конечным продуктом является серная кислота:
SО3 + N2 О3 + Н2 О
Н2 SО4 + 2NОВ настоящее время в промышленности в основном применяют контактный метод получения серной кислоты, позволяющий использовать аппараты с большей интенсивностью.
Рассмотрим процесс получения серной кислоты контактным методом из двух видов сырья: серного (железного) колчедана и серы.
1) Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
— окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FеS2 + 11О2 = 2
mirznanii.com
Производство серной кислоты из серы
Московская Государственная Академия
Тонкой Химической Технологии
Имени М.В. Ломоносова
Курсовая Работа
По дисциплине: Основы Химической Технологии
На тему:
Производство серной кислоты из серы.
Преподаватель: Игумнов Михаил Степанович
Студент : Троян Наталья Сергеевна
Группа М-32
Москва.1999
Содержание
Введение……………………………………………………………………………. 3
Исходное сырье………………………………………………………………. 7
Характеристика целевого продукта……………………………. 8
Химическая схема процесса………………………………………. 10
1.Сжигание серы. ………………………………………………………………. 10
2. Контактное окисление SO2 в SO3 …………………………………….. 11
3.Абсорбция триоксида серы. …………………………………………….. 12
Задание для расчета…………………………………………………….. 14
Выполнение расчета…………………………………………………….. 15
1.Составляем блок-схему производства. ……………………………. 15
2. Составление уравнений по каждому узлу. ……………………….. 16
3.Материальный баланс. ……………………………………………………. 19
Список литературы……………………………………………………….. 20
Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260 – 336,5*С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д. Наиболее важные области применения серной кислоты отражены на схеме.
Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4 , поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2 в SO3 в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2 , высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2 . Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту.
За последние годы в процессе производства серной кислоты внесены существенные улучшения. Широко применяется обжиг колчедана в кипящем слое и сжигание серы в циклонной печи, значительно увеличивается использование тепла, выделяющегося приобжиге сырья, и на других стадиях производства серной кислоты. Непрерывно повышается производительность башенных сернокислотных систем в результате поддержания оптимального технологического режима, разработанного на основе исследований; интенсивность башенных систем достигает 250 кг/м3 в сутки. Освоен контактно-башенный процесс производства серной кислоты, при котором расход HNO3 составляет 6 – 7 кг на 1 тонну H2 SO4 .
В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом.
В качестве катализаторов контактного процесса теперь применяется термически стойкая ванадиевая контактная масса (в виде гранул и колец) с пониженной температурой зажигания. Проведены работы по освоению процесса окисления SO2 в кипящем слое катализатора. Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO2 на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов.
Внедряется процесс конденсации H2 SO4 , заменяющий абсорбцию серного ангидрида.
Также для производства серной кислоты используют ангидрид или безводный сульфат кальция CaSO4 , гипс или двуводную соль CaSO4 *2H2 O и фосфогипс, представляющий собой отход производства концентрированных фосфорных удобрений (смесь гипса, соединений фтора, окислов фосфора, SO2 и других примесей).
В нитрозном способе катализатором служат оксиды азота. Окисление SO2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным . Сущность нитрозного метода состоит в том, что обжиговый газ обрабатывается серной кислотой, в которой растворены окислы азота. Сернистый ангидрид обжигового газа поглощается нитрозой, и затем окисляется окислами азота по реакции: SO2 + N2 O3 + H2 O = H2 SO4 + 2NO. Образующийся NO плохо растворим в нитрозе и выделяется, а затем частично окисляется кислородом до NO2 . Смесь NO и NO2 вновь поглощается H2 SO4 .
Промышленность выпускает три вида товарной серной кислоты:
Башенная кислота: С=75%, tкрист = -29,5*С
Контактная кислота: С=92,5%, tкрист = -22,0*С
Олеум: С=20% своб. SO3 , tкрист = +2*С
Схема применения серной кислоты
Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты в СССР получали из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. В атмосферу с отходящими газами тепловых электростанций и металлургических заводов выбрасывается диоксида серы значительно больше, чем употребляется для производства серной кислоты. Из-за низкой концентрации SO2 в таких отходящих газах их переработка пока еще не всегда осуществима.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Серная кислота может существовать как самостоятельное химическое соединение H2 SO4 , а также в виде соединений с водой H2 SO4 *2H2 O, H2 SO4 *H2 O, H2 SO4 *4H2 O и с триоксидом серы H2 SO4 *SO3 , H2 SO4 *2SO3 .
В технике серной кислотой называют и безводную H2 SO4 и ее водные растворы (по сути дела, это смесь H2 O, SO2 и соединений H2 SO4 *nH2 O) и растворы триоксида серы в безводной H2 SO4 – олеум (смесь H2 SO4 и соединенийH2 SO4 *nSO3 ).
Безводная серная кислота – тяжелая масляни
mirznanii.com
2. Производство серной кислоты
Серную кислоту не случайно называют «хлебом» химической промышленности. Она используется в производстве других кислот, химических волокон, цветных металлов, при мойке шерсти. В основном кислоту применяют в выпуске фосфорных удобрений. Многоплановое ее применение обусловлено сильной химической активностью, дешевизной производства, удобствами использования — не дымит, не выделяет запаха, а в концентрированном виде не разрушает черные металлы.
Сырьем для производства серной кислоты могут быть различные серосодержащие вещества, но наибольшее практическое значение имеют колчедан, элементарная сера, сернистые газы цветной металлургии, сжигания угля, очистки нефти. Колчедан получают в основном как побочный продукт флотационного обогащения. Он имеет низкую себестоимость, хорошую транспортабельность, что делает его основным сырьем в сернокислотном производстве. Основу флотационного колчедана составляет пирит (FeS2), содержащий до 45% железа и серу. В нем имеются также сульфиды мышьяка, селена и др., которые образуют газообразные соединения, попадают в сернистые газы и ухудшают их качество. Поэтому сернистые газы требуют дополнительной очистки, что усложняет технологическую схему производства. Достаточно распространенное сырье — элементарная сера. Она наиболее концентрированный серосодержащий ресурс. В результате более эффективны дальние перевозки, снижается расход сырья на выпуск единицы продукции более чем в 2 раза по сравнению с колчеданом. Процесс производства кислоты проще, требует меньших удельных капвложений, экологичнее. Чистая сера имеет достаточную тепловую способность (10000 кдж/кг), что позволяет при получении сернистого газа использовать ее не только как сырье для кислоты, но и как источник энергии в теплоэнергоблоках для собственных производственных целей и поставки другим потребителям (рис.1).Однако запасы элементарной серы в природе ограничены, а
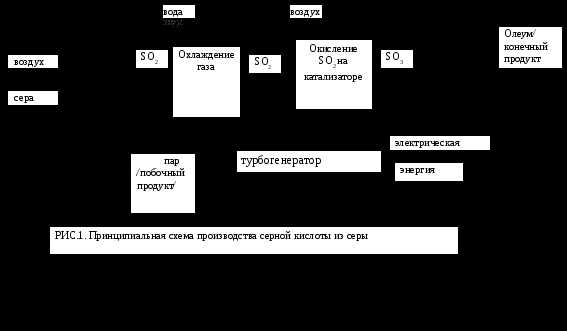
Сжигание серы
абсорбция SO3 и образование серной кислоты
Серная кислота
себестоимость ее добычи высокая. Это обусловливает повышенную стоимость конечного продукта по сравнению с кислотой, полученной из колчедана. Наиболее эффективное сырье для выпуска кислоты — сернистые газы цветной металлургии, очистки нефти, сероводород природного газа. Себестоимость тонны кислоты из них в 2,5 — 6 раз меньше, чем из элементарной серы и колчедана, сам процесс достаточно экологичен, а в окружающую среду в результате утилизации серы не попадают вредные соединения. Техногенные выбросы серы в атмосферу вдвое превышают ее мировую добычу в качестве сырья для промышленности.
Значительные запасы серы в сульфатах — гипсе, ангидриде. Однако эти виды сырья менее эффективны из-за больших энергетических затрат в производстве.
Исходным этапом производства серной кислоты является получение сернистого ангидрида (SO2). Для этого колчедан дробят, обжигают в многоподовых печаx, в кипящем слое, как и в металлургическом процессе. При этом газы составляют основной продукт, а оксиды железа — побочный. Образуется так называемый огарок — твердые отходы, содержащие окислы железа, как и в богатых железных рудах, а также незначительную часть невыгоревшей серы (до 2%) и минеральные примеси. Каждый кубический метр сернистых газов содержит до 300 г пыли, а также мышьяк, селен, теллур, фтор и другие вещества, которые загрязняют кислоту, снижают активность катализатора. Поэтому газы обжига колчедана очищают (рис. 2). При использовании высококачественного сырья с практическим отсутствием примесей — элементарной серы, сероводорода — сжигание проводится через форсунки в более простых печах. В этом случае не образуется огарок, а сернистые газы без предварительной очистки применяются в выпуске кислоты, что упрощает технологический процесс, повышает его экологичность (рис.1,3). В производстве кислоты из газов цветной металлургии отсутствует стадия обжига, а сернистые газы в производстве используются после предварительной очистки. Это уменьшает удельные капитальные вложения при создании сернокислотных предприятий.
Основная сложность сернокислотного производства — получение из сернистого ангидрида серного (S03), так как взаимодействие сернистых газов с кислородом в обычных условиях осуществляется медленно и для промышленных процессов не приемлемо. В зависимости от метода ускорения отмеченной химической реакции существуют способы получения кислоты: контактный и нитрозный. При нитрозном способе в качестве ускорителя реакции применяют двуокись азота, которая отдает кислород сернистым газам и превращается в окись азота. Последняя вновь окисляется кислородом воздуха до двуокиси и взаимодействует с сернистыми газами. Серный ангидрид соединяется с водой и образует 75% кислоту, которую упаривают до товарного продукта, содержащего 98,5% кислоты. Этот процесс проводят в специальных металлических
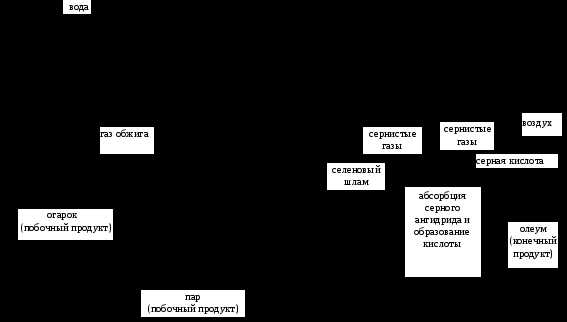
Обжиг колчедана
Охлаждение газа
Очистка газа от пыли
Промывка и сушка газа
подогрев газа
Окисление сернистого ангидрида в серный на катализаторе
колчедан
воздух
сернистый ангидрид
РИС. 2. Принципиальная схема производства серной кислоты
башнях, футерованных кислотоустойчивым кирпичом. Поэтому нитрозный способ называют еще башенным.
Контактный способ основан на окислении сернистых газов воздухом, кислородом в присутствии ванадиевого катализатора в контактных аппаратах. Серный ангидрид направляют в абсорбционные башни, куда подается концентрированная серная кислота. Она поглощает серные газы и образуется 100% серная кислота, в которой избыточно растворим ангидрид (Н2S04 • nSО3). Этот продукт называют олеумом. Рассмотренный способ прогрессивнее по сравнению с нитрозным. При контактном получении кислоты — скорость окисления выше, особенно при использовании кислорода, что повышает единичную производительность оборудования, лучше качество конечного продукта, а производство — экологичнее (меньше выбросов окислов азота). В технологическом процессе практически не расходуют топливо. Поэтому подавляющую часть серной кислоты вырабатывают контактным методом.
Размещение сернистого производства обусловлено особенностями сырьевых ресурсов и имеет в зависимости от этого ориентацию на сырье или центры потребления. При использовании сернистых газов промышленности предприятия ориентированы на центры переработки нефти, цветной металлургии как комбинированные производства на основе утилизации отходов и имеют сырьевую ориентацию (Новополоцк). Здесь могут создаваться также предприятия-потребители серной кислоты, выпускающие фосфорные удобрения (Ревда — Россия, Алаверди — Армения и др.). Получение кислоты из колчедана, элементарной серы имеет территориальную ориентацию на пункты потребления как нематериалоемкое производство (Гомель). На 1 т 100% серной кислоты расходуют около 800 кг колчедана или 350 кг элементарной серы, 0,1 кг контактной массы, 100 кВт•ч электрической энергии и 50 куб.м воды. Такое влияние потребителя на размещение предприятий усиливается также худшей транспортабельностью готовой продукции по сравнению с сырьем. Перевозка кислоты требует специальных транспортных средств, упаковки, соблюдения более сложных условий безопасности.
studfiles.net
Производство концентрирование серной кислоты — Справочник химика 21
Сульфирование — замещение водорода в бензольном ядре сульфогруппой—применяют для получения сульфокислот, являющихся промежуточными продуктами при синтезе ряда фенолов методом щелочного плавления, а также иопользуемых в производстве различных красителей. Обычно реакцию осуществляют нагреванием ароматического углеводорода с концентрированной серной кислотой, например [c.26]Сероводород НзЗ является типичным восстановителем. В своих кислородных соединениях элементы этой подгруппы проявляют степень окисления +4 и +6, что соответствует оксидам КОз и КОз. Сернистый газ проявляет как окислительные, так и восстановительные свойства. Эти же свойства характерны и для сернистой кислоты. В производстве серной кислоты оксид серы (VI) 80 3 получают контактным методом, поэтому этот метод называется контактным. Серная кислота двухосновна и образует два типа солей — сульфаты и гидросульфаты. Концентрированная серная кислота при нагревании взаимодействует со многими металлами, расположенными в электрохимическом ряду напряжений металлов после водорода. Разбавленная серная кислота взаимодействует с металлами, стоящими в этом ряду перед водородом. [c.214]
Экстракционная фосфорная кислота содержит не более 36% Н3РО4. Для большинства способов производства двойного суперфосфата и других удобрений необходимо уиаривать кислоту до более высокой концентрации (50—80% Н (Р04). Концентрирование фосфорной кислоты осложнено коррозией аинаратуры и выпадением осадков сульфата кальция и других примесей на греющих поверхностях. Поэтому чаще всего для концентрирования фосфорной кислоты применяют барабанные барботажные концентраторы, в которых нагрев производится непосредственным соприкосновением упариваемой кислоты с топочными газами так же, как при концентрировании серной кислоты. Разработаны способы азотнокислотного разложения фосфоритов с получением комплексных удобрений. [c.151]
Содовым раствором при 105° этиленхлоргидрин практически количественно омыляется в этиленгликоль. При нагревании с концентрированной серной кислотой до 90—100° образуется р, Р -дихлордиэтиловый эфир (хло-рекс), применяемый в качестве селективного растворителя в производстве нефтяных смазочных масел. Небольшие количества хлорекса образуются также как побочный продукт при хлоргидринировании этилена но реакциям [c.184]
Использование отбросного сероводородного газа, получающегося в результате мокрой очистки коксового газа от сероводорода, для производства концентрированной серной кислоты является чрезвычайно важной задачей. Решение этой задачи позволяет непосредственно на коксохимическом заводе получать весьма необходимую серную кислоту в количествах, покрывающих полностью потребность завода для производства сульфата аммония, переработки сырого бензола на чистые продукты ректификации и переработки каменноугольной смолы. [c.225]
Поступающая в производство концентрированная серная кислота хранится в цистернах из незащищенной углеродистой стали, которые эксплуатируются без ремонта свыще 7 лет. Разбавление кислоты водой до 20—40%, сопровождающееся повышением температуры до 50—60° С производят в эмалированном аппарате. Для этой цели можно использовать и гуммированный или оклеенный листовым полиизобутиленом ПСГ аппарат, приняв меры, предупреждающие попадание концентрированной кислоты на неметаллическую обкладку (рис. 6.1). [c.343]
На рис. 18 изображена схема производства концентрированной серной кислоты из сероводородного газа низкой концентрации (3—6% Н.,8). Сероводородный газ поступает в верхнюю часть печи /, ку. Я одновременно добавляется воздух, подогретый в [c.50]
До возникновения контактного способа производства концентрированную серную кислоту получали разложением купоросного сланца. [c.39]
Для сульфирования ароматических соединений применяют главным образом концентрированную серную кислоту, олеум и серный ангидрид. Сульфирование ароматических соединений проводят в аппаратах периодического действия с мешалками и охлаждающими рубашками, змеевиками или с дополнительной выносной теплообменной аппаратурой. В многотоннажных производствах процессы сульфирования проводят непрерывна в каскаде реакторов с мешалками. В реакторах поддерживают различную температуру в соответствии с изменением концентрации и готовности сульфирующего агента. [c.109]
Для получения 1 т спирта на абсорбцию идет около 2 т концентрированной серной кислоты, а затем приходится упаривать уже 4 т разбавленной кислоты. Такой кислотооборот осложняет производство и вызывает значительные трудности из-за сильной коррозии и тял елых условий труда. По сернокислотному методу из 1 т этилена вырабатывается 1,2 т спирта-ректификата и около 100 кг этилового эфира. Превращение этилена в спирт достигает 90%. [c.171]
С водой НЫОз смешивается в любых отношениях. Его растворы — сильная кислота, называемая азотной. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство НЫОз осуществляется по стадиям окисление НзЫ в ЫО кислородом воздуха на платиновом катализаторе [c.400]
В начале XIX в. при производстве сульфата натрия действием концентрированной серной кислоты на поваренную соль последовали жалобы инструменты ремесленников, живших в окрестности таких заводов, быстро портились, а растительность гибла. Пытались выпускать газообразный побочный продукт реакции (какой ) в атмосферу с помощью труб высотой до 300 м, но вредные действия этого вещества продолжались, особенно в сырую погоду. Подробно проанализируйте все изложенное и объясните причины. [c.55]
Серную кислоту применяют также при производстве фосфорных удобрений и сульфата аммония, используемого в качестве удобрения. Кроме того, серная кислота используется для сннтеза многих сульфатов, многих лекарственных препаратов, для очистки растительных масел, жиров. Концентрированная серная кислота, обладающая- сильной способностью поглощать воду, может быть использована- для осушки газов, не реагирующих с ней. [c.297]
www.chem21.info
