Киса та изготовление – Производство неорганических кислот
Производство неорганических кислот
Большую часть веществ, применяемых во многих отраслях народного хозяйства, составляют неорганические вещества — кислоты, щелочи, соли, окислы; продукты металлургии; строительной индустрии — цементы, керамики, стекло; других отраслей, имеющих важное значение для страны.
Немалое место среди этих веществ занимают кислоты — серная, азотная, соляная, фосфорная и другие.
Наиболее широкое применение находит серная кислота — фундамент химической промышленности, так как почти нет ни одной отрасли химического производства, в которой бы она не применялась.
Не менее важное значение имеет азотная и соляная кислоты.
Все это объясняется широким диапазоном их свойств, необходимых для осуществления многих процессов.
Под названием «серная кислота» в технике подразумеваются любые смеси триоксида серы с водой. Моногидрат, или безводная серная кислота H2S04, — тяжелая маслянистая жидкость, смешивающаяся с водой в любых соотношениях; плотность 1,83 г/см3, температура кипения 296,2 °С, при дальнейшем нагревании разлагается на S03 и Н20, кристаллизуется при температуре +10,45 0С.
Промышленность выпускает несколько сортов серной кислоты, отличающихся концентрацией основного вещества и содержанием примесей. Основные сорта серной кислоты: 65-процентная — камерная, 75-процентная — башенная, 98-процентная — купоросное масло, олеум, 100-процентная — химически чистая, аккумуляторная и др.
Высокая активность серной кислоты и сравнительно небольшая стоимость определяют огромные масштабы производства и чрезвычайно разнообразное применение почти во всех отраслях народного хозяйства.
Наиболее крупным потребителем серной кислоты является производство минеральных удобрений — супер-фосфата, сульфата аммония и др. В металлообрабатывающей промышленности серная кислота применяется для снятия ржавчины с поверхности черных металлов при подготовке их к защитным или декоративным покрытиям лаками и цветными металлами. Большое количество серной кислоты расходуется на очистку нефтепродуктов. Производство красителей, лаков, красок, лекарственных веществ, некоторых пластических масс, многих ядохимикатов, эфиров, спиртов было бы невозможно в современных масштабах без серной кислоты. Разбавленные растворы серной кислоты или ее солей применяют в производстве искусственного шелка, в текстильной промышленности. В пищевой промышленности серная кислота используется для приготовления крахмала, патоки и других продуктов.
В процессах нитрирования для производства многих органических соединений, в том числе и большинства взрывчатых веществ, также применяется серная кислота.
Сырье.
Получение серной кислоты. Технологический процесс получения серной кислоты состоит из трех стадий.
Первой стадией производственного процесса является получение сернистого газа S02.
Сернистый газ выделяют из топочных газов или отходящих газов металлургических процессов сжиганием серы. При сжигании чистой серы, не содержащей ядовитых для катализатора примесей (мышьяк), получается газ, который может быть использован непосредственно (без очистки) для производства.
При сжигании кусковой серы применяются вращающиеся барабанные печи и неподвижные отражательные печи. Сжигание жидкой серы в распыленном состоянии проводят в неподвижных цилиндрических печах с разбрызгивающими форсунками.
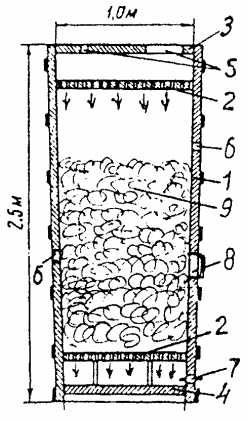
При получении сернистого газа из колчедана его подвергают подготовке (дробление, просеивание, обогащение) и. обжигу. Для обжига применяют печи различного типа (механические полочные, обжиг в кипящем слое и др.)
При сжигании колчедана, с отходящим печным газом уносится некоторая часть колчедана и огарка в виде мельчайшей пыли.
Отложение пыли на поверхности катализатора в контактных аппаратах ведет к понижению активности катализатора, а следовательно, и к понижению производительности аппарата.
В серно-кислотной промышленности применяют механический и электрический методы очистки газа от пыли.
При механической очистке в качестве пылеочистительных аппаратов применяют циклоны. Циклоны применяются для предварительной очистки печных газов от крупных частиц и пыли.
Для тонкой очистки применяется очистка в электрофильтрах. После электрофильтра пыли остается 0,04-0,1 г/м3.
Для тонкой очистки сернистого газа от вредных газообразных примесей (соединений мышьяка, селена) применяют мокрый электрофильтр, в котором используются жидкие химические реагенты, поглощающие эти примеси.
Вторая стадия — окисление сернистого газа до триоксида серы — протекает в присутствии катализатора, особенность которого в том, что он непрочно удерживает кислород и легко отдает его сернистому газу. В зависимости от вида катализатора и характера процесса существует два способа получения серной кислоты: башенный (нитрозный) и контактный.
Башенный
(нитрозный) способ. В
производстве H2SO4 по нитрозному способу обжиговый газ
предварительно освобождается только
от механических примесей. Дополнительной
очистки газа от химических примесей-ядов
(мышьяка, селена и др.) не требуется.
Очищенный от пыли газ поступает в систему
при температуре 350 °С. Газ проходит
последовательно через все башни системы,
где происходит образование серной
кислоты путем поглощения S0
Контактный метод. Контактный метод производства был предложен в 1831 г. и реализован в промышленности в 1875 г. В настоящее время он является основным при производстве серной кислоты.
Быстрое развитие контактного метода производства объясняется возможностью получения чистой концентрированной кислоты и олеума — продуктов, имеющих большое промышленное значение.
Производство серной кислоты контактным методом состоит из следующих основных стадий:
1. Очистка газов от примесей, вредных для процесса контактного окисления S02 в SO3.
2. Окисления S02 в S03 на поверхности твердого катализатора.
3. Поглощение трехокиси серы серной кислотой с получением концентрированной H2S04 и олеума (H2S04 + SOs).
Нитрозный способ дает кислоту, загрязненную примесями и разбавленную, что ограничивает ее использование. При необходимости концентрирования этой кислоты резко возрастает расход топлива (для упаривания воды). Неполный возврат окислов азота приводит к постоянным затратам на дорогостоящую азотную кислоту, продукт более транспортабельный. Но расход колчедана, электроэнергии при данном способе несколько выше, чем при контактном, хотя башенные установки дешевле контактных, аппаратура контактного сернокислотного производства эксплуатируется более длительный срок и требует Меньших затрат на ремонт.
Технология производства азотной кислоты
Аммиак и азотная кислота
Соединения
азота играют важную роль в народном
хозяйстве. Они входят в состав
минеральных удобрений, пластических
масс, искусственных волокон, красителей,
лаков, взрывчатых веществ, кислот и
многих других продуктов. Но элементарный
азот инертен, он трудно вступает в
соединения. Чтобы использовать азот,
его сначала необходимо связать с
другими элементами, получить связанный
азот, а затем эти простейшие соединения
превратить в более сложные. Наиболее
рентабельным способом получения
связанного азота является его синтез
с водородом в виде аммиака NH
N2 + 3H2 t; 2NH3 + Q
Процесс производства аммиака включает две стадии:
1. Получение азота и водорода.
2. Синтез азото-водородной смеси.
Необходимый для синтеза аммиака, азот получают из воздуха. Чтобы выделить азот из воздуха, последний подвергают глубокому охлаждению и ректификации и сжижению. При испарении жидкого воздуха выделяют азот.
Водород производят несколькими способами:
1.
Конверсией (взаимодействием) окиси
углерода с водяным паром (СО + Н20  С02 + Н2),
используя при этом генераторный и
водяной пар.
С02 + Н2),
используя при этом генераторный и
водяной пар.
2. Конверсией метана — природного газа и окиси углерода.
3. Глубоким охлаждением комового газа, содержащего около 60% водорода.
4. Электролизом водных растворов и солей.
Наибольшее распространение получили конверсионные способы.
Синтез аммиака можно осуществить с применением катализатора при температуре 450-550 °С и давлении. Скорость этой реакции зависит от температуры, давления, концентрации азота и водорода, содержания в них примесей и ряда других факторов.
Полученные тем или иным способом азот и водород, пройдя тщательную очистку, смешиваются в пропорции 1:3. Смесь газов поступает в колонну синтеза. Она представляет собой стальной цилиндр с толстыми стенками. Высота колонны до 13 метров, диаметр 1—2 метра. В ее верхней части расположен контактный аппарат, заполненный катализатором, а в нижней — теплообменник. В качестве катализатора чаще всего используют губчатое железо е добавкой активаторов (алюминий и кальций).
Азотно-водородная смесь с температурой 20-30 °С, подаваемая в колонну, проходит теплообменник, где подогревается, а затем попадает в контактный узел. Проходя через слой катализатора, азот соединяется с водородом, при этом в аммиак превращается только 18-20% смеси. При выходе из колонны аммиак и непрореагировавшая часть смеси попадает в холодильник, в котором газообразный аммиак конденсируется. В газоотделителях жидкий аммиак отделяется, а оставшаяся азотно-водородная смесь вновь подается компрессором в колонну на синтез (с добавкой новой порции газов).
Большая часть получаемого аммиака расходуется на производство азотной кислоты, удобрений, соды и ряда органических соединений.
Свойства и сорта азотной кислоты
Чистая азотная кислота HNO3, при обыкновенной температуре представляет собой бесцветную жидкость, замерзающую при — 41 °С с образованием белоснежных кристаллов. Водные растворы азотной кислоты в зависимости от концентрации кристаллизуются при различных температурах.
Азотную кислоту используют в огромных количествах для производства минеральных удобрений, взрывчатых веществ и других продуктов. Много азотной кислоты расходуется в производстве серной кислоты по нитрозному методу.
Промышленность выпускает разбавленную (слабую) азотную кислоту трех сортов (1-й — 55%, 2-й — 47%, 3-й — 45%) и концентрированную (крепкую) азотную кислоту двух сортов (1-й — 98%, 2-й — 97%).
Производство азотной кислоты окислением аммиака
Процесс получения азотной кислоты окислением аммиака включает три стадии:
1. Контактное окисление аммиака до окиси азота NO.
2. Окисление окиси азота до двуокиси азота NO2,.
3. Абсорбция (поглощение) двуокиси азота водой с образованием азотной кислоты HN03.
Получают азотную кислоту в специальных установках.
Окисление аммиака кислородом воздуха происходит в контактном аппарате при температуре 800 °С в присутствии катализатора (сплав платины с родием, окись кобальта или железа и др.). Предварительно аммиак и воздух тщательно очищают и подают в смеситель. Затем воздушно-аммиачную смесь, содержащую 10-12% аммиака NH3, после подогрева подают в контактный аппарат, где происходит реакция:
4NH3 + 502 = 4NO + 6Н20 + Q
Окисление полученной окиси азота, идет по реакции:
2NO + 02 = 2N02 + Q
Образовавшиеся газы при температуре 800 °С поступают в котел-утилизатор, охлаждаясь до 250 °С и далее — в холодильник, где дополнительно охлаждаются до 30 °С.
Абсорбция образовавшейся двуокиси азота водой протекает по следующей реакции:
3N02 + Н20 = 2HN03 + NO + Q
Прямой синтез концентрированной азотной кислоты.
Прямой синтез концентрированной азотной кислоты заключается во взаимодействии жидкой четырехокиси азота с водой в присутствии газообразного кислорода.
Реакция образования азотной кислоты протекает следующим образом:
2N204 + 2Н20 + 02 = 4HN03 + Q
Прямой синтез позволяет получать крепкую (концентрированную) азотную кислоту.
Технология производства пиломатериалов
studfiles.net
Производство пищевых органических кислот
Пищевые органические кислоты используются в ряде отраслей пищевой промышленности (кондитерской, консервной, при производстве безалкогольных напитков и др.) для придания изделиям определенного вкуса. Кроме того, они широко применяются в фармацевтической, химической, текстильной, кожевенной и других отраслях промышленности. В пищевой промышленности наибольшее применение находят лимонная, уксусная и молочная кислоты.
Производство уксусной кислоты
Уксусную кислоту можно получить брожением и химической обработкой продуктов сухой перегонки дерева. Пищевую уксусную кислоту получают главным образом брожением.
Возбудителем брожения являются уксуснокислые бактерии, которые окисляют этиловый спирт в уксусную кислоту. Процесс окисления этилового спирта в уксусную кислоту проходит в две стадии. Вначале этиловый спирт окисляется в уксусный альдегид, который при дальнейшем окислении превращается в уксусную кислоту:
или суммарно: 2СН3СН2ОН + О2 → СН3СООН + Н2О + 117 ккал
При производстве используют из многих видов бактерий бактерии Шюценбаха и бактерии курвум.
Для уксуснокислых бактерий благоприятна кислая среда (pH 3,0). Оптимальная температура для бактерий курвум 35-37°С, для бактерий Шюценбаха — 28°С. Уксуснокислое брожение является аэробным процессом, для этого среда продувается воздухом. Для нормальной жизнедеятельности уксуснокислых бактерий и нормального брожения сбраживаемое сусло должно содержать воду, этиловый спирт, уксусную кислоту, а также питательные вещества: сахар, сернокислый аммоний, суперфосфат.
Сырьем для производства уксуса является спирт, получаемый из зерно-картофельного сырья. Уксус, полученный из спирта-сырца, более ароматичный, чем из ректификата, однако непостоянное количество сивушного масла в спирте-сырце приводит к нарушению технологического процесса.
Уксус можно производить двумя основными способами: медленным и скорым; последний может быть периодическим или непрерывным, который и применяется в большинстве случаев.
Непрерывный способ производства уксуса
Брожение протекает в окислительных генераторах (рисунок 1), которые изготавливаются из дубовой клепки и имеют форму усеченного конуса, обращенного широким основанием вверх. Внутренняя поверхность генератора покрыта пивной смолкой или парафином. На расстоянии 20 см от крышки внутри чана имеется деревянное сито с отверстиями диаметром 3-5 см. Это сито равномерно распределяет вводимое в генератор сусло. На высоте 20-25 см от дна находится дырчатое (ложное) дно, через отверстия которого стекает готовый уксус. В нижней части по окружности чана, непосредственно под ложным дном, находятся отверстия для доступа свежего воздуха. В настоящее время вместо деревянных генераторов применяют стеклянные, эмалированные, керамические, железобетонные с кислотостойким покрытием.
 1 — корпус; 2 — дренажные перегородки; 3 — верхняя крышка; 4 — дно; 5 — люк и отверстие для ввода сырья; 6 — отверстие для подачи воздуха; 7 — отверстие для слива кислоты; 8 — люк-лаз; 9 — стружка
1 — корпус; 2 — дренажные перегородки; 3 — верхняя крышка; 4 — дно; 5 — люк и отверстие для ввода сырья; 6 — отверстие для подачи воздуха; 7 — отверстие для слива кислоты; 8 — люк-лаз; 9 — стружкаРисунок 1 — Окислительный генератор
Внутреннее пространство генератора заполняется буковыми стружками. Стружки сверху орошаются суслом, а снизу продуваются воздухом. Свежие стружки, загруженные в генератор, подкисляются уксусной кислотой, чтобы устранить возможность развития посторонних микроорганизмов. Для этого через стружку пропускают уксус концентрацией 9% до тех пор, пока концентрация уксуса в стекающей из генератора кислоты не будет равной концентрации заливаемого уксуса. Вместе с уксусом в чан вводят уксуснокислые бактерии. Продолжительность процесса подкисления составляет 8-10 сут. При этом на подкисление 1 м3 стружки расходуется около 400 л уксуса. После окончания подкисления открывают воздушные отверстия в чане и начинают заливку сусла. В состав сусла входит 3-4%-ный раствор этилового спирта и 6-7%-ный раствор уксусной кислоты. Кроме того, для нормального развития бактерий сусло должно содержать необходимые питательные вещества (углеводы, азотистые, минеральные вещества). Сусло поступает в верхнюю часть генератора и по стружке медленно стекает вниз. Снизу вверх продувается воздух. Уксусные бактерии окисляют спирт в уксусную кислоту и из нижней части чана стекает 9-10%-ный раствор уксуса. В начале брожения заливают сусло, подогретое до необходимой температуры ( 25-30°С).
Уксуснокислое брожение является экзотермическим процессом: 1 кг безводного спирта при окислении в уксусную кислоту выделяет 2490 ккал тепла. При этом температура сусла повышается и может прекратиться жизнедеятельность уксуснокислых бактерий и брожение. Тепло отводится охлаждением поверхности чанов. Температура для этого в помещении должна быть 18-20°С.
Скорый способ производства уксусной кислоты — типичный непрерывный процесс, при котором один раз заряженный генератор может работать много лет без перемены стружек. Теоретический выход уксусной кислоты составляет 103 кг из 100л безводного спирта. Практический выход — 73-75 кг из 100л безводного спирта.
Циркуляционный способ производства уксуса
При производстве уксуса непрерывным способом сусло через генератор проходит один раз. При этом количество уксусной кислоты в исходном продукте повышается на 3%. При циркуляционном способе сусло опять после первого прохода через генератор возвращается несколько раз до тех пор, пока не будет окислен весь спирт. При этом способе сусло состоит из смеси воды, спирта и питательных веществ без добавления уксуса. Количество питательных веществ увеличивается в два раза по сравнению с непрерывным способом.
Процесс окисления длится 5-6 сут. После окончания окисления спирта весь уксус выкачивается из генератора, а в генератор задается свежее сусло. Между напорным чаном сусла и генератором устанавливается теплообменник, что позволяет поддерживать температуру брожения около 30°С в верхней части генератора, и — 33-34°С в нижней.
При циркуляционном способе генератор не связан с атмосферой, так как воздух нагнетается компрессором. Это улучшает санитарные условия и уменьшает потери уксуса на испарение. Выход уксуса увеличивается до 85-90 кг из 100 л спирта.
Обработка и розлив уксуса
Полученный уксус осветляют и фильтруют. Осветляют уксус с помощью желатина, рыбьего клея или активного угля. Обработанный уксус отстаивают в течение нескольких суток, затем осветленный уксус осторожно сливают, а оставшийся осадок фильтруют.
Осветленный уксус разливают в дубовые бочки и выдерживают в лагерном отделении не менее двух месяцев. Разливают уксус в бутылки и бочки.
Уксус, полученный в результате брожения, можно сконцентрировать до 70-80%-ной уксусной кислоты. Такая кислота применяется в производстве органических красителей и растворителей, пластических масс, искусственного и синтетичекого волокна, медикаментов. Производство уксуса непрерывным способом протекает по схеме:
Производство молочной кислоты
Биохимический процесс получения молочной кислоты основан на способности молочнокислых бактерий превращать сахар в молочную кислоту:
С6Н12О6 → 2СН3СНОНСООН + 22,5 ккал
Возбудителями молочно-кислого брожения являются молочно-кислые бактерии. Для промышленного получения молочной кислоты используют термофильные бактерии Дельбрука. Оптимальная температура для этих бактерий 48-50°С и pH среды 6,3-6,5. Эти бактерии очень чувствительны к высокому содержанию кислоты. При накоплении в бродящей среде молочной кислоты они прекращают брожение и в заторе остается несброженный сахар. Поэтому образующуюся при брожении молочную кислоту нейтрализуют мелом или гашенной известью.
Молочнокислые бактерии хорошо сбраживают глюкозу, фруктозу, сахарозу, мальтозу, галактозу. Основным сырьем для получения молочной кислоты служит сахар или крахмал, который предварительно осахаривают амилазой или гидролизуют минеральной кислотой, а также меласса и рафинадная патока.
Технологический процесс производства молочной кислоты
Производство молочной кислоты состоит из следующих операций: приготовление затора, молочнокислое брожение, обработка сброженного затора и фильтрация, кристаллизация и расщепление лактата кальция, упаривание молочной кислоты. Если в качестве сырья применяют крахмал, то из него готовят крахмальное молоко концентрацией 11-12%. Приготовленную суспензию перекачивают в гидролизатор, где
гидролизуют крахмал до глюкозы при помощи серной кислоты. Можно производить также ферментативный гидролиз крахмала. Для этого применяют ячменный солод или ферментный препарат плесневого гриба Aspergillus oryzae.
Кислотный гидролиз крахмала более распространенный. Конец осахаривания контролируется йодной пробой. После осахаривания крахмальный гидролизат нейтрализуют мелом и отстаивают 3-4ч. При работе на сахаре или мелассе сахарозу предварительно разлагают при помощи серной кислоты до глюкозы и фруктозы, которые лучше усваиваются молочнокислыми бактериями.
В качестве дополнительного питания для молочнокислых бактерий к гидролизату, полученному после гидролиза крахмала или сахарозы, добавляют водную вытяжку из солодовых ростков. Готовое сусло после смешивания с солодовой вытяжкой должно иметь концентрацию сахара 10-12% и слабокислую реакцию. Дополнительно в сусло вносят еще 2% (по отношению к сахару) мела для связывания молочной кислоты, так как молочнокислые бактерии погибают в присутствии даже небольшого количества молочной кислоты.
Готовое сусло нагревают до 70°С и при этой температуре выдерживают 1-1,5ч для пастеризации, затем охлаждают до 50°С и засевают чистой культурой молочнокислых бактерий. После засева сусло перекачивают в бродильные чаны (рисунок 2), где проводится брожение при 50°С в течение 7-10 сут. Для поддержания этой температуры бродильные чаны снабжены медными змеевиками, через которые пропускают холодную воду. Образующуюся в результате брожения молочную кислоту необходимо нейтрализовать, для этого в бродильный чан три-четыре раза в сутки вносят тонкоразмолотый мел и размешивают. Мел во взаимодействии с молочной кислотой образует молочнокислый кальций (лактат кальция): 2СН3СНОНСООН + СаСО3 = Са(СН3СНОНСОО)2 + СО2 = Н2О
 Рисунок 2 — Бродильный чан для молочнокислого брожения
Рисунок 2 — Бродильный чан для молочнокислого броженияБрожение продолжается 8-9 сут. При нормальном брожении поверхность сусла покрывается мелкой пеной, отсутствует запах летучих кислот, спирта и эфиров. По окончанию брожения в сброженной среде содержится 11-14% лактата кальция. Сброженное сусло нагревают в бродильном чане до 80-90°С для умертвления бактерий и сверты вания белков и обрабатывают гашеной известью до слабощелочной реакции.
При этом бактерии, свернувшиеся белки, различные соли и другие примеси оседают.
Сусло отстаивают 3-5ч и в горячем состоянии фильтруют на рамном фильтр-прессе. Прозрачный фильтрат, содержащий 10-15% лактата кальция, поступает в чаны для кристаллизации. Чаны-кристаллизаторы снабжены змеевиками для охлаждения и мешалками. В кристаллизаторах раствор охлаждают до 11-12°С, за 10-16 ч в осадок выпадает молочнокислый кальций. Из кристаллизатора масса подается насосом на фильтр-пресс для отделения кристаллов от маточного раствора.
Кристаллизацию проводят также из концентрированных растворов. Для этого полученный после фильтрации раствор лактата кальция упаривают до концентрации 27-30%, а затем охлаждают до 27-30°С, заливают в кристаллизаторы и выдерживают 36-48 ч. Образовавшиеся кристаллы лактата кальция отделяют от маточного раствора на центрифуге. Маточные и промывные воды после фильтрации и центрифугирования собирают и используют для получения технической молочной кислоты. Кристаллический лактат расплавляют и передают центробежным насосом в расщепительный чан. Здесь под действием серной кислоты при 60-70°С лактат кальция разлагается с образованием молочной кислоты: Са(СН3СНОНСОО)2 + Н2SO4 = СаSO4 + 2СН3СНОНСООН
В результате разложения лактата кальция образуется так называемая сырая молочная кислота. Она содержит различные примеси и красящие вещества. Для освобождения от примесей (железа, тяжелых металлов) ее обрабатывают желтой кровяной солью и сернистым натрием или сернистым барием, для адсорбции красящих веществ сырую молочную кислоту обрабатывают активным углем. Затем массу фильтруют на фильтр-прессе и получают сырую молочную кислоту 18-20%-ной концентрации. Для повышения концентрации ее упаривают на вакуум-аппарате. Упаривание производят в две ступени: до 50%-ной с последующей очисткой от примесей осветлением активным углем и фильтрацией; упариванием до 80%-ной концентрации с последующей фильтрацией в горячем состоянии. Концентрированная молочная кислота сливается в сборник и поступает на розлив.
Схема производства молочной кислоты:
Молочная кислота находит широкое применение не только в пищевой, но и в других отраслях промышленности. Она применяется при изготовлении некоторых пластмасс, применяется в кожевенном производстве, в фармацевтической промышленности, медицине. Большое применение находят соли и эфиры молочной кислоты.
Производство лимонной кислоты
Лимонная кислота является трехосновной кислотой
Впервые лимонная кислота была получена в 1784 г. Шеелем из сока лимонов. Лимонная кислота содержится также в апельсинах, мандаринах, клюкве, шиповнике, черной смородине и в листьях махорки. Долгое время лимонную кислоту получали из лимонов, затем начали получать из листьев махорки, содержание которой соответственно 9% и 7-8% в пересчете на сухое вещество. Наиболее целесообразным является способ получения лимонной кислоты при помощи плесневых грибов Аспергиллюс нигер, которые являются возбудителем лимонно-кислого брожения сахара. Общую реакцию лимоннокислого брожения можно представить так:
С6Н12О6 + 3О → С6Н8О7 + 2Н2О
Применяют для выращивания гриба штамм 6/5 гриба Аспергиллюс нигер. Оптимальная температура для этого гриба 31 -37°С. Он устойчив в кислотной среде. Питательный раствор подкисляют соляной кислотой до pH 3-4. В период роста гриба и брожения должен быть обеспечен достаточный доступ воздуха.
Питательная среда для выращивания гриба должна содержать сахара, из которых наилучше усваиваются сахароза и глюкоза. Кроме сахаров в среде должны содержаться азот, калий, фосфор, сера, цинк, железо и магний в виде минеральных солей. Эти вещества необходимы для нормального роста мицелия и активного кислотообразования.
Процесс промышленного получения лимонной кислоты может осуществляться двумя способами: поверхностным и глубинным. При поверхностном способе питательный раствор располагается тонким слоем, и плесневый гриб развивается на поверхности жидкости. При глубинном способе брожение ведется в глубоких бродильных чанах, плесневый гриб развивается по всей толщине питательного раствора. Для создания аэробных условий питательная среда энергично аэрируется.
Глубинный способ имеет ряд преимуществ перед поверхностным. Он позволяет более рационально использовать производственную площадь, предохранить производство от инфекции, механизировать и автоматизировать производственный процесс.
Поверхностный способ получения лимонной кислоты
Завод лимонной кислоты состоит из трех основных цехов: спорового, бродильного и химического. В споровом цехе происходит размножение чистой культуры плесневого гриба Аспергиллюс нигер. В бродильном цехе готовят сахарный сироп и сбраживают его в лимонную кислоту. В химическом цехе сброженный раствор подвергают химической обработке для выделения из него кристаллической лимонной кислоты.
Бродильный цех состоит из варочного, стерилизационного, бродильного, мицельного отделений и отделения сборников. В варочном отделении готовят концентрированный 40-50%-ный сахарный сироп. Для этого служит варочный котел, изготовленный из нержавеющей стали и имеющий мешалку и барботер острого пара. В варочный котел набирают водопроводную воду и нагревают ее до 80-90° С пропусканием пара через барботер. В горячую воду засыпают такое количество сахара, чтобы получить 40-50%-ный раствор, и кипятят его в течение 5 мин, после чего перекачивают центробежным насосом в стерилизационное
отделение.
В стерилизатор поступают вместе с сиропом питательные соли. В качестве питания применяют водные растворы хлористого аммония, сернокислых солей и фосфорнокислого калия. После размешивания растворы кипятят 3-5 мин. После кипячения в стерилизатор добавляется холодная вода, которая разбавляет сироп до заданного объема и охлаждает его. Температура сиропа после разбавления должна быть 35-38°С. Затем добавляют крепкую соляную кислоту для подкисления и раствор тщательно перемешивают.
После приготовления питательного раствора его засевают спорами плесневого гриба, выращенного в споровом цехе, из расчета 350-400 тыс. спор на 1 см3 среды. После засева питательный раствор тщательно перемешивают и направляют в бродильное отделение, где разливают по кюветам. Кюветы устанавливают в специальных бродильных камерах, в которых поддерживают температуру 34-36°С.-При этой температуре на питательном растворе вырастает пленка гриба. Рост пленки идет 36-48 ч. Когда питательная среда покроется достаточно зрелой пленкой, раствор из-под нее сливают и заменяют бродильным раствором. Последний отличается от питательного тем, что почти не содержит питательных солей. Сахара в нем 13,5-15%. Из питательных солей в нем содержится только хлористый аммоний, который способствует процессу образования лимонной кислоты.
Под действием плесневого гриба сахар бродильного раствора превращается в лимонную кислоту. Сброженный раствор время от времени сливают из-под пленки в сборники и заменяют свежим бродильным раствором. Такой способ лимоннокислого брожения называют сменным. Он применяется при сбраживании растворов, приготовленных из сахара. Брожение идет при 32°С в течение 14-16 сут. Бродильные растворы меняют 8-12 раз. По окончании брожения сброженный раствор из-под пленки сливают, пленку удаляют с кювет, а камеру моют и стерилизуют.
Сброженные растворы из отделения сборников поступают в химический цех для выделения кристаллической лимонной кислоты. В химическом цехе раствор подается насосом в нейтрализатор и нагревается острым паром до кипения. Кипящий раствор нейтрализуют мелом, и лимонная кислота в виде цитрата кальция выпадает в осадок:
2С6Н8О7 + ЗСаСО3 = Са3(С6Н5О7)2 + ЗСО2 + ЗН2О
Нерастворимый осадок цитрата кальция отделяется от маточного раствора фильтрацией через нутч-фильтр. В фильтрате остается 5-7% сахара. Фильтрат сгущают и направляют в бродильное отделение. Цитрат кальция обрабатывают серной кислотой. В результате реакции образуется гипс и лимонная кислота
Са3(С6Н5О7)2 + 3Н2SO4 = 2С6Н8О7 + 3СаSO4
Для осветления полученного раствора, содержащего красящие вещества, в него добавляют активированный уголь в количестве 2% от массы лимонной кислоты. Активный уголь загружают после введения в раствор 95% расчетного количества серной кислоты. После этого реакционную массу нагревают до кипения и кипятят 15 мин. При этом образуется раствор лимонной кислоты и осадок гипса.
Раствор лимонной кислоты отделяют от гипса и других побочных продуктов на фильтрах. После фильтрации раствор упаривают в вакуум-аппарате до концентрации лимонной кислоты 80% вес. Упаренный раствор поступает в кристаллизатор, где после охлаждения до 8-12°С выкристаллизовывается лимонная кислота. После удаления маточного раствора кристаллы на центрифугах промывают холодной водой и сушат. Сушка производится в камерных сушилках при 35°С. Высушенные кристаллы просеивают на механических ситах и расфасовывают.
Схема производства лимонной кислоты:
Получение лимонной кислоты из мелассы
При поверхностном способе получения лимонной кислоты из мелассы процесс можно вести сменным или бессменным методами. При сменном методе плесневый гриб выращивают на обычной питательной среде. Процесс кислотообразования ведут на растворе из мелассы. Для приготовления бродильного раствора мелассу разбавляют до концентрации сахара 13-15%, осветляют активным углем, подкисляют серной кислотой и обрабатывают желтой кровяной солью для осаждения солей железа, которые вредно влияют на процесс кислотообразования. Бродильные растворы поступают в кюветы после выращивания пленки плесневого гриба. Через 2,5-3 суток сброженные мелассные растворы сливаются и заменяются свежеприготовленными.
При бессменном методе ведения процесса рост гриба и кислотообразование происходит в одной и той же среде. Мелассу разбавляют до концентрации сахара 15%. Перед розливом в кюветы в раствор добавляют необходимое количество фосфорной кислоты. Для сбраживания мелассовых заторов применяется специальный штамм гриба Аспаргиллюс нигер. Продолжительность брожения 8-10 сут. Сброженные растворы поступают в химический цех для выделения лимонной кислоты.
Глубинный способ получения лимонной кислоты
При получении лимонной кислоты методом глубинных культур выращивание плесневого гриба и лимоннокислое брожение производится в специальных аппаратах — ферментаторах. Ферментатор (рисунок 3) представляет собой вертикальный цилиндрический сосуд со сферическими дном и крышкой. Внутри ферментатора вмонтированы воздушный барботер, мешалка и змеевик.
 1 — барботер; 2 — мешалка; 3 — змеевик; 4 — пеногаситель; 5 — привод; 6 — люк; 7 — штуцер засева; 8 — выхлопная труба; 9 — штуцер для термометра; 10 — пробный кран; 11 — сливной штуцер
1 — барботер; 2 — мешалка; 3 — змеевик; 4 — пеногаситель; 5 — привод; 6 — люк; 7 — штуцер засева; 8 — выхлопная труба; 9 — штуцер для термометра; 10 — пробный кран; 11 — сливной штуцерРисунок 3 — Ферментатор
Приготовленный мелассный затор после стерилизации и охлажденный до 32-33° С вместе с растворами питательных солей поступает в ферментатор. В ферментаторе затор засевается спорами плесневого гриба и тщательно перемешивается. После этого сразу начинается аэрация среды обеспложенным и кондиционированным воздухом. Перед подачей в ферментатор воздух проходит через угольный фильтр, камеры кондиционирования и бактериальные фильтры. Количество продуваемого воздуха составляет 0,25-0,5 дм3/мин на один дм3 производственного раствора.
В ферментаторе гриб растет не в виде сплошной пленки, а в виде небольших частичек, равномерно распределенных в жидкости. Брожение ведется при непрерывном перемешивании и аэрации раствора. Этим создаются условия для хорошего контакта мицелия со средой и для аэробного процесса сбраживания сахара. Брожение ведется при 31-32°С. Эта температура поддерживается подачей холодной воды в змеевик ферментатора.
Через 30-36 ч после засева в ферментатор подают постепенно, порциями стерильный раствор мелассы в таком количестве, чтобы общая концентрация сахара составляла 12,5-15% в пересчете на исходный объем питательной среды. Длительность процесса брожения составляет 6-7 сут. Конец брожения определяется по уменьшению титруемой кислотности за последние сутки и по содержанию сахара в сбраживаемом растворе.
Сброженный раствор вместе с мицелием плесневого гриба переводится в запарник, где доводится до кипения при работающей мешалке. Затем жидкость поступает на барабанный вакуум-фильтр для отделения и отмывки мицелия от кислого сброженного раствора. Освобожденный от мицелия кислый раствор вместе с промывными водами поступает в химический цех для выделения лимонной кислоты.
nomnoms.info
Производство серной кислоты. Методы получения. Применение
Серная кислота нашла широкое применение в различных отраслях человеческой деятельности. Современная химическая промышленность включает её в перечень основных продуктов производства, уровень её выпуска является косвенным показателем потенциала химического производства отдельной страны. Ежегодно в мире производится около 160 миллионов тонн этого вещества.
По своим физико-химическим свойствам серная кислота является двухосновной кислотой, в этом соединении сера достигает самой высокой степени окисления (+6). В обычных условиях в концентрированном состоянии серная кислота представляет собой тяжёлую маслянистую жидкость, не имеющую ни цвета, ни запаха. Используется серная кислота в растворе. В качестве растворителя может использоваться как обычная вода, так и серный ангидрид. Принято считать раствор водным, если отношение количество молекул серного ангидрида к количеству воды меньше единицы. При превышении этого показателя применяют выражение — раствор серного ангидрида в серной кислоте или олеум.
Производство серной кислоты обеспечивает этим ценным продуктом технологический процесс создания минеральных удобрений, её используют в качестве электролита в свинцовых аккумуляторах, кислота является основным компонентом при получении различных минеральных солей и кислот. Химические волокна, красители, дымообразующие и взрывчатые вещества в технологии своего производства используют серную кислоту. Без нее невозможно представить себе нефтяную, металлообрабатывающую, текстильную, кожевенную и другие отрасли промышленности.
Даже пищевая отрасль не обошлась без использования этого вещества – получение пищевой добавки E513(эмульгатора). Промышленный органический синтез, дегидратация (процесс получения сложных эфиров, диэтилового эфира), гидратация (добыча этанола из этилена), сульфирование (производство синтетических моющих средств и промежуточных продуктов при получении красителей), алкилирование (синтез изооктана, капролактама, полиэтиленгликоля), восстановление смол в фильтрах на линиях производства дистиллированной воды — ни один из этих процессов не обходится без использования серной кислоты.
Производство серной кислоты обеспечивает самого основного потребителя этого вещества – синтез минеральных удобрений. К примеру, для получения тонны фосфорных удобрений необходимо израсходовать от двух до трёх с половиной тонн серной кислоты. По этой причине сернокислотные предприятия, на которые возложено производство серной кислоты, строят в комплексе с заводами производящими минеральные удобрения.
Для добычи серной кислоты используются два технологических метода. Производство серной кислоты контактным способом является основным и составляет девяносто процентов, нитрозный (башенный) метод получил меньшую распространённость. Несмотря на недостатки и достоинства каждого, производство серной кислоты из колчедана вытеснило нитрозный благодаря более привлекательным показателям себестоимости, чистотой и высокой концентрацией готового продукта на выходе.
Освоение сернокислотными заводами контактного способа синтеза, производство серной кислоты позволяет разбить на три этапа. На первой стадии происходит обжиг пирита, для этого используются специальные печи обжига в так называемом «кипящем слое». Вторая стадия предполагает окисление серного газа до оксида серы (VI), и на третьей стадии происходит получение олеума, который разливают по цистернам и отправляют заказчикам.
Производство серной кислоты нитрозным способом не нашло широкого использования из-за недостаточной чистоты выходного продукта, что ограничивает его применение.
Вне зависимости от методов и способов получения, производство серной кислоты требует от производственников уделять повышенное внимание охране окружающей среды.
fb.ru
Производство органических кислот
В настоящее время биотехнологическими способами получают в промышленных масштабах ряд органических кислот. Из них лимонную, глюконовую, кетоглюконовую и итаконовую кислоты получают лишь микробиологическим способом, молочную, салициловую и уксусную – как химическим, так и микробиологическим, яблочную – химическим и энзиматическим путем. Уксусную кислоту продуцируют Aсеtobacter и Gluconobacter, лимонную – Aspergillus niger, Aspergillus wentii, молочную – Lactobacillus delbrueckii.
В качестве сырья для получения пищевого уксуса используют виноградное вино, пивное сусло, мед, соки различных фруктов и ягод после спиртового брожения или водный раствор этилового спирта для получения белого уксуса. Кроме спирта среда содержит уксусную кислоту и минеральные соли, в состав которых входят азот, фосфор, сера, марганец, калий. Иногда добавляют источники витаминов в виде различных экстрактов. Спирт служит источником углерода и энергии для бактерий.
Уксусная кислота стала первым микробиологическим продуктом, полученным с помощью иммобилизованных клеток. Этот способ может быть непрерывным и периодическим. В течение длительного времени применяется адсорбирование уксуснокислых бактерий на древесной стружке, древесном угле, коксе и других субстратах, Пропуская раствор этанола через генераторы с иммобилизованными бактериями, получают 10…15%-ный раствор уксусной кислоты. При этом из 100 л безводного спирта теоретически должно быть получено 103 л уксусной кислоты. На практике выход уксуса из 100 л этанола редко превышает 90 л, что связано с переокислением и неполным окислением этанола бактериями, а также с его испарением.
Уксус, полученный при брожении, имеет приятные аромат и вкус, которые обусловливают побочные продукты брожения: сложные эфиры (этилацетат и другие), высшие спирты, органические кислоты.
В столовом уксусе содержится от 5 до 9 % уксусной кислоты. Уксус с концентрацией кислоты от 20 до 30 % получают путем вымораживания исходного раствора. Путем перегонки получают 70…80%-ную уксусную кислоту, называемую уксусной эссенцией. Ледяная уксусная кислота содержит от 98,0 до 99,8 % кислоты.
Уксусную кислоту или уксус широко используют в пищевой промышленности. Уксус, полученный микробиологическим путем (пищевая уксусная кислота, столовый уксус), различается по сортам в зависимости от характера сбраживаемого субстрата. Известен яблочный, виноградный, грушевый и другие сорта уксуса. Уксус также применяют для растворения органических красителей, при получении медикаментов, пластмасс и т.д.
Лимонная кислота широко распространена в природе, относительно много ее содержится в некоторых ягодах, фруктах, особенно в цитрусовых (в лимоне от 5 до 10 %), в листьях и стеблях некоторых растений.
Ранее лимонную кислоту выделяли в виде лимоннокислого кальция из продуктов переработки листьев хлопчатника, стеблей махорки, хвои ели и в значительных количествах из плодов лимонов. Однако это производство является крайне дорогим и небольшим по объему. Поэтому лимонная кислота была дефицитным и дорогим продуктом.
В настоящее время лимонная кислота по объему производства является одним из главных продуктов микробного синтеза, ее общий выпуск в разных странах достигает 400 тыс. тонн в год.
Для получения лимонной кислоты используют микроскопические грибы родов Aspergillus, Penicillium, Mucor, Ustina и др. В настоящее время основными продуцентами лимонной кислоты являются различные штаммы гриба Aspergillus niger.
Сверхсинтез лимонной кислоты происходит при лимитировании роста грибов-продуцентов минеральными компонентами среды и одновременном избыточном содержании источника углерода. В условиях лимитирования роста гриба недостатком железа и марганца после полного поглощения из среды дефицитного элемента он прекращает расти, однако продолжает потреблять имеющийся в среде источник углерода. При этом в клетках гриба начинает накапливаться лимонная кислота, которая в дальнейшем выделяется в среду.
Посевной материал в виде спор (конидий) выращивают на мелассной среде поверхностным или глубинным способом.
Лимонную кислоту выделяют из культуральной жидкости в виде плохо растворимой соли – цитрата кальция, которая образуется при добавлении мела. Перевод лимонной кислоты в свободное состояние достигается при добавлении строго определенного количества серной кислоты:
Цитрат кальция + Н2SO4 = Цитрат + Гипс.
Гипс удаляют фильтрованием. Раствор лимонной кислоты осветляют активным углем, упаривают, кристаллизуют.
Лимонная кислота используется в кондитерской промышленности для подкисления карамели, пастилы, вафель, так как она хорошо подчеркивает фруктовый вкус. Данную органическую кислоту в целях подкисления добавляют в мороженое, пищевые концентраты, маргарин, некоторые сорта колбас и сыра.
Лимонную кислоту применяют для торможения образования меланоидинов в сгущенном молоке с сахаром, раствором ее промывают и дезодорируют жировое сырье, обрабатывают перед холодным хранением свежее мясо, рыбу, фрукты с целью стабилизации их цвета, вкуса и запаха. Соли лимонной кислоты используют для изготовления шампуней и других моющих средств, так как они стимулируют вспенивание и обеспечивают механическую устойчивость пен.
Молочная кислота с 1881 г. производится промышленным способом с помощью молочнокислых бактерий. Для промышленного изготовления молочной кислоты пригодны только гомоферментативные молочнокислые бактерии, образующие до 98 % молочной кислоты. Применяются штаммы Lactobacillus delbrueckii, Lactobacillus bulgaricus.
Молочнокислые бактерии преобразуют в молочную кислоту самые разные углеводы, поэтому для промышленного получения этой кислоты используют мелассу, молочную сыворотку, глюкозу, мальтозу, сахарозу, лактозу, осахаренный крахмал и пр.
Молочную кислоту в промышленных условиях получают методом анаэробной глубинной ферментации. Во время ферментации рН среды поддерживают, добавляя мел. Через 6…7 суток культивирования в среде остается от 0,5 до 0,1 % сахаров и от 11 до 14 % лактата кальция. Из 100 г сахаров получают от 80 до 90 г лактата кальция.
Осадок мела и коллоиды отделяют фильтрацией. Фильтрат упаривают, охлаждают и кристаллизуют. Кристаллы лактата отделяют центрифугированием. Молочную кислоту из лактата получают разложением серной кислотой. Реакция идет при температуре от 60 до 70 °С в соответствии с уравнением:
Молочную кислоту обрабатывают активированным углем, фильтруют и фасуют. Конечный продукт – в виде жидкого концентрата молочной кислоты.
Молочную кислоту применяют для приготовления джемов, в которых она способствует хорошей консистенции. Молочная кислота как регулятор рН, улучшитель вкуса применяется в производстве многих сыров, квашении капусты, в сухом концентрате кваса. В хлебобулочном производстве молочная кислота и лактаты увеличивают объем мякиша и улучшают корку хлеба при использовании муки низкого качества. Способность лактатов удерживать влагу применяют в производстве колбас, сыров, детского питания. Молочную кислоту также используют для ускорения получения молочно-белкового сгустка при производстве творога.
Не нашли то, что искали? Воспользуйтесь поиском гугл на сайте:
zdamsam.ru
Производство — плавиковая кислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Производство — плавиковая кислота
Cтраница 1
Производство плавиковой кислоты состоит в следующем. [1]
Для производства плавиковой кислоты применяется, главным образом, весьма чистый полевой шпат с содержанием CaF2 не ниже 97 — 98 / 0 и минимальным содержанием кремневой кислоты. [2]
В производствах плавиковой кислоты, перекиси водорода, хлористого железа и других неорганических химических производствах растет применение графита для изготовления ответственной аппаратуры. [3]
При производстве плавиковой кислоты образуется гипсовый шлам, количество которого может достичь 50 m в сутки и более. Если шлам не может быть использован непосредственно как удобрение или переработан в сульфат аммония, его необходимо непрерывно удалять с установки. [4]
Традиционные методы производства плавиковой кислоты основаны на разложении природного плавикового шпата серной кислотой с последующим улавливанием газообразного HF водой. Однако при настоящем уровне потребления природного сырья запасы шпата быстро будут истощены, поэтому актуальной проблемой является его замена на другие источники фтористого сырья. Таким источником является кремнефтористоводо-родная кислота, получаемая в качестве полупродукта при переработке фосфатов. В настоящее время известно несколько путей переработки h3SiFe в плавиковую кислоту или газообразный фтористый водород: через синтетический плавиковый шпат; термическим или сернокислотным разложением h3SiF6 и через кремнефториды с последующим их гидролизом аммиаком во фториды, перерабатываемые затем в безводный HF или плавиковую кислоту. [5]
Были созданы первые цехи по производству плавиковой кислоты, уралита, криолита, сероуглерода, борной кислоты и буры. [6]
Плавиковый шпат CaF2 широко применяется в производстве плавиковой кислоты h3F2, молочного стекла, эмалей; используется в медицине. Хлорид магния в смеси с его оксидом применяют в производстве к силолита, идущего на изготовление полов, панелей, подоконников. [7]
Печи с вращающимися барабанами являются основными элементами установок производства плавиковой кислоты, соды, карбида кальция, хлорида бария и ряда других производств, включая производство строительных материалов. Данные конструкции широко используются и для оформления процессов сушки разнообразных материалов. [9]
В качестве примера из области неорганической химии ниже подробно описывается производство плавиковой кислоты. [10]
Плавиковый шпат применяют марки Ф-0 для оптических приборов; марки Ф-95-для производства плавиковой кислоты и фтористых солей высокой чистоты; марки Ф-92-для производства плавиковой кислоты и фтористых солей и в качестве флюса при выплавке сталей и сплавов особого назначения; марок Ф-85 и Ф-75-в качестве флюса при выплавке сталей и ферросилиция; марки Ф-85-для производства матовых стекол и эмалей; марок Ф-55, Ф-40 и Ф-30-для производства концентратов плавикового шпата высших марок и цемента. [11]
Плавиковый шпат применяют марки Ф-0 для оптических приборов; марки Ф-95-для производства плавиковой кислоты и фтористых солей высокой чистоты; марки Ф-92-для производства плавиковой кислоты и фтористых солей и в качестве флюса при выплавке сталей и сплавов особого назначения; марок Ф-85 и Ф-75 — в качестве флюса при выплавке сталей и ферросилиция; марки Ф-85-для производства матовых стекол и эмалей; марок Ф-55, Ф-40 и Ф-30-для производства концентратов плавикового шпата высших марок и цемента. [12]
Плавиковый шпат марки Ф-0 применяется для оптических приборов; марки Ф-95 — для производства плавиковой кислоты и фтористых солей высокой чистоты; марки Ф-92 — для производства плавиковой кислоты и фтористых солей и в качестве флюса при выплавке сталей и сплавов особого назначения; марок Ф-85 и Ф-75 — в качестве флюса при выплавке сталей и ферросилиция; марки Ф-85 — для производства матовых стекол и эмалей; марок Ф-55, Ф-40 и Ф-30 — для производства концентратов плавикового шпата высших марок и цемента. [13]
Для получения спека употребляют плавиковый шпат, содержащий 70 — 75 % CaF2 и непригодный для производства плавиковой кислоты, и кварцевый песок, либо трепел, содержащий 80 — 85 % SiO2: или инфузорную землю. Кварцевый песок менее удобен для спекания. [14]
Плавиковый шпат применяют марки Ф-0 для оптических приборов; марки Ф-95-для производства плавиковой кислоты и фтористых солей высокой чистоты; марки Ф-92-для производства плавиковой кислоты и фтористых солей и в качестве флюса при выплавке сталей и сплавов особого назначения; марок Ф-85 и Ф-75-в качестве флюса при выплавке сталей и ферросилиция; марки Ф-85-для производства матовых стекол и эмалей; марок Ф-55, Ф-40 и Ф-30-для производства концентратов плавикового шпата высших марок и цемента. [15]
Страницы: 1 2
www.ngpedia.ru
Паяльная кислота своими руками

Паяльная кислота является тем флюсом, который можно отнести к отдельной категории, ведь он влияет агрессивно на материалы, которые необходимы при работе. Этот флюс в основном распространяется в жидком состоянии, причем это не зависит от его концентрации. Иногда можно приобрести концентрированное вещество, а потом разбавить его, а возможно и купить уже готовое, разбавленное. Кроме этого каждый вполне может сделать паяльную кислоту самостоятельно.

Свойства материалов необходимо подбирать по тем факторам, которые необходимы для их применения. Кислота для спаивания предназначается для тех металлов, которые имеют сильные загрязнения, ведь на них происходит окисление, а также на поверхности остается большое количество ржавчины. Материал очень активен, поэтому необходимо работать с ним осторожно и избегать попадания на кожные покровы и слизистые оболочки человека. Необходимо сначала внимательно ознакомиться с правилами и методами применения кислоты, а уже потом начинать применять ее по назначению.
В процессе производства паяльной кислоты самостоятельно, необходимо использовать специальную технологию. В конце должен получиться тот материал, который будет иметь те свойства, предписанные ГОСТом. Именно это сделает флюс качественным и надежным, чтобы соединения были прочными. Необходимо сделать так, чтобы свойства и функции кислоты работали и после спаивания металлов, ведь материл убирает пленки и ржавчину с поверхности, а также препятствует их повторному возникновению. Следует также учитывать растекаемость по поверхности спаиваемых материалов и схватываемость с металлами и изделиями.
Характеристики, состав и свойства
Необходимо точно знать, из чего должен состоять материал, и только потом приступать к его производству. В кислоту для спаивания входят:
- присадка смачивающая;
- хлорид амония;
- деионизированная вода;
- хлорид цинка;
- соляная кислота.
Паяльная кислота, созданная самостоятельно, может состоять из других компонентов. Необходимо только сделать все для того, чтобы флюс обладал всеми необходимыми свойствами. Следует обеспечить высокую активность данного материала. Он должен за минимальное количество времени вступить во взаимодействие с необходимыми материалами, а также уничтожить все вещества, которые не дают нормально спаиваться. Однако стоит учитывать, что мелкие детали при действии кислоты могут пострадать и испортиться. Такие же свойства имеются и у паяльного активного жира.

У кислоты довольно неприятный запах, поэтому когда человек вдыхает его, то его здоровье может пострадать. Именно поэтому при работе с данным материалом обязательно рекомендуется пользоваться респиратором. Ну а помещение для работы необходимо постоянно проветривать. Необходимо обезопасить руки, кожные покровы и слизистые от попадания кислоты, нужно, чтобы заготовка попадала только в необходимые для спаивания места.
Материалы и инструменты для изготовления кислоты
Необходимо знать, что кислота для спаивания, сделанная самостоятельно, будет несколько другого состава, нежели покупная. Однако она будет более простой. Чтобы приготовить такую кислоту, необходимо пользоваться некоторыми приспособлениями:
- Стеклянная емкость или банка для замешивания и приготовления материала.
- Цинк в гранулах или стаканчики от использованных батареек с содержанием данного элемента.
- Водопроводная чистая вода.
- Соляная кислота концентрированная, которая способна растворять ненужные примеси и вещества.
Изготовление кислоты самостоятельно
Для начала необходимо взять емкость или баночку для замешивания кислоты. Именно туда помещается цинк или батарейки и их остатки. Только после всего вышеперечисленного в емкость можно наливать соляную кислоту. Главное при этом действовать с большой осторожностью, ведь при попадании на кожу можно получить серьезный ожог. Кислоты в емкости не должно быть больше, чем 3/4 от объема всего состава.
В итоге получается, что пропорции должны быть такими. Для 1 литра соляной кислоты необходимо 412 грамм цинка, вот только измерить это можно только при помощи специальных инструментов. Поэтому стоит знать, что будут некоторые отклонения в ту или иную сторону.
При дальнейшем приготовлении паяльной кислоты необходимо подождать, когда закончится реакция химических веществ. Цинк и кислота контактируют между собой, металл постепенно растворяется. Во время этого процесса происходит активное выделение водорода, поэтому в жидкости можно увидеть множество пузырьков.

Жидкость постепенно становится все прозрачней и чище. Когда все процессы будут закончены, необходимо перелить жидкость в плотно закрывающуюся тару. Все данные материалы можно с легкостью купить в магазинах, специализирующихся на продаже химии и реактивов. При использовании батареек можно увидеть, что подходят практически любые из них.
Если необходимо сделать материал с более слабыми свойствами, то следует немного убавить агрессивность. В этом случае рекомендуется добавить немного воды, чтобы раствор получился более жидким и со слабыми свойствами. Однако нужно соблюдать осторожность, ведь жидкость может разбрызгаться и попасть на кожные покровы и слизистые оболочки человека. Пропорции в данном случае следует выбирать самому, придерживаясь особенностей необходимой пайки.
Приготовление паяльной кислоты самостоятельно
Для начала стоит позаботиться о собственной безопасности, ведь пользоваться кислотой очень опасно и можно нанести непоправимый вред здоровью. Если производство кислоты осуществляется на предприятиях и в промышленных областях, то все необходимо делать в шкафах специального назначения. Реактивы надежно защищены от посторонних, а переливаются они строго под специальными вытяжками. В домашних условиях рекомендуется пользоваться защитой, перчатками, очками, респираторами и другими приспособлениями. Растворение кислоты следует производить только в хорошо проветриваемом помещении или вообще на улице. Ведь в процессе создания кислоты для спаивания в воздух постоянно выделяется водород в больших количествах. Также необходимо позаботиться на всякий случай и о воде, при помощи которой можно быстро промыть участок кожи, на который попало вещество. Лучше всего использовать водопроводную холодную воду, ведь в результате несчастного случая она уменьшит боль и быстро промоет рану.
Если данное вещество разлилось по поверхности, то лучше всего его смывать специальным составом воды и щелочи. Также нужно обязательно помнить о том, что данный материал необходимо правильно хранить, емкость должна быть закрытой и сохранять герметичность, хранение осуществляется в темном и прохладном месте. Рекомендуется исключить доступ посторонних людей к паяльной кислоте, чтобы не возникало опасности для других. Флюс иногда производится из чистой соляной кислоты без цинка и воды. Однако применят его по большей части только для изделий из железа.
svarkagid.com
Производство серной кислоты
.
Серную кислоту производят в больших количествах на сернокислотных заводах.
I. Сырьё, используемое для производства серной кислоты:
II. Подготовка сырья.
Разберём производство серной кислоты из пирита FeS2 .
1) Измельчение пирита.
Перед использованием большие куски пирита измельчают в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ.
2) Очистка пирита.
После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют.
III. Химизм производства.
Производство серной кислоты из пирита состоит из трёх стадий.
ПЕРВАЯ СТАДИЯ — обжиг пирита в печи для обжига в «кипящем слое».
Уравнение реакции первой стадии
t = 800°C
4FeS2 + 11O2
2Fe2 O3 + 8SO2 + Q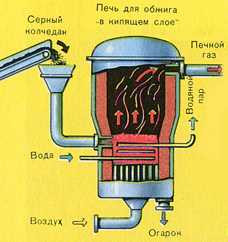
Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в «подвешенном состоянии» из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета.
За счёт выделяющейся теплоты в результате реакции поддерживается температура в печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с водой, которая нагревается. Горячую воду используют дальше для центрального отопления рядом стоящих помещений.
Образовавшийся оксид железа Fe2 O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом — сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве).
Таким образом выполняется принцип химического производства — безотходность производства.
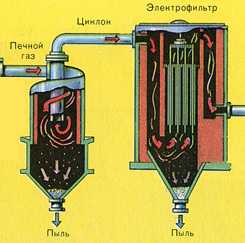
Из печи выходит печной газ, состав которого: SO2 , O2 , пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка печного газа от твёрдых частичек огарка проводят в два этапа — в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду.
Осушку печного газа проводят в сушильной башне — снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2 .
ВТОРАЯ СТАДИЯ — окисление SO2 в SO3 кислородом.
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 + O2
2SO3 + QСложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3 ).
а) температура:
Прямая реакция является экзотермической +Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2 O5 .
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2 ), а справа — 2V SO3 . Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3 . Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3 .
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
ТРЕТЬЯ СТАДИЯ — поглощение SO3 серной кислотой.
Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2 O
H2 SO4 . Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2 SO4 ·nSO3 .Уравнение реакции этого процесса nSO3 + H2 SO4
H2 SO4 ·nSO3Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Охрана окружающей среды,
связанная с производством серной кислоты.
Основным сырьем для производства серной кислоты, является сера. Она относится к числу наиболее распространенных числу химических элементов на нашей планете.
Производство серной кислоты происходит в три стадии на первой стадии получают SO2 , путем обжига FeS2 , затем SO3 , после чего на третьей стадии получают серную кислоту.
mirznanii.com
