Как делают этиловый спирт: Чем медицинский спирт отличается от пищевого? | Здравоохранение | Общество
Из чего делают различные виды спирта в России и Китае
Наверняка вы тоже задавались вопросом из чего делают спирт кроме привычного сахара и зерна. Отвечаем: спирт можно гнать из всего, что содержит углеводы (сахара). Даже из нефти, опилок. Вот только чем благороднее сырье, тем вкуснее спирт. Давайте посмотрим, из чего делают популярный спирт и что служит сырьем в разных странах.
Из чего делают этиловый спирт
Согласно ГОСТ 5962-2013, сырьем для производства спирта этилового категорией ниже “Экстра” может быть любое сельскохозяйственное крахмалистое или сахарное сырье: зерно, картофель, сахарная свекла, меласса, сахар-сырец. Да, картофельные очистки, силос, солома тоже подойдут.
В других странах придерживаются тех же принципов. В качестве сырья используют сахарный тростник, просо, мискантус.
Из чего делают пищевой спирт
Спирт можно делать из любого сырья, а пищевым он становится после качественной ректификационной очистки.
Из чего делают спирт в России
На заводах, по технологии и нормативам — из пшеницы, ячменя, ржи, кукурузы, овса, проса, картофеля, свеклы и ее производных (патоки и мелассы). Добавляют в небольших количествах горох, гречку.
Из чего делают спирт в Китае
В интернете много статей о том, что китайцы делают спирт даже не из палок, а из … экскрементов и идет он на водочные заводы России. Эта информация не подтверждена (и наверняка скрывалась бы), поэтому сырьем считают рис и кукурузу.
Из чего делали спирт в СССР
Нет, официально все было прилично: существовали ГОСТы, спирт делали из
пищевого сырья, зерна и корнеплодов. А вот неофициально, особенно во время
сухого закона, умельцы делали его из клея БФ, технического спирта, тормозной
жидкости, денатурата, перебродившего столярного клея, средства для мытья окон,
аптечных препаратов.
В СССР не было качественных и компактных мини-спиртзаводов типа Люкссталь 8m, поэтому спирт гнали как придется и подручными средствами. Ценой таких экспериментальных составов была слепота, ожоги, взрывы аппарата и другой экстрим. И это не считая того, что за самогоноварение можно было сесть в тюрьму.
Кстати, если вы хотите сделать добротную и душистую наливку по старому советскому рецепту, но из чистого спирта, заходите в раздел настоек на спирту.
Из чего делают спирт в Осетии
Классическую арака (национальную водку) делают из кукурузы, под посевы которой отведены огромные площади. Следует отметить, что большая часть контрафактного спирта и алкоголя тоже идет из Осетии. Опять же, вам никто не скажет, из чего точно делают китайский спирт и осетинские коньяки.
Из чего делали спирт для водки
Для качественной классической водки используется очищенный зерновой спирт.
Даже ГОСТ строго не ограничивает производителей по сырью — подойдет любое
пищевое.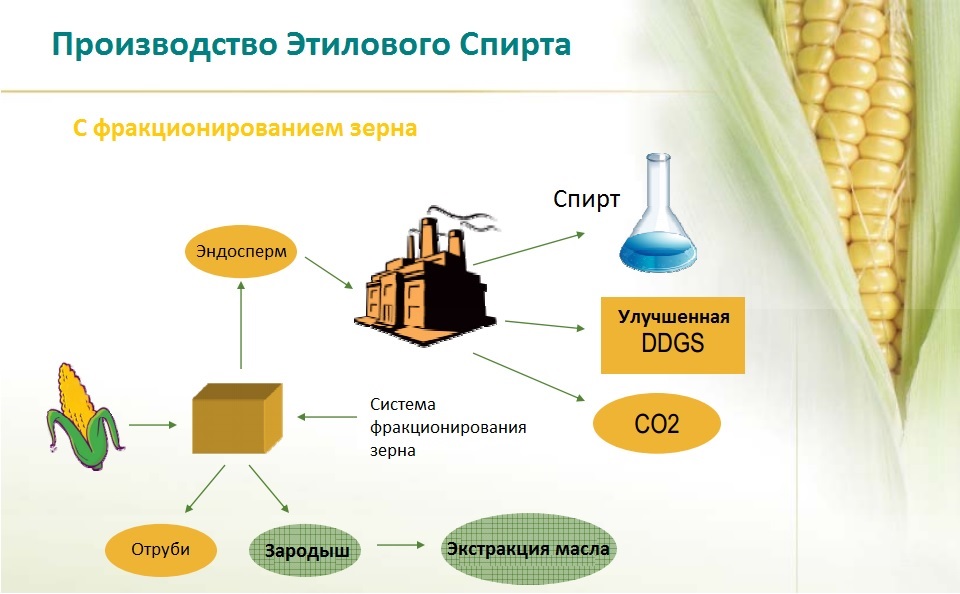
Из чего делают медицинский спирт
Это обычный этиловый спирт, очищенный и разбавленный до 95%, 90%, 70% или 40% крепости.
Из чего делают технический спирт
Из непищевого сырья — сахара, добытого гидролизом из целлюлозы, отходов лесной промышленности. Буквально — из палок.
Из чего делают метиловый спирт
Метиловый спирт или метанол синтезируют из метана, окиси углерода, муравьиной кислоты, а также получают, нагревая без доступа кислорода древесину и лигнин. В небольших количествах метиловый спирт получают при перегонке браги, в составе головной фракции.
Из чего делают “Альфа” спирт
Спирт высшей категории “Альфа” гонят из пшеницы, ржи или их смеси — это записано в ГОСТ 5962-2013.
Из чего делают спирт “Люкс”
Из любого зерна или смеси зерна разных типов. Пропорции определяет на свою совесть производитель.
Из чего делают спирт “Экстра”
Спирт категории “Экстра” делают из зерна, смеси зерна
разных культур (пшеница, ячмень, овес, просо и иже с ними), а еще — из зерна и
картофеля и картофельного крахмала, которого должно быть не более 3/5 всего
сырья.
Из чего делают спирт для виски?
Американский бурбон — из кукурузы, скотч и ирландский виски — из ячменя.
Из чего делают коньячный спирт
Только из винограда — это канонический рецепт, пришедший к нам от французов, которые, собственно, и изобрели коньяк.
Ну и напоследок: если вы всегда хотели знать, но боялись/забывали спросить.
Из чего делают муравьиный спирт
Муравьиный спирт — это 1,4 % муравьиной кислоты в этаноле крепостью 70% или 96 процентов.
Из чего делают нашатырный спирт
Это 10-процентный раствор аммиака (соединения азота и водорода) в воде. Этанола в нем нет вообще.
Из чего делают изопропиловый спирт
Летучий и ядовитый спирт производят из ацетона и пропилена, фракций нефти.
Из чего делают камфорный спирт
Он состоит из этилового спирта и камфоры — растительного соединения, которое получают из скипидара.
Из чего делают сухой спирт
Сухой спирт — это не шутка, а горючее. Спиртовые таблетки применяются
давно, например, во время лабораторных опытов и туристических походов. Такая таблетка состоит из уротропина
(производное аммиака и формальдегида) и парафина и дает много тепла.
Спиртовые таблетки применяются
давно, например, во время лабораторных опытов и туристических походов. Такая таблетка состоит из уротропина
(производное аммиака и формальдегида) и парафина и дает много тепла.
Из чего делают дешевый спирт
Дешевый спирт, который легко может оказаться паленым, делают из технического спирта, отходов пищевой промышленности. Более того, действительно есть технология изготовления спирта из экскрементов. И вы никогда не узнаете, что вы купили вечером пятницы. Чем пить нечто из …. и палок, лучше варить чистый и вкусный спирт из проверенного сырья. Кстати, домашний спирт в 3-5 раз дешевле магазинного. И это еще один аргумент за самогоноварение. Выбирайте напиток, посмотрите отзывы на самогонные аппараты и готовьте чистый, как слеза, спирт.
Этиловый спирт – яд для организма
Этиловый спирт – яд для организма
Как показали результаты всеобщей диспансеризации, у подавляющего большинства россиян высок риск развития заболеваний сердечно-сосудистой, дыхательной систем, диабета и злокачественных опухолей. У 24,3 % наших сограждан – из-за неправильного питания, у 19,6% – из-за низкой физической активности, у 17,3 % и 16,7 % из-за пагубных привычек – курения и чрезмерного потребления алкоголя соответственно.
У 24,3 % наших сограждан – из-за неправильного питания, у 19,6% – из-за низкой физической активности, у 17,3 % и 16,7 % из-за пагубных привычек – курения и чрезмерного потребления алкоголя соответственно.
Лучше – меньше
Хотя в России с 2008 по 2014 год наблюдалось постепенное снижение потребления алкоголя с 16,2 л чистого спирта до 11,5 л на душу населения, мы все еще значительно опережаем по этому показателю страны Западной Европы. Для сравнения, там потребление алкогольной продукции на душу населения в год составляет всего 9,8 л. По данным исследований, 75% российского населения умеренно потребляют спиртные напитки, 20 % потребляют алкоголь в чрезмерных количествах, 5 % больны алкоголизмом.
Этиловый спирт – яд для организма. Молекула этанола хорошо растворяется в воде и жирах, поэтому легко проникает практически во все ткани, оказывая пагубное действие на организм. Уже появились такие диагнозы, как алкогольный гастрит, гепатит, жировая дистрофия печени, хронический панкреатит, кардиомиопатия и даже полинейропатия.
Любовь россиян к спиртному обходится дорого и стране в целом, и каждому отдельному ее гражданину. Ежегодно от последствий, вызываемых злоупотреблением спиртным, умирают 500 тысяч человек, большинство из которых – мужчины трудоспособного возраста. Еще больше число тех, кто заболевает хроническими заболеваниями или получают травмы и попадают в несчастные случаи. На почве пагубной привычки возникают и другие социально-экономические проблемы, в том числе низкая производительность труда и рост преступности, с которыми безуспешно борются власти.
Знать меру
Есть в медицине понятие «стандартная доза» (one drink), под которой понимается количество алкогольного напитка, в котором содержится определенное количество чистого этилового спирта. Эксперты ВОЗ предложили стандарт, который сейчас принят в большинстве стран мира: 10 г чистого спирта. Такое количество спирта содержится в 150 мл сухого вина, или 50 мл крепкого алкоголя (водки, коньяка и т.д.). В бутылке пива крепостью 4,5° содержится 1,6 стандартной дозы.
Эксперты ВОЗ предложили стандарт, который сейчас принят в большинстве стран мира: 10 г чистого спирта. Такое количество спирта содержится в 150 мл сухого вина, или 50 мл крепкого алкоголя (водки, коньяка и т.д.). В бутылке пива крепостью 4,5° содержится 1,6 стандартной дозы.
Специалисты подсчитали и уровень потребления алкоголя, при котором не увеличивается риск последствий для здоровья. Для здоровых мужчин в возрасте до 65 лет он составляет 3 стандартных дозы в день или 14 – в неделю. Для здоровых женщин и мужчин старше 65 лет – 2 дозы в день или 7 — в неделю. Важно, чтобы оба показателя укладывались в рамки ВОЗ. Например, если среднестатистический россиянин выпивает две рюмки водки в день (100 мл), он не превышает дневной лимит, но превышает недельный.
Некоторым категориям граждан нельзя пить алкоголь вообще: беременным женщинам, людям, принимающим лекарственные средства, несовместимые со спиртным, или страдающим рядом хронических заболеваний, а также представителям профессий, где требуется предельная концентрация внимания и автомобилистам, если они собираются в ближайшее время сесть за руль.
Мифам бой
Среди россиян распространено мнение, что алкоголь снижает уровень холестерина и даже чистит сосуды, как «Тирет» – трубы. Это опасный миф. Чрезмерное потребление алкоголя разрушает стенки сосудов, способствует отложению в их стенках атеросклеротических бляшек и образованию тромбов, а также вызывает спазм сосудов (после их кратковременного расширения), что в сочетании с атеросклерозом может стать причиной инфаркта и инсульта. По материалам исследования, проведенного в 15 городах страны, выявлено, что среди мужского населения алкоголь занимает второе место по вкладу в общий риск распространенности артериальной гипертонии. А у пожилых людей, лиц с сердечно-сосудистыми заболеваниями внезапная смерть в связи с приемом алкоголя нередко наступает при относительно невысокой концентрации алкоголя в крови.
Антиалкогольная горячая линия
Получить информацию по любым вопросам, связанным с употреблением алкоголя, можно, позвонив в телефонную справочную службу «Здоровая Россия». Горячая линия работает по номеру 8-800-200-0-200. Звонки на нее бесплатны из всех регионов России.
Горячая линия работает по номеру 8-800-200-0-200. Звонки на нее бесплатны из всех регионов России.
Телефон горячей линии Благотворительного фонда реабилитации больных наркоманией «Нарком», оказывающего услуги по профилактике курения, алкоголизма, наркомании, включая просвещение граждан о факторах риска для их здоровья и мотивацию к ведению здорового образа жизни (8-499-250-05-00) с бесплатными консультациями адвоката, психолога, социального работника на сайте Вашего учреждения в разделе «информация для пациента».
Этиловый спирт
С2Н5ОН представляющий собой бесцветную прозрачную жидкость с характерным запахом и жгучим вкусом, является конечным продуктом процесса брожения. В зависимости от содержания этилового спирта алкогольные напитки делят на высокоалкогольные — до 96 % спирта (этиловый спирт), крепкие — от 31 до 65 % спирта (водка, ром, коньяк), среднеалкогольные — 9—30 % спирта (виноградные Вина, ликеры, наливки), слабоалкогольные— 1,5—8 % спирта (пиво, квас). Этиловый спирт хорошо смешивается с водой в любых соотношениях, имеет температуру кипения 78,3°С, замерзания— минус 117°С, гигроскопичен.
Этиловый спирт хорошо смешивается с водой в любых соотношениях, имеет температуру кипения 78,3°С, замерзания— минус 117°С, гигроскопичен.
Классификация спирта. В зависимости от исходного сырья спирт подразделяется на пищевой и технический. В свою очередь пищевой спирт может вырабатываться из:
♦ зернового сырья и картофеля;
♦ сахарной мелассы и других отходов сахарного производства;
♦ плодов.
В зависимости от степени очистки спирт подразделяется на безводный, медицинский, люкс, экстра, высшей очистки, 1-го сорта.
Этиловый спирт (этанол) — продукт перегонки сброженных углеводосодержащих продуктов с последующим концентрированием и обработкой отгона (спиртсодержащей жидкости). Этанол представляет собой бесцветную, легкоподвижную горючую жидкость плотностью при 0°С 806 кг/м3, с температурой кипения 78,3°С; он смешивается с водой в любых соотношениях, в больших дозах ядовит.
Этиловый спирт широко применяется в различных отраслях народного хозяйства. Более 150 производств используют его в качестве сырья, растворителя и горючего.
Более 150 производств используют его в качестве сырья, растворителя и горючего.
В России вырабатывается более 1/6 из мирового производства этилового спирта. Основными потребителями пищевого этилового спирта являются ликеро-водочная и винодельческая отрасли пищевой промышленности. Пищевой спирт — это высококонцентрированная смесь почти чистого этилового спирта с водой. 95%-й питьевой этиловый спирт как пищевой продукт реализуется только в районах Крайнего Севера и Сибири. В основном же он используется в качестве основного или вспомогательного сырья при изготовлении водок, ликеров, наливок, горьких и сладких настоек, виноградных и плодово-ягодных вин.
Пищевой этиловый спирт получают из растительного сырья, богатого крахмалом (картофеля, зерна злаков, отходов крахмалопаточного производства) и инулином (топинамбура и корней цикория), или из сырья, содержащего сахара (мелассы — отхода сахарного производства, сахарной свеклы, некондиционного сахара-сырца, стеблей сахарного тростника, некондиционных плодов и ягод, включая виноград, а также из отходов виноделия).
Технический спирт вырабатывают из растительного сырья с высоким содержанием клетчатки негидролизуемыми ферментами дрожжевой клетки (древесных опилок, соломы, торфа, мха), и из сульфитных щелоков (отходов целлюлозно-бумажного производства), содержащих до 1,5% сахара. Технический этиловый спирт вырабатывают также синтетическим путем — гидратацией (в присутствии катализатора) углеводорода этилена — С2Н4 + Н20 = С2Н5ОН.
Этиловый спирт из пищевого сырья и древесины получают по одному и тому принципу путем сбраживания Сахаров под действием ферментов дрожжей. Отличие состоит лишь в способах гидролиза полисахаридов сырья до сбраживаемых Сахаров: крахмал пищевого сырья гидролизуют биохимическим путем с помощью ферментов (амилаз), а целлюлозу древесины — химическим способом, воздействуя на нее минеральными кислотами. Процесс же сбраживания гексоз в том и другом случае одинаков и может быть представлен следующей схемой:
гексозы—фосфорные эфиры—гексоз-фосфотриозы—
фосфоглицериновая кислота—пировиноградная кислота—
уксусный альдегид—этиловый спирт.
В основе производства этилового спирта из клубней картофеля и зерна злаков лежат два биохимических процесса: гидролиз (осахаривание) крахмала, содержащегося в сырье, и сбраживание образующихся Сахаров в спирт и углекислый газ, и физический процесс разделения жидкостей по точкам кипения.
Осахаривание крахмала ведут с помощью амилолитических ферментов, накапливающихся в проросших зернах (солоде) или продуцируемых грибами рода Aspergillus: Asp. avamori, Asp. oryzae. Asp. niger, Asp. usamii, Asp. botatae. Фермент дрожжей сх-глюкозидаза (мальтаза) катализирует гидролиз дисахарида мальтозы до двух молекул глюкозы, а комплекс ферментов зимазы сбраживает глюкозу в этиловый спирт и углекислый газ: С6Н1206-> 2С2Н5ОН + 2С02 + 118 кДж.
Из злаковых культур для получения этилового спирта в основном используют кукурузу, ячмень, овес, рожь, пшеницу, просо. В производстве спирта применяют так называемый «зеленый солод», т. е. увлажненное до содержания 38—40% влаги и проросшее зерно ячменя, ржи, пшеницы, овса, проса, кукурузы. Обычно на спиртовых заводах применяют смесь солодов из двух или трех видов зерна. При подборе смесей стремятся к созданию наиболее полного комплекса активно осахаривающихся ферментов.
е. увлажненное до содержания 38—40% влаги и проросшее зерно ячменя, ржи, пшеницы, овса, проса, кукурузы. Обычно на спиртовых заводах применяют смесь солодов из двух или трех видов зерна. При подборе смесей стремятся к созданию наиболее полного комплекса активно осахаривающихся ферментов.
Для сбраживания осахаренного зернокартофельного сырья, называемого затором, применяют дрожжи Saccharo-myces cerevisiae расы XII, II М.
Производство спирта из крахмалистого сырья складывается из следующих основных технологических процессов:
♦ подготовки сырья — мойки, очистки от посторонних примесей;
♦ тепловой обработки (разваривания) с водой при температуре 120—150°С и давлении не менее 588 кПа (6 атм) для разрушения клеточной структуры и растворения крахмала;
♦ охлаждения разваренной массы;
♦ осахаривания крахмала под действием амилолити-ческих ферментов — а- и (З-амилаз и олиго-1,6-глюкозида-зы (декстриназы), содержащихся в солодовом молоке или чистой культуре плесневых грибов, в течение 5—10 мин при температуре 57—58°С;
♦ сбраживания мальтозы и декстринов (после превращения их в мальтозу) в этиловый спирт и углекислый газ под действием ферментов дрожжей для получения зрелой бражки, содержащей 7—10% спирта;
♦ выделения из бражки путем ее перегонки с паром в специальных колонках спирта-сырца, содержащего 88% об. этилового спирта и получаемые в процессе брожения примеси;
этилового спирта и получаемые в процессе брожения примеси;
♦ повторной перегонки спирта-сырца на ректификационном аппарате периодического или непрерывного действия для получения ректификованного спирта крепостью 96— 96,5% об. Спирт-ректификат получают также непосредственно из бражки на непрерывно действующих брагоректи-фикационных аппаратах, где из спирта-сырца выделяют примеси.
Примеси являются вторичными и побочными продуктами спиртового брожения. Большинство их оказывает вредное воздействие на организм человека, и поэтому остаточное количество и состав примесей влияют на качество спирта-ректификата и вырабатываемых из него ликеро-водочных изделий. При общем содержании примесей в спирте-сырце 0,3—0,5% в их составе идентифицировано более 50 соединений, которые могут быть отнесены к одной из четырех групп химических веществ: альдегидам и кетонам, эфирам, высшим спиртам (сивушные масла) и кислотам.
Очистка (ректификация) спирта-сырца от примесей является обязательным условием последующего использования спирта для приготовления водок и ликеро-водочных изделий. Ректификация путем перегонки спирта-сырца основана на различных точках кипения при нагревании этилового спирта и загрязняющих его примесей. В зависимости от степени летучести эти примеси бывают головными, хвостовыми и промежуточными.
Ректификация путем перегонки спирта-сырца основана на различных точках кипения при нагревании этилового спирта и загрязняющих его примесей. В зависимости от степени летучести эти примеси бывают головными, хвостовыми и промежуточными.
Головные примеси кипят при температуре ниже температуры кипения этилового спирта. Это альдегиды (уксусный и др.), эфиры (муравьиноэтиловый, уксуснометиловый, уксусноэтиловый и др.), метиловый спирт. К хвостовым относят примеси, кипящие при температуре выше температуры кипения этилового спирта. Это в основном сивушные масла, т. е. высшие спирты — пропиловый, изо-пропиловый, бутиловый, изобутиловый, амиловый, изоа-миловый и др. К хвостовым примесям относятся также фурфурол, ацетали и некоторые другие вещества.
Промежуточные примеси представляют собой наиболее трудноотделимую группу соединений. В зависимости от условий перегонки они могут быть и головными, и хвостовыми. В эту группу примесей входят изомасляноэтиловый, изовалерианоэтиловый, уксусноизоамиловый, изова-лерианоизоамиловый эфиры.
В некоторых случаях спирт-сырец перед ректификацией предварительно подвергают химической обработке для освобождения от примесей: раствором NaOH омыляют сложные эфиры и превращают их в соли летучих кислот; раствором КМп04 окисляют альдегиды в непредельные соединения.
В зависимости от степени очистки спирт этиловый ректификованный бывает четырех сортов: люкс — 96,3%, экстра — 96,5% об., высшей очистки — 96,2 и 1-го сорта — 96% об. Для производства алкогольных напитков используется спирт «Люкс», «Экстра» и высшей очистки. Спирт «Люкс» и «Экстра» вырабатывают из различных видов зерна (кроме бобовых культур) и смеси зерна и картофеля. Количество крахмала картофеля в смеси не должно превышать 35% при выработке спирта «Люкс» и 60% при выработке спирта «Экстра».
Спирт высшей очистки в зависимости от исходного сырья вырабатывают:
♦ из зерна, картофеля или из зерна и картофеля;
♦ из смеси зерна, картофеля, сахарной свеклы и мелассы сахара-сырца и другого сахаро- и крахмалосодержащего пищевого сырья в различных соотношениях;
♦ из мелассы.
Поскольку спирт ректификованный «Экстра» вырабатывают из кондиционного зерна, то содержание примесей в нем не должно превышать 0,07 г/дм3. В спирте высшей очистки и 1-го сорта количество примесей допускается соответственно до 0,1 и 0,15 г/дм3. Помимо крепости в ректификованном спирте всех трех сортов нормируется содержание альдегидов (соответственно не более 2, 4 и 10 мг в 1 л безводного спирта), сивушного масла (не более 3, 4 и 15 мг/дм3), эфиров (не более 25, 30 и 50 мг/дм3), свободных кислот (не более 12, 15 и 20 мг/дм3). Он должен выдерживать пробу на метиловый спирт с фуксинсернистой кислотой. Содержание фурфурола не допускается.
Этиловый спирт всех сортов должен быть бесцветным и прозрачным, без посторонних частиц. Вкус и запах должны быть характерными для этилового спирта, изготовленного из соответствующего сырья. Посторонние привкусы и запахи не допускаются.
Спирт этиловый питьевой вырабатывают крепостью 95 ±0,2% об. Запах и вкус его должны быть характерными для этилового ректификованного спирта высшей очистки, вырабатываемого из зерна и картофеля, остальные показатели качества такие же, как и для спирта этилового ректификованного высшей очистки.
Запах и вкус его должны быть характерными для этилового ректификованного спирта высшей очистки, вырабатываемого из зерна и картофеля, остальные показатели качества такие же, как и для спирта этилового ректификованного высшей очистки.
Разливают спирт в чистые стеклянные бутылки емкостью 0,5 и 0,25 л. На бутылку со спиртом наклеивают этикетку установленного образца с указанием: наименование завода-изготовителя, наименование спирта, крепость в объемных процентах, емкости бутылки и номера действующего стандарта. Срок хранения питьевого спирта не ограничен.
По качеству спирт этиловый питьевой должен соответствовать требованиям, указанным в табл. 16. Из органолептических показателей в спирте определяют внешний вид, цвет, вкус и запах. Спирт питьевой должен быть прозрачной, бесцветной жидкостью с характерным вкусом и запахом
Помимо органолептических показателей качества в спирте проводят физико-химические исследования и устанавливают объемную долю этилового спирта (95,0 ± 0,2%), массовую концентрацию альдегидов (не более 4 мг/дм3), сивушного масла (не более 4 мг/дм3), эфиров (не более 30 мг/дм3), свободных кислот (не более 15 мг/дм3). Напиток должен выдерживать пробу на метиловый спирт с фуксин-сернистой кислотой и не содержать фурфурола.
Напиток должен выдерживать пробу на метиловый спирт с фуксин-сернистой кислотой и не содержать фурфурола.
Спирт этиловый пищевой получают только из пищевого сырья. Основным сырьем для производства спирта является картофель, зерно, патока.
Производство спирта состоит из следующих этапов:
подготовительного — очистка сырья от примесей, приготовление солода;
основного — разваривание крахмалистого сырья, осахаривание крахмала, сбраживание осахаренной массы, перегонка бражки и получение сырого спирта;
завершающего — ректификация (повторная перегонка с целью очистки этилового спирта от примесей).
В зависимости от содержания примесей и крепости спирт этиловый ректификованный (С2Н5ОН) выпускают сортов: Люкс, Экстра,
высшей очистки и 1-го. Спирт этиловый ректификованный представляет собой прозрачную, бесцветную жидкость без посторонних запахов и привкусов.
Спирты сортов Люкс и Экстра получают только из кондиционного зерна. Для спирта высшей очистки и 1-го сорта используют любое крахмалосодержащее пищевое сырье.
Для спирта высшей очистки и 1-го сорта используют любое крахмалосодержащее пищевое сырье.
Содержание этилового спирта (крепость) выражается в объемных процентах. Под объемным процентом понимают количество миллилитров спирта в 100 мл водно-спиртового раствора при 20 «С.
Крепость спирта Люкс — 96,3% об., Экстра — 96,5, высшей очистки — 96,2, 1-го сорта — 96,0% об.
Этиловый спирт — бесцветная, легкоподвижная жидкость; удельный вес безводного спирта при 20 «С — 0;78927; температура кипения при 760 мм рт. ст. — 78,3 °С; замерзания——117 °С.
Спирт этиловый ректифицированный спирт «люкс» и «экстра»
вырабатывают из различных видов зерна, смеси и картофеля, кроме бобовых. При производстве спирта «Люкс» количество картофеля в смеси не должно превышать 35 %, спирта «Экстра» — 60 %.
Этанол
Консервант.
В РФ разрешён в качестве экстракционного и технологического растворителя в пищевых производствах согласно ТИ, максимальное остаточное количество согласно ТИ (п. 5.3.42 СанПиН 2.3.2.1293-03).
5.3.42 СанПиН 2.3.2.1293-03).
Этиловый спирт представляет собой бесцветную жидкость, смешивающуюся с водой в любых соотношениях. Пищевой спирт получают только брожением сахаросодержащих жидкостей. Этанол в РФ и большинстве других стран не считается пищевой добавкой. Он является составной частью многих пищевых продуктов, его использование в качестве консерванта не ограничено. Консервирующее действие проявляется, начиная с концентрации в несколько процентов, и связано со снижением активности воды в пищевом продукте.
Арабы использовали спирт для хранения фруктов ещё тысячу лет назад. В настоящее время этанол находит промышленное применение в хлебопечении и виноделии. Его добавляют к сокам, применяемым затем в производстве вин, и к специальным сортам вин. В домашнем хозяйстве этанол по-прежнему широко применяется при консервировании фруктов в роме и сахаре.
В Роскачестве назвали самую качественную водку — Российская газета
Эксперты Роскачества исследовали водку из спирта сорта «люкс» либо «альфа». Всего по 30 параметрам качества и безопасности оценили 23 товара от 14 российских производителей.
Всего по 30 параметрам качества и безопасности оценили 23 товара от 14 российских производителей.
Для того, чтобы выяснить природу спирта (пищевой или технический) эксперты проверили водку на содержание метилового спирта, уксусного альдегида, токсичных химических элементов (свинец, ртуть, кадмий, мышьяк) и фурфурола (побочный продукт брожения при очистке). Весь исследованный алкоголь оказался безопасным, он соответствовал требованиям закона о регулировании производства и оборота этилового спирта, алкогольной и спиртосодержащей продукции. При этом 19 товаров из 23 получили высшую оценку рейтинга Роскачества — пять баллов.
Теперь они могут претендовать на получение российского Знака качества. Все образцы изготовлены на основе пищевого спирта, они не содержат денатурирующих веществ и фурфурола. Содержание токсичных веществ и метанола (метилового спирта) в них ниже установленного уровня. В каждой бутылке именно столько градусов, сколько указано на маркировке.
Однако у экспертов возникли замечания к способу очистки водки — содержание кальция и магния не позволяет утверждать, что водка очищена молоком, как заявлено в маркировке. Такие претензии есть к продуктам двух торговых марок. Ещё к двум образцам есть замечания по вкусу (он жгучий и резкий).
Такие претензии есть к продуктам двух торговых марок. Ещё к двум образцам есть замечания по вкусу (он жгучий и резкий).
В Росалкогольрегулировании напоминают, что потребители всегда могут проверить подлинность приобретаемого алкоголя в бесплатном приложении АнтиконтрафактАлко. Там же можно проверить легальность работы магазина и при необходимости сообщить об обнаруженном правонарушении, уточнил официальный представитель Росалкогольрегулирования Александр Куликов.
Эксперты Роскачества также выяснили, есть ли кардинальная разница между относительно бюджетной и дорогой водкой. И дешевая, и дорогая водка оказалась безопасной. В нескольких образцах выявлены несоответствия требованиям ГОСТа по органолептике (вкусу). Дегустационная оценка у водки должна быть не менее 9,4 балла. Оценка за дегустацию двух торговых марок составили 9,1 балла. Вкус у напитков оказался жгучим и резким. Также у этих торговых марок выявлено высокое содержание сульфатов. Неудивительно, что при дегустации эти марки получили низкие оценки, так как именно сульфаты придают водке горечь.
А вот спирт все производители используют качественный. «В настоящее время чаще всего водка производится на основе спирта этилового ректификованного «люкс» или «альфа». Спирт «люкс» вырабатывается из различных видов зерна (пшеница, рожь, тритикале, кукуруза) и их смеси в различных соотношениях. Спирт «альфа» — из пшеницы, ржи или их смеси», — пояснила Марина Медриш, заведующая лабораторией Всероссийского научно-исследовательского института пищевой биотехнологии (ВНИИПБТ).
Проблема качества и безопасности водки касается, по ее словам, в основном нелегальной розницы, где отсутствует контроль.
«В год в лицензированной рознице продается порядка миллиарда литров водки, которая проходит жесткий контроль. К сожалению, есть и нелегальный сектор (например, магазины, не имеющие лицензии, павильоны и т. д.), где ежегодно реализуется порядка 250 миллионов литров нелегальной водки. Такая продукция производится в полукустарных условиях с применением ворованного нелегального спирта и часто не соответствует обязательным требованиям технических регламентов», — отмечает глава Центра исследований федерального и регионального рынков алкоголя Вадим Дробиз.
Подробности исследования и рейтингах водок можно узнать на сайте Роскачества.
отбор сырья и технология производства
Сейчас значительно вырос спрос на спирт, поскольку люди самостоятельно делают антисептики. По словам администратора магазина Spirt-96 чаще всего спрашивают именно медицинский этанол. Но на самом деле можно использовать и пищевой. Чтобы вы убедились в этом мы собрали информацию о различиях медицинского и пищевого спирта. Спойлер: разница оказалась не такой уж большой. Более детально об этих и других видах спирта вы можете узнать здесь.
Из чего делают медицинский спирт
Этиловый спирт можно сделать с любой основы (сырья), которая богата на углеводы. Самые популярные – крахмал и зерновые культуры. Существуют и экзотические способы получения этанола. Технические его сорта делают из древесины, поскольку она состоит из целлюлозы. Именно отсюда проходят байки про самогон из опилок.
Сразу скажем, что пить такой продукт нельзя – он предназначен только для технических нужд. Им разбавляют лакокрасочные смеси, добавляют в топливо, используют в химических реакциях.
Им разбавляют лакокрасочные смеси, добавляют в топливо, используют в химических реакциях.
Безопасный для человека спирт (медицинский и питьевой) делают исключительно из пищевых продуктов. Так, основой для самых дешевых классов выступает картофельный крахмал и богатые на углеводы отходы сахарного производства.
Хороший спирт, например, Люкс делают из зерна с добавлением небольшого количества крахмала. Зерновые также подходят не все. Это пшеница и рожь, то есть хлебные злаки. Картофельный крахмал в медицинском спирте Люкс составляет не больше 30% от общей массы сырья.
Марку Люкс мы выбрали не просто так, а по той причине, что к ней относится большая часть этанола, предназначенного для медицинского использования. Цену на данный вид спирта вы можете увидеть тут.
Чем медицинский спирт отличается от питьевого
Согласно всеобщему представлению, медицинский этанол самый чисты. Это заблуждение. Действительно, вся продукция, которая предназначена для этой сферы, проверяется с особой тщательностью. Но это не обязательно означает, что спирт проходит самую высокую очистку. Так, медицинский Люкс уступает по чистоте питьевой Пшеничной слезе.
Но это не обязательно означает, что спирт проходит самую высокую очистку. Так, медицинский Люкс уступает по чистоте питьевой Пшеничной слезе.
Более того, медицинский и пищевой Люкс будут отличаться по составу. Почему так происходит? В пищевых продуктах главное – органолептические свойства. То есть вкус и запах. Для медицинских препаратов – безопасность.
Так, чтобы сделать Люкс пригодным для внешнего использования, нужно удалить все примеси, которые могут быть опасны. А вот на эфирные масла, которые сильнее всего влияют на вкус, обращают меньшее внимание.
Если подытожить, то следует сказать, что для домашнего алкоголя медицинский спирт Люкс использовать можно. При этом за те же деньги вы можете купить этанол более высокого класса, а значит, лучше выбрать пищевой сорт.
Больше информации об медицинском этиловом спирте вы найдете на сайте Spirt-96. В блоге есть подробная информация о каждом классе этанола, а также рецепты приготовления антисептиков и алкогольных напитков.
В интернет-магазине можно купить этиловый спирт-ректификат для пищевого и медицинского использования. Самый популярный класс – Люкс. Доставка по Украине через Новую почту.
Пояснения к номенклатуре продукции, сведения по которой отражаются в форме N 1-алкоголь / КонсультантПлюс
Пояснения к номенклатуре продукции,
сведения по которой отражаются в форме N 1-алкоголь
Спирт этиловый из пищевого сырья и технический (стр. 001) — спирт, произведенный из пищевого или непищевого сырья методом спиртового брожения либо гидратацией этилена, а также иными способами с последующей перегонкой и ректификацией или без нее с содержанием спирта не менее 88% объема готовой продукции.
По строке 001 приводятся объемы:
— спирта этилового, выработанного из пищевого сырья (из зерновых культур, свеклы, картофеля, патоки, отходов виноделия, головной фракции этилового спирта и др.), а также спирта, полученного в результате переработки в брагоректификационном аппарате возвращенного из ликероводочного производства неисправимого (грязного) брака, при условии соответствия его (спирта) требованиям действующей нормативно-технической документации (строка 002);
— спирта этилового технического (строка 005), в составе которого учитываются спирт этиловый технический синтетический (строка 006), спирт этиловый технический гидролизный (строка 007) и спирт этиловый технический сульфитный (строка 008).
Строка 001 = строка 002 + строка 005.
Строка 005 >= строка 006 + строка 007 + строка 008.
Спирт этиловый технический синтетический — спирт, полученный методом органического синтеза, спирт этиловый технический гидролизный — полученный методом гидролиза растительных материалов, спирт этиловый технический сульфитный — полученный путем биохимической переработки древесной массы.
По строкам 003, 009, 011, 013, 015 отражаются данные по спирту этиловому ректификованному, полученному соответственно из пищевого сырья, а также техническому (в целом, в том числе по видам: синтетическому, гидролизному, сульфитному).
Ректификация — осуществляемое в специальных аппаратах разделение многокомпонентных жидких смесей на практически чистые компоненты.
Предприятие, осуществляющее наряду с производством этилового спирта (пищевого или технического) также и его ректификацию в собственных цехах ректификации, в отчетности по форме N 1-алкоголь приводит данные по всем видам произведенных им спиртов, в т. ч. ректификованных (строки 001 — 009, 011, 013, 015).
ч. ректификованных (строки 001 — 009, 011, 013, 015).
Предприятие — производитель спирта этилового с дальнейшей его ректификацией в собственных цехах ректификации и предприятие, вырабатывающее спирт-ректификат из пищевого сырья (бражки), при составлении отчетности по форме N 1-алкоголь по всем графам формы должны соблюдать следующие логические контроли:
Строка 002 >= строки 003;
Строка 003 >= строки 004;
Строка 005 >= строки 009;
Строка 006 >= строки 011;
Строка 007 >= строки 013;
Строка 008 >= строки 015;
Строка 009 = строка 011 + строка 013 + строка 015.
Предприятие, осуществляющее только ректификацию полученного от сторонних организаций этилового спирта (пищевого или технического), приводит данные только по ректификованным спиртам, в т.ч. полученным из спирта, принятого на ректификацию от сторонних организаций (строки 003, 004, 009 — 016).
Строка 010 = строка 012 + строка 014 + строка 016.
Все виды этиловых спиртов (из пищевого сырья и технических), спирты коньячные, а также спиртосодержащая денатурированная продукция учитываются в декалитрах в пересчете на безводный этиловый спирт.
Неизбежные технологические потери, обусловленные самой сущностью технологического процесса производства спирта (например, при производстве этилового пищевого спирта — это потери условного крахмала при разваривании, солодоращении, траты сахара на побочное брожение и размножение дрожжей, потери спирта при брагоректификации и т.д.), в объемы его производства не включаются.
Спирт денатурированный (денатурат) из пищевого сырья (строка 017) и спирт этиловый технический денатурированный (строка 019) — этиловый спирт, содержащий добавки красителя или специальные вещества, наличие которых исключает его использование при производстве алкогольной и спиртосодержащей пищевой продукции.
Предприятие, осуществляющее наряду с производством этилового спирта (пищевого или технического) также и его денатурацию в собственных цехах денатурации, в отчетности по форме N 1-алкоголь приводит данные по всем видам произведенных им спиртов, в т.ч. денатурированных (строки 001, 002, 005 — 008, 017 и 019).
Предприятие, осуществляющее только денатурацию полученного от сторонних организаций этилового спирта (пищевого или технического), приводит данные только по денатурированным спиртам, в т.ч. полученным из спирта, принятого на денатурацию от сторонних организаций (строки 017 — 020).
Предприятие — производитель спирта этилового с дальнейшей его денатурацией в собственных цехах денатурации при составлении отчетности по форме N 1-алкоголь по всем графам формы должно соблюдать следующие логические контроли:
Строка 002 >= строки 017;
Строка 005 >= строки 019;
Строка 017 >= строки 018;
Строка 019 >= строки 020.
Спирт этиловый (головная фракция) из отходов пищевого спирта (строка 021) является промежуточным этапом технологического процесса производства этилового спирта и, как правило, полностью перерабатывается с целью получения конечного продукта.
Спирт этиловый (головная фракция) из отходов пищевого спирта не учитывается в составе спирта этилового из пищевого сырья.
Спирт-сырец этиловый виноградный (строка 022) — продукт с объемной долей этилового спирта не менее 40%, произведенный путем перегонки виноматериалов, сброженных виноградных выжимок, дрожжевых и клеевых осадков.
Спирты коньячные (строка 023) — винный дистиллят с объемной долей этилового спирта 55 — 70%, произведенный фракционной перегонкой виноматериалов с объемной долей этилового спирта не менее 7,5% и находившийся в постоянном контакте с древесиной дуба в течение всего периода выдержки.
Дистилляты виноградные и плодовые (строка 024) — продукты с объемной долей этилового спирта 52 — 86%, произведенные путем перегонки виноматериалов, сброженных плодовых сусел, спирта-сырца виноградного или плодового, виноградных или плодовых выжимок, дрожжевых или гущевых осадков.
Спирт этиловый (головная фракция) из отходов пищевого спирта, спирт-сырец этиловый виноградный, спирты коньячные, дистилляты виноградные и плодовые в объем спирта этилового из пищевого сырья и технического не включаются, а учитываются самостоятельно.
Спирт этиловый питьевой 95% (строка 032) — ректификованный этиловый спирт, произведенный из пищевого сырья, разведенный умягченной водой до 95% объема готовой продукции.
Виноматериалы — сырье для изготовления вина, полученное в результате спиртового брожения виноградного сусла, виноградной мезги либо плодового сока с добавлением или без добавления этилового спирта, произведенного из пищевого сырья, с содержанием этилового спирта не более 22,5% объема готовой продукции.
Виноматериалы не относятся к винам виноградным и винам плодовым и учитываются отдельно.
Виноматериалы виноградные необработанные (строка 025) — виноматериалы для производства шампанских вин, вырабатываемых из сортов винограда, установленных национальным стандартом.
Виноматериалы виноградные обработанные (строка 026) — виноматериалы, прошедшие полный цикл технологической обработки, установленный для данного вида виноматериалов технологическими инструкциями.
Соки спиртованные от 20 град. до 25 град. для ликероводочных изделий — это полуфабрикаты, получаемые путем прессования дробленого свежего плодово-ягодного сырья и консервирования полученного сока с этиловым ректификованным спиртом.
до 25 град. для ликероводочных изделий — это полуфабрикаты, получаемые путем прессования дробленого свежего плодово-ягодного сырья и консервирования полученного сока с этиловым ректификованным спиртом.
В позицию «Водка и ликероводочные изделия» (строка 029) согласно Общероссийскому классификатору продукции ОК-005-93 включаются все виды водок и спирт этиловый питьевой 95% (код 918110), изделия ликероводочные крепостью 30% и свыше (бальзамы, джины, ромы, ликеры, аперитивы, настойки полусладкие и горькие, напитки крепкие из плодового спирта, коктейли и прочие) (918120), наливки и настойки сладкие крепостью менее 30% (918130), изделия ликероводочные слабоградусные крепостью менее 30% (918140).
Строка 029 >= строка 030 + строка 031 + строка 032.
Водки и особые водки — спиртные напитки крепостью 40,0 — 45,0%, 50,0 — 56,0%, полученные обработкой специальным адсорбентом водно-спиртового раствора, с добавлением ингредиентов или без них, с последующим фильтрованием.
Ликероводочные изделия — спиртные напитки крепостью 6,0 — 60,0%, а именно: ликеры, кремы, наливки, пунши, настойки (в том числе сладкие, полусладкие, полусладкие слабоградусные, горькие, горькие слабоградусные), напитки десертные, аперитивы, бальзамы, джины, коктейли различной органолептической и цветовой гаммы с различным содержанием сахара, изготавливаемые смешиванием полуфабрикатов, ингредиентов и других пищевых добавок со спиртом-ректификатом и исправленной питьевой водой.
Ликероводочные изделия с объемной долей этилового спирта до 25% (включительно) (строка 030) — те же спиртные напитки крепостью до 25% (включительно).
Вино — алкогольная продукция, произведенная из виноматериалов, с содержанием этилового спирта, произведенного из пищевого сырья, не более 22% объема готовой продукции.
Виноградные вина (строка 033) — вина, выработанные из виноградных материалов. Шипучее виноградное вино, искусственно насыщенное углекислотой путем сатурации, относится к виноградным винам и включается в общий объем их производства. Полусухие и полусладкие вина следует также относить к виноградным винам.
Вина натуральные виноградные (молодые, без выдержки, выдержанные и марочные (строки 034, 035 и 036) — вина, произведенные без добавления этилового спирта или винного дистиллята.
В состав показателя «Вина натуральные молодые, без выдержки» (строка 034) включаются вина молодые и вина без выдержки.
Предприятия — производители виноградных вин при составлении отчетности по форме N 1-алкоголь должны соблюдать следующий логический контроль по всем графам формы:
строка 033 >= строка 034 + строка 035 + строка 036.
Плодовые вина (строка 037) — вина, выработанные из соков плодово-ягодных спиртованных, виноматериалов плодовых сброженно-спиртованных, соков плодовых и ягодных концентрированных. Сидр и шипучие (газированные), а также полусладкие и полусухие плодово-ягодные вина относятся к плодовым винам.
Сидр — слабоалкогольный напиток, произведенный путем сбраживания яблочного сусла с добавлением сахара или без него, с последующим насыщением двуокисью углерода эндогенного или экзогенного (газированного) происхождения.
Медовые вина — вина, произведенные путем спиртового брожения медового сусла с добавлением или без добавления сахара и спирта.
Медовые напитки — напитки, произведенные на основе брожения медового сусла с добавлением или без добавления сахара и спирта, настоев пряно-ароматического сырья, пищевых вкусоароматических добавок и других компонентов.
Строка 037 >= строки 038.
Напитки винные (виноградные и плодовые) (строка 039) — алкогольные напитки с объемной долей этилового спирта 5 — 28%, получаемые из виноградных и плодовых виноматериалов с добавлением или без добавления этилового спирта из пищевого сырья, коньячных, виноградных, плодовых спиртов или дистиллятов, винных концентратов, сахаросодержащих, пищевых вкусоароматических добавок и воды.
По строке 039 также учитываются напитки и коктейли винные газированные крепостью свыше 9%, но не более 20%.
Коктейли винные газированные — алкогольные напитки, произведенные путем смешивания виноградных или плодовых виноматериалов или их концентратов со спиртом, водой, с использованием вкусоароматических добавок или без них, с насыщением двуокисью углерода.
По строке 040 учитываются слабоалкогольные напитки с содержанием этилового спирта не более 9%, в том числе джин-тоник.
По строке 041 приводятся данные по винам шампанским и игристым.
Вина шампанские — вина, насыщенные двуокисью углерода эндогенного происхождения при вторичном брожении необработанных виноградных виноматериалов в бутылках или резервуарах под давлением.
Вина игристые — вина, насыщенные двуокисью углерода эндогенного происхождения при вторичном брожении обработанных и необработанных виноматериалов в бутылках или резервуарах под давлением.
Коньяки (строка 042) — крепкие спиртные напитки, выработанные из выдержанного не менее 3 лет коньячного спирта, крепостью не ниже 40%.
По строке 043 учитываются коньячные напитки и бренди.
Коньячные напитки — алкогольные напитки, произведенные из коньячных спиртов, выдержанных в контакте с древесиной дуба не менее 1 года, с добавлением при необходимости сахара, колера, дубового экстракта и воды.
Бренди — крепкие алкогольные напитки, вырабатываемые из коньячного или виноградного спирта с добавлением различных компонентов в соответствии с техническими условиями на данный вид продукции.
Коньяки в указанную позицию не включаются.
Кальвадосы (строка 044) — алкогольные напитки, произведенные из выдержанных или молодых яблочных спиртов или дистиллятов, с использованием компонентов древесины дуба.
Спиртосодержащая денатурированная продукция — продукция, приготовленная из спиртосодержащих отходов ликероводочного и спиртового производств, с добавлением различных денатуратов и красителей, предусмотренных рецептурой в количествах, исключающих возможность использования ее для производства алкогольной и пищевой продукции.
Спиртосодержащая денатурированная продукция является сырьем для производства парфюмерно-косметической продукции, товаров бытовой химии и другой продукции, в состав которой входят спирты.
Готовая парфюмерно-косметическая продукция (лосьоны, одеколоны) и товары бытовой химии (аэрозоли, средства для мытья посуды), розлитые в потребительскую тару, в отчете по форме N 1-алкоголь не отражаются.
С введением настоящего Порядка отменяется ранее действовавшая Инструкция по заполнению формы федерального государственного статистического наблюдения за производством спирта этилового, спиртосодержащей, алкогольной продукции и розливом алкогольной продукции, утвержденная Постановлением Госкомстата России от 09.11.2001 N 83.
Управление статистики
предприятий и других
хозяйствующих субъектов
Вред суррогатного алкоголя и спиртосодержащих жидкостей
Опасно ли употребление суррогатов алкоголя? Безусловно, опасно, так как сопровождается тяжелыми, вплоть до смертельного исхода, поражениями печени, почек, глаз, центральной нервной системы. Часть отравлений бывает связана с употреблением поддельных спиртных напитков. При этом иногда страдают люди, вовсе не злоупотребляющие ими.
Часть отравлений бывает связана с употреблением поддельных спиртных напитков. При этом иногда страдают люди, вовсе не злоупотребляющие ими.
Также нередко пьют суррогаты хронические алкоголики. Они часто используют вовсе «несъедобные» продукты бытовой химии, технические спирты, лекарственные жидкости, что приводит к очень тяжелым отравлениям.
Суррогаты алкоголя и их виды
Что же такое суррогаты алкоголя? Это спиртосодержащие жидкости, применяемые в быту и для технических нужд. Их употребляют с целью опьянения при недоступности обычных спиртных напитков. Также сюда можно отнести поддельные алкогольные напитки (вина, коньяки, водку, самогон, настойки, коктейли), изготовленные с использованием ненадлежащего сырья или с нарушениями технологии. Наряду с этиловым спиртом они содержат вредные примеси различных веществ.
Суррогаты подразделяют на две группы:
- Содержащие этанол, или истинные суррогаты. Сюда относятся лекарства (настойки пустырника, боярышника), различные лосьоны, одеколоны, технический этиловый спирт.
 Более опасные суррогаты – это бытовые жидкости, такие как растворители, средства для мытья стекол и поверхностей, политура; тормозная жидкость, антифризы; клей БФ. Они могут содержать гидролизный и сульфатный спирты, денатурат, примеси метилового спирта, этиленгликоля, альдегиды, эфирные масла, ацетон, хлороформ, красители, прочие ядовитые вещества.
Более опасные суррогаты – это бытовые жидкости, такие как растворители, средства для мытья стекол и поверхностей, политура; тормозная жидкость, антифризы; клей БФ. Они могут содержать гидролизный и сульфатный спирты, денатурат, примеси метилового спирта, этиленгликоля, альдегиды, эфирные масла, ацетон, хлороформ, красители, прочие ядовитые вещества. - Вещества, не содержащие этиловый спирт, но вызывающие опьянение. Их называют ложными суррогатами. Это метиловый, пропиловый, бутиловый, амиловый и муравьиный спирты, этиленгликоль, дихлорэтан и жидкости различного назначения, в которые они входят в большой концентрации. Они крайне ядовиты и вызывают опасные поражения различных органов и смерть.
Особую опасность представляют поддельные алкогольные напитки. Попавшие в них ядовитые соединения, особенно метиловый спирт, которые приводят к смертельным отравлениям.
Признаки отравления алкогольными суррогатами
Первыми признаками отравления алкогольными суррогатами бывают тошнота, затем рвота, чувство дурноты, головокружение, боли в животе, мучительная головная боль. Клиническая картина первоначально такая же, как при отравлении большим количеством водки. Дальнейшие симптомы зависят от того, чем вызвано отравление и насколько велика доза выпитого.
Клиническая картина первоначально такая же, как при отравлении большим количеством водки. Дальнейшие симптомы зависят от того, чем вызвано отравление и насколько велика доза выпитого.
Метанол (метиловый спирт). По запаху и вкусу не отличается от этилового спирта, но является смертельным ядом.
Продукт сухой перегонки древесины. Используется в качестве растворителя при производстве лаков, как добавка к жидкому топливу для двигателей внутреннего сгорания.
Состояние пострадавшего напрямую зависит от количества выпитого. Приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению. Смертельная доза метанола равна 80-100 мл. Первыми признаками отравления будут тошнота и рвота, мушки перед глазами. Кожа больного сухая и красная. В течение последующих суток состояние его ухудшается. Появляется жажда, боли в животе, одновременно головная боль, сильные боли в икроножных мышцах, двоение в глазах.
В тяжелых случаях часто наступает слепота. Появляются судороги, возбуждение, напряжение затылочных мышц. Нарушается сердечный ритм, падает давление. Если количество выпитого спирта близко к смертельной дозе, наступает кома и остановка дыхания. Возможно молниеносное развитие отравления со смертельным исходом.
Нарушается сердечный ритм, падает давление. Если количество выпитого спирта близко к смертельной дозе, наступает кома и остановка дыхания. Возможно молниеносное развитие отравления со смертельным исходом.
Этиловый спирт частично нейтрализует метанол.
Этиленгликоль. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом.
Применяется как компонент автомобильных антифризов и тормозных жидкостей, в производстве целлофана, полиуретанов и ряда других полимеров, как растворитель красящих веществ.
Смертельная доза его равна 100-300 мл. После 6-8 часов от приема этиленгликоля возникают головная боль, боли в пояснице, животе; жажда, понос, рвота. Кожа и слизистые сухие, красные, с синюшным оттенком.
При тяжелом отравлении больной возбужден, зрачки расширены. Позднее появляются судороги, больной теряет сознание. В терминальной стадии развивается сердечная недостаточность с отеком легких, острая печеночная и почечная недостаточность, смерть.
Что делать при отравлении суррогатами алкоголя
При подозрении на отравление суррогатами алкоголя надо срочно вызвать скорую помощь, так как тяжесть состояния может нарастать очень быстро.
Если пострадавший в сознании, до прибытия врача ему надо дать выпить теплую воду в большем количестве и затем вызвать рвоту.
Человека без сознания укладывают на бок, очищают рот и носоглотку от рвотных масс. Чтобы не допустить западение языка, выводят его из полости рта и фиксируют.
Если точно известно, что отравление вызвал метиловый спирт, больному, находящемуся в сознании, можно дать выпить коньяк или водку. Содержащийся в них этиловый спирт частично нейтрализует метанол.
Профилактика отравлений суррогатами алкоголя
Самая надежная профилактика отравлений – никогда не употреблять суррогаты алкоголя. Чтобы избежать случайных отравлений, храните продукты бытовой химии отдельно, в посуде, имеющей соответствующие надписи.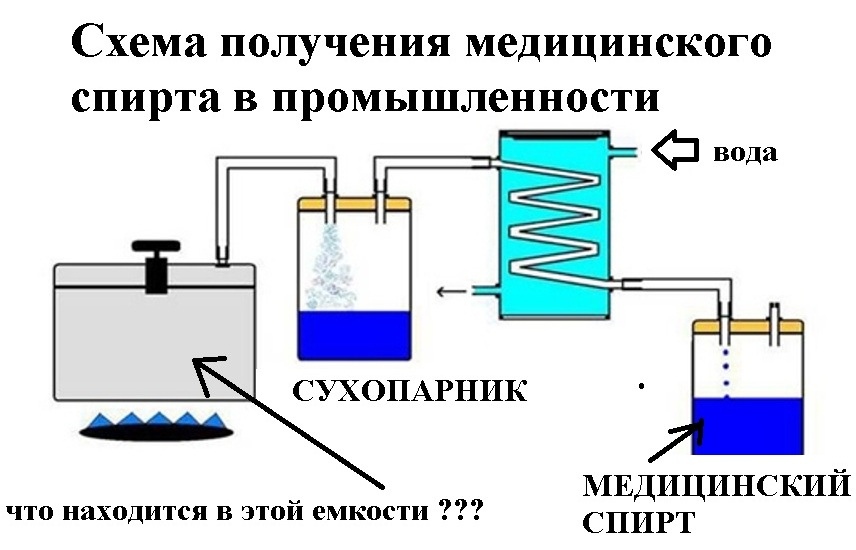
Покупайте все спиртные напитки в хорошо проверенных, пользующихся отличной репутацией специализированных магазинах.
А лучше не пейте вообще. Помните, алкоголь вреден для здоровья!
Этиловый спирт | Encyclopedia.com
КЛЮЧЕВЫЕ ФАКТЫ
ДРУГИЕ НАИМЕНОВАНИЯ:
Этанол; зерновой спирт; алкоголь; этилгидрат
ФОРМУЛА:
CH 3 CH 2 OH
ЭЛЕМЕНТЫ:
Углерод, водород, кислород
ТИП СОЕДИНЕНИЯ:
Спирт (органический)
СОСТОЯНИЕ:
Жидкость
MOL :
46,07 г / моль
ТОЧКА ПЛАВЛЕНИЯ:
−114,14 ° C (−173,45 ° F)
ТОЧКА КИПЕНИЯ:
78.29 ° C (172,9 ° F)
РАСТВОРИМОСТЬ:
Смешивается с водой, эфиром, ацетоном и наиболее распространенными органическими растворителями
ОБЗОР
Этиловый спирт (ETH-uhl AL-ko-hol) является прозрачным, бесцветным, легковоспламеняющаяся жидкость с резким, жгучим вкусом и приятным винным запахом. Это одно из первых химических веществ, открытых и использованных людьми. Керамические кувшины, по-видимому, предназначенные для хранения пива, датируются периодом неолита, около 10 000 лет до нашей эры. Некоторые ученые предполагают, что люди, возможно, научились варить пиво и включили его в свой ежедневный рацион еще до того, как начали готовить и употреблять хлеб.Изготовление и употребление вина — явная тема египетских пиктограмм, датируемых четвертым тысячелетием до нашей эры. Вероятно, сегодня не существует человеческой культуры, в которой бы не было употребления алкоголя. Сегодня напитки с содержанием алкоголя от двух до пяти процентов («почти пиво» и пиво) до 50 процентов (некоторые формы водки) известны и потребляются людьми. Несмотря на широкое использование в качестве напитка, этиловый спирт имеет ряд коммерческих и промышленных применений, на которые приходится более 90 процентов всех соединений, производимых в Соединенных Штатах.
Это одно из первых химических веществ, открытых и использованных людьми. Керамические кувшины, по-видимому, предназначенные для хранения пива, датируются периодом неолита, около 10 000 лет до нашей эры. Некоторые ученые предполагают, что люди, возможно, научились варить пиво и включили его в свой ежедневный рацион еще до того, как начали готовить и употреблять хлеб.Изготовление и употребление вина — явная тема египетских пиктограмм, датируемых четвертым тысячелетием до нашей эры. Вероятно, сегодня не существует человеческой культуры, в которой бы не было употребления алкоголя. Сегодня напитки с содержанием алкоголя от двух до пяти процентов («почти пиво» и пиво) до 50 процентов (некоторые формы водки) известны и потребляются людьми. Несмотря на широкое использование в качестве напитка, этиловый спирт имеет ряд коммерческих и промышленных применений, на которые приходится более 90 процентов всех соединений, производимых в Соединенных Штатах.
КАК ЭТО ПРОИЗВОДИТСЯ
Этиловый спирт производится одним из двух способов: естественным путем в процессе ферментации или синтетическим путем, начиная с соединений, содержащихся в нефти. До начала Второй мировой войны более 90 процентов всего этилового спирта, производимого в США и других развитых странах, производилось путем ферментации. Отработанный сироп, оставшийся от производства сахара из сахарного тростника, обрабатывали ферментами при температуре от 20 ° C до 38 ° C (от 68 ° F до 100 ° F) в течение 28-72 часов.В этих условиях около 90 процентов сиропа превращается в этиловый спирт.
До начала Второй мировой войны более 90 процентов всего этилового спирта, производимого в США и других развитых странах, производилось путем ферментации. Отработанный сироп, оставшийся от производства сахара из сахарного тростника, обрабатывали ферментами при температуре от 20 ° C до 38 ° C (от 68 ° F до 100 ° F) в течение 28-72 часов.В этих условиях около 90 процентов сиропа превращается в этиловый спирт.
Со временем были разработаны синтетические методы производства этилового спирта. В одном из таких способов этилен (этен; CH 2 = CH 2 ) обрабатывают серной кислотой и водой с получением этилового спирта. Этот метод был популярен в 1950-х и 1960-х годах. Затем был изобретен новый метод приготовления смеси. В этом процессе этилен и вода нагреваются вместе при высоких температурах [от 300 ° C до 400 ° C (от 570 ° F до 750 ° F)] и высоком давлении [1000 фунтов на квадратный дюйм (6.9 мегапаскалей)] над катализатором фосфорной кислоты (H 3 PO 4 ). Эффективность этого метода выше, чем у старого метода, и получение этилового спирта с помощью этого процесса имеет меньше последствий для окружающей среды.
Эффективность этого метода выше, чем у старого метода, и получение этилового спирта с помощью этого процесса имеет меньше последствий для окружающей среды.
По состоянию на 2003 год около 94 процентов всего этилового спирта было произведено путем ферментации. Остальное получали методом фосфорной кислоты.
ОБЫЧНОЕ ИСПОЛЬЗОВАНИЕ И ПОТЕНЦИАЛЬНАЯ ОПАСНОСТЬ
В 2005 году методами ферментации было произведено 10 500 миллионов литров (2 790 миллионов галлонов) этилового спирта.Из этого количества 92 процента было использовано в качестве топлива или добавки к топливу. Многие эксперты предполагают, что потребители используют смесь бензина (90 процентов) и этилового спирта (10 процентов), называемую бензином, в качестве автомобильного топлива, поскольку она сгорает более полно и выделяет меньше вредных побочных продуктов в окружающую среду. Хотя газохол еще не стал очень популярным в Соединенных Штатах, он широко используется в некоторых других частях мира, в первую очередь в Бразилии.
Интересные факты
- Все члены семейства органических соединений спиртов (такие как метиловый спирт, этиловый спирт и изопропиловый спирт) в определенной степени токсичны.Только этиловый спирт безопасно пить в относительно небольших количествах. Даже в этом случае концентрация алкоголя в крови менее 5 процентов может привести к смерти.
- Концентрация алкоголя в напитке часто выражается как «доказательное» число. Прочность напитка в два раза превышает его концентрацию алкоголя. Таким образом, в напитке крепостью 80% концентрация алкоголя составляет 40 процентов.
Из оставшихся 8 процентов этилового спирта, произведенного путем ферментации, половина была использована в промышленных операциях в качестве растворителя или промежуточного звена при получении других химических соединений; а половина была использована в производстве алкогольных напитков.
В 2005 году методом фосфорной кислоты было произведено около 650 миллионов литров (170 миллионов галлонов) этилового спирта. Из этого количества 60 процентов было использовано для промышленных растворителей при производстве туалетных принадлежностей и косметики, покрытий и чернил, моющих и бытовых чистящих средств, фармацевтических препаратов и других продуктов. Остальные 40 процентов были использованы для получения других химических соединений, включая этилакрилат, уксус, этиламины, этилацетат, простые эфиры гликоля и прочие материалы.
Из этого количества 60 процентов было использовано для промышленных растворителей при производстве туалетных принадлежностей и косметики, покрытий и чернил, моющих и бытовых чистящих средств, фармацевтических препаратов и других продуктов. Остальные 40 процентов были использованы для получения других химических соединений, включая этилакрилат, уксус, этиламины, этилацетат, простые эфиры гликоля и прочие материалы.
Этиловый спирт обычно встречается в одной из трех основных форм. Абсолютный спирт — это этиловый спирт, содержащий менее 1% примесей, таких как вода. Абсолютный спирт сделать очень сложно, потому что этиловый спирт будет поглощать воду из атмосферы или любого другого доступного источника. Этиловый спирт, используемый в топливе и почти на всех промышленных предприятиях, представляет собой смесь 95 процентов этилового спирта и 5 процентов воды. И абсолютный, и 95-процентный этиловый спирт чрезвычайно токсичны.Проглатывание даже очень небольшого количества любой жидкости имеет серьезные последствия для здоровья, включая смерть.
Алкоголь, с которым обычно контактирует большинство людей, — это этиловый спирт, смешанный с водой в алкогольных напитках, таких как пиво, вино, джин, водка, ром или бурбон. В таких напитках концентрация этилового спирта составляет от нескольких процентов до 50 процентов.
Воздействие этилового спирта на организм человека зависит от типа потребляемого напитка и времени, затраченного на его употребление.Питье пятипроцентного пива в течение часа оказывает на организм совсем другое воздействие, чем пятипроцентная водка за пять минут.
Этиловый спирт является депрессантом центральной нервной системы. После приема внутрь он проходит через желудок и тонкий кишечник человека, где быстро всасывается в кровоток. Затем он путешествует по телу, нарушая нормальное функционирование нервной системы и вызывая такие симптомы, как сонливость, невнятная речь, нечеткое зрение, неустойчивая походка, нарушение суждения и сокращение времени реакции.При более высокой концентрации алкоголя в крови эти симптомы могут стать более серьезными, что приведет к коме и смерти.
Слова, которые нужно знать
- КАТАЛИЗАТОР
- Материал, который увеличивает скорость химической реакции без каких-либо изменений в своей химической структуре.
- MISCIBLE
- можно смешивать; особенно относится к смешиванию одной жидкости с другой.
- СИНТЕЗ
- Химическая реакция, в которой некоторый желаемый химический продукт образуется из простых начальных химикатов или реагентов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
«Алкоголь». Эровид. http://www.erowid.org/chemicals/alcohol/alcohol.shtml (по состоянию на 7 октября 2005 г.).
«Алкоголь: то, чего вы не знаете, может навредить вам». Национальный институт злоупотребления алкоголем и алкоголизма. http://pubs.niaaa.nih.gov/publications/WhatUDontKnow_HTML/dontknow.htm (по состоянию на 7 октября 2005 г.).
Богган, Уильям. «Алкоголь и ты». http://chemcases.com/alcohol/ (по состоянию на 7 октября 2005 г.).
«Химикат недели: этанол. «http://scifun.chem.wisc.edu/chemweek/ethanol/ethanol.html (доступ 7 октября 2005 г.).
«http://scifun.chem.wisc.edu/chemweek/ethanol/ethanol.html (доступ 7 октября 2005 г.).
« Этанол ». http://www.ucc.ie/ucc/depts/chem /dolchem/html/comp/ethanol.html (доступ 7 октября 2005 г.).
«Как работает алкоголь.» Как работает материал. http://science.howstuffworks.com/alcohol.htm (проверено 7 октября 2005 г.) 2005).
Что такое этиловый спирт?
Этиловый спирт, также известный как этанол, является активным ингредиентом алкогольных напитков. Пока вы пьете его, когда употребляете такие вещи, как пиво, спиртные напитки и вино, употребление этилового спирта само по себе опасно и может привести к летальному исходу.
Продолжите чтение, чтобы узнать о химическом составе этилового спирта, от его химического состава и производственного процесса до того, чем он отличается от изопропилового спирта.
Этиловый спирт — это то же самое, что этанол?
Этиловый спирт — это еще одно название этанола. Это летучие, легковоспламеняющиеся органические соединения, которые можно распознать по сильному запаху. Этанол — единственный вид алкоголя, который может безопасно употребляться людьми, то есть в виде алкогольных напитков.Чистый этанол токсичен и может вызвать кому или даже смерть.
Этанол — единственный вид алкоголя, который может безопасно употребляться людьми, то есть в виде алкогольных напитков.Чистый этанол токсичен и может вызвать кому или даже смерть.
Другие виды спирта, такие как изопропиловый спирт (IPA) и бутиловый спирт, очень токсичны и не подлежат употреблению. Эти спирты могут вызвать слепоту и смерть даже при очень низких концентрациях.
Этиловый спирт — одно из доисторических открытий человечества, которое широко используется и сегодня. Открытие употребления алкоголя в развлекательных целях, скорее всего, появилось еще до появления самого человека. Фактически, некоторые виды приматов намеренно едят ферментирующие фрукты, чтобы напиться! Этот метод создания этилового спирта путем ферментации сладких продуктов до сих пор остается самым популярным методом производства и известен как ферментация сахара.
Помимо алкогольных напитков, этанол в больших количествах производится как биотопливо и добавка к бензину. Этот спирт также имеет другие промышленные применения в качестве растворителя и реагента.
Каков химический состав этилового спирта?
Этиловый спирт или этанол представляет собой относительно простое органическое соединение с химической формулой C 2 H 6 O. Формулу также можно записать в виде структурной формулы: CH 3 -CH 2 -OH или просто C 2 H 5 OH.
Как видно из структурной формулы, этильная группа связана с гидроксильной группой. Это следует обобщенной формуле для спирта: C n H 2n + 1 OH.
Более обобщенная формула спирта — R-OH. R представляет собой углеводородную цепь, а OH представляет собой гидроксильную группу. Две группы образуют угол 109 градусов друг с другом, как показано на рисунке ниже:
Учитывая его молекулярный состав, эмпирически определена молярная масса, равная 46.069 г · моль -1 . Молярную массу можно приблизительно определить, сложив атомные веса всех ее элементов.
Углерод имеет приблизительный атомный вес 12, но, поскольку есть два атома углерода, общий вес углерода равен 24. Между тем, атомный вес кислорода равен 16, а атомный вес водорода равен 1, но, поскольку атомов водорода шесть, общий вес водорода равен 6. Следовательно, молярная масса рассчитывается как: 24 + 16 + 6 = 46.
Между тем, атомный вес кислорода равен 16, а атомный вес водорода равен 1, но, поскольку атомов водорода шесть, общий вес водорода равен 6. Следовательно, молярная масса рассчитывается как: 24 + 16 + 6 = 46.
Из чего сделан этиловый спирт?
Сахарное брожение
Наиболее распространенный способ производства этилового спирта — ферментация крахмалистых или сладких пищевых продуктов, таких как виноград или рис.Ферментация — это сложный биохимический процесс, в котором участвует живой организм. Для сбраживания крахмалистого источника используют один из видов грибов (дрожжи). Упрощенный путь ферментации проиллюстрирован ниже:
Вот некоторые из наиболее распространенных видов алкогольных напитков и их ферментированных ингредиентов:
- Эль: Ферментированный из солода с хмелем
- Пиво: Солодовое зерно злаков, например ячмень, используется для ферментации, а хмель добавляется для аромата
- Бренди: Обычно дистиллируется из вина или любых ферментированных фруктов сок.
 рис и очень популярен в Японии. пюре из зерна, такого как рожь, кукуруза или ячмень
рис и очень популярен в Японии. пюре из зерна, такого как рожь, кукуруза или ячмень - Вино: Один из старейших и наиболее распространенных источников алкоголя ол, вино — сброженный сок свежего винограда
Этилен гидратация
Другой путь производства этилового спирта — это нефтехимические процессы, такие как гидратация этилена, как показано в приведенной ниже сбалансированной формуле.В качестве катализатора в этой реакции используется разбавленная серная кислота:
Можно ли пить этиловый спирт?
Хотя этиловый спирт является активным ингредиентом алкогольных напитков и единственным видом алкоголя, который безопасно пить таким образом, употребление чистого этанола может привести к коме или даже смерти.
В алкогольных напитках этанол можно употреблять ответственно, но только до определенного предела. В среднем безопасна концентрация алкоголя в крови от 0,020 до 0,039%.В этой концентрации этанол вызывает опьянение и потерю ингибирования. Однако, когда концентрация алкоголя в крови достигает 0,25%, начинается отравление алкоголем, вызывающее потерю сознания. Когда он достигнет 0,40%, человек впадет в кому и может умереть.
Однако, когда концентрация алкоголя в крови достигает 0,25%, начинается отравление алкоголем, вызывающее потерю сознания. Когда он достигнет 0,40%, человек впадет в кому и может умереть.
Различные люди имеют разную толерантность к алкоголю до того, как впадут в интоксикацию. Такие факторы, как еда и вес тела, влияют на толерантность к употреблению алкоголя, поэтому всегда пейте ответственно и знайте свой предел.
В чем разница между этиловым спиртом и изопропиловым спиртом?
И этиловый, и изопропиловый спирт (IPA) обычно используются в качестве дезинфицирующих средств, особенно в качестве медицинского спирта. Однако IPA ядовит при проглатывании даже в очень малых концентрациях.
По химическому составу они очень похожи. По сравнению с этанолом (C 2 H 6 O) изопропиловый спирт имеет химическую формулу C 3 H 8 O, которая также может быть записана как CH 3 CHOHCH 3 . Как видите, изопропильная группа присоединена к гидроксильной группе. Это простейшая форма вторичного спирта, в которой атом углерода спирта присоединен к двум другим атомам углерода.
Как видите, изопропильная группа присоединена к гидроксильной группе. Это простейшая форма вторичного спирта, в которой атом углерода спирта присоединен к двум другим атомам углерода.
Что безопаснее: этиловый спирт или изопропиловый спирт?
С точки зрения потенциального вреда для человека, этиловый спирт имеет наименьшие риски, даже при высоких концентрациях. Следовательно, этанол безопаснее изопропилового спирта. Тем не менее, оба вещества легко воспламеняются и могут вызвать раздражение слизистой оболочки. В то время как IPA не следует употреблять в любых концентрациях, этанол также не следует употреблять в высоких концентрациях.
При работе с любым из спиртов следует носить средства индивидуальной защиты, например очки. Вы также должны избегать воспламенения любого из этих спиртов, так как они легко воспламеняются.
различных способов использования этилового спирта
Характеристики этилового спирта / этанола
Этанол широко известен как этиловый спирт, но его также называют чистым спиртом, зерновым спиртом и питьевым спиртом. Его можно охарактеризовать как бесцветную жидкость, растворимую в воде. Он также имеет легкий запах и немного сладкий в разбавленном виде.Однако в неразбавленном или концентрированном виде он имеет очень сильный вкус и оставляет жгучий привкус.
Его можно охарактеризовать как бесцветную жидкость, растворимую в воде. Он также имеет легкий запах и немного сладкий в разбавленном виде.Однако в неразбавленном или концентрированном виде он имеет очень сильный вкус и оставляет жгучий привкус.
Этиловый спирт — это алкоголь, содержащийся в алкогольных напитках, таких как пиво, бренди или виски. Он производится в результате ферментации или химического расщепления сахаров дрожжами. Его делают из растений и злаков, таких как кукуруза, пшеница, ячмень. Этанол можно получить путем измельчения зерен и затем их ферментации с помощью дрожжей. В процессе ферментации крахмал зерен превращается в спирт.Затем идет процесс дистилляции.
Спирт в медицине
Спирт обычно используется в медицине как антисептическое и дезинфицирующее средство. В медицинских салфетках и антибактериальных дезинфицирующих средствах для рук содержится спирт, который помогает предотвратить распространение бактерий в больницах и связанных с ними учреждениях. Спирт также используется для стерилизации кожи перед инъекциями. Больницы и медицинские клиники используют спирт для стерилизации различного медицинского оборудования до и после использования. Для этого можно использовать этиловый спирт и изопропиловый спирт.
Спирт также используется для стерилизации кожи перед инъекциями. Больницы и медицинские клиники используют спирт для стерилизации различного медицинского оборудования до и после использования. Для этого можно использовать этиловый спирт и изопропиловый спирт.
Изопропиловый спирт
При использовании спирта в качестве дезинфицирующего или дезинфицирующего средства вы, вероятно, используете изопропиловый спирт. Изопропиловый спирт получают из пропана, который обычно получают из ископаемого топлива, такого как нефть и уголь. Изопропиловый спирт денатурирован, что означает добавление токсичного вещества для предотвращения потребления. Изопропиловый спирт не рекомендуется использовать в качестве растворителя для экстрактов. Изопропиловый спирт может оставлять в экстрактах нежелательные примеси.
Пищевой этиловый спирт в качестве растворителя
Пищевой этиловый спирт можно безопасно использовать в качестве растворителя для различных продуктов, таких как кулинарные экстракты, эфирные масла, настойки и концентраты. Использование пищевого этилового спирта минимизирует количество примесей, которые могут загрязнить ваши экстракты и настойки. Он также практически не оставляет следов.
Использование пищевого этилового спирта минимизирует количество примесей, которые могут загрязнить ваши экстракты и настойки. Он также практически не оставляет следов.
Этиловый спирт часто используется в качестве финальной промывки при экстракции BHO и CO2.
Независимо от того, новичок вы или специалист по экстракции, пищевой экстрактогол может помочь вам создать масла и концентраты высочайшего качества!
Extractohol предлагает на ваш выбор 190 пищевых продуктов из органического тростникового спирта и 200 пищевых этиловых спиртов.
Метанол — Энциклопедия Нового Света
| Метанол | |
|---|---|
| Общие | |
| Систематическое название | метанол |
| Другие названия | гидроксиметан метиловый спирт древесный спирт карбинол |
| Молекулярная формула | СН 3 ОН |
| УЛЫБКИ | CO |
| Молярная масса | 32. 04 г / моль 04 г / моль |
| Внешний вид | бесцветная жидкость |
| Номер CAS | [67-56-1] |
| Недвижимость | |
| Плотность и фаза | 0,7918 г / см³, жидкость |
| Растворимость в воде | Полностью смешиваемый |
| Температура плавления | –97 ° С (176 К) |
| Температура кипения | 64,7 ° С (337,8 К) |
| Кислотность (p K a ) | ~ 15.5 |
| Вязкость | 0,59 мПа · с при 20 ° C |
| Структура | |
| Молекулярная форма | Тетраэдрический и изогнутый |
| Дипольный момент | 1,69 D (газ) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Классификация ЕС | Легковоспламеняющийся ( F ) Ядовитый ( T ) |
| NFPA 704 | 3 1 0 |
| R-фразы | R11, R23 / 24/25, R39 / 23/24/25 |
| S-фразы | S1 / 2, S7, S16, S36 / 37, S45 |
| Температура вспышки | 11 ° С |
| Пределы воспламеняемости в воздухе (по объему) | 6. 72% — 36,50% 72% — 36,50% |
| Номер RTECS | PC1400000 |
| Страница дополнительных данных | |
| Структура и свойства | n , ε r и т. Д. |
| Термодинамические характеристики | Фазовое поведение Твердое, жидкое, газовое |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные алканолы | этанол бутанол |
| Родственные соединения | хлорметан метоксиметан |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | |
Метанол , также известный как метиловый спирт , карбинол , древесный спирт , древесная нафта или древесный спирт , является простейшим спиртом. Его химическая формула — CH 3 OH. Это бесцветная, летучая, легковоспламеняющаяся жидкость с характерным запахом, который несколько мягче и слаще, чем этанол (этиловый спирт). Он ядовит, и с ним нужно обращаться осторожно.
Его химическая формула — CH 3 OH. Это бесцветная, летучая, легковоспламеняющаяся жидкость с характерным запахом, который несколько мягче и слаще, чем этанол (этиловый спирт). Он ядовит, и с ним нужно обращаться осторожно.
Метанол используется в качестве растворителя, топлива и антифриза. Однако его основное применение — производство других химикатов. Около 40 процентов метанола превращается в формальдегид, который, в свою очередь, используется в таких продуктах, как пластмассы, краски, взрывчатые вещества и текстиль.Его добавляют в этанол для производства так называемого денатурированного спирта (то есть этанола, который стал токсичным), который находит различное применение в промышленности. [1]
Естественное происхождение
Метанол естественным образом образуется в результате анаэробного метаболизма многих видов бактерий. В результате в атмосфере остается низкий уровень паров метанола. В течение нескольких дней атмосферный метанол окисляется кислородом с помощью солнечного света с образованием углекислого газа и воды.
История
В процессе бальзамирования древние египтяне использовали смесь веществ, в том числе метанол, которые они получали при пиролизе древесины. Однако чистый метанол был впервые выделен в 1661 году Робертом Бойлем, который назвал его спиртом коробки , потому что он производил его путем дистилляции самшита. Позже он стал известен как пироксилиновый спирт . В 1834 году французские химики Жан-Батист Дюма и Эжен Пелиго определили его элементный состав.Они также ввели слово метилен в органическую химию, образовав его от греческого methy = «вино» + hŷlē = дерево (участок деревьев). Его предполагаемое происхождение было «алкоголь, сделанный из дерева (вещества)», но в нем есть ошибки на греческом языке. Термин «метил» был получен примерно в 1840 году путем обратного образования из метилена , а затем был применен для описания «метилового спирта». Это было сокращено до «метанола» в 1892 году Международной конференцией по химической номенклатуре.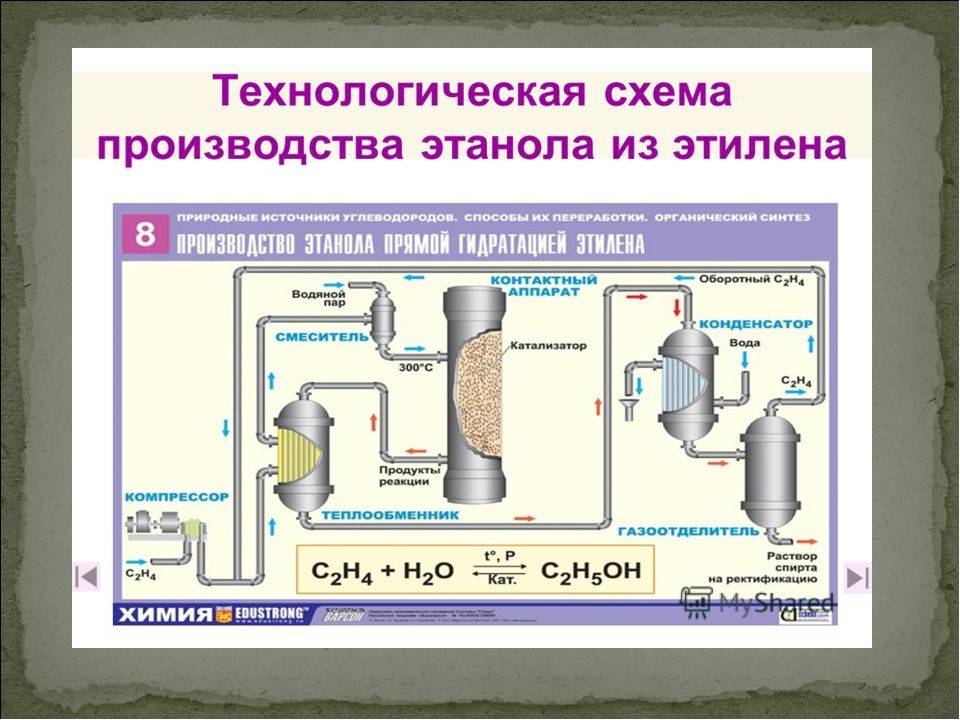 Суффикс -yl, используемый в органической химии для образования названий радикалов, был извлечен из слова «метил».
Суффикс -yl, используемый в органической химии для образования названий радикалов, был извлечен из слова «метил».
В 1923 году немецкий химик Матиас Пьер, работавший на BASF, разработал средство для преобразования синтез-газа (смесь оксидов углерода и водорода) в метанол. В этом процессе использовался катализатор на основе хромата цинка и требовались чрезвычайно жесткие условия — давление в диапазоне 30–100 МПа (300–1000 атм) и температура около 400 ° C. Современное производство метанола стало более эффективным за счет использования катализаторов (обычно медных), способных работать при более низких давлениях.
Использование метанола в качестве моторного топлива привлекло внимание во время нефтяного кризиса 1970-х годов из-за его доступности и низкой стоимости. Проблемы возникли на ранних этапах разработки смесей бензин-метанол. Из-за его низкой цены некоторые продавцы бензина сделали его слишком смешанным. Другие использовали неправильную технику смешивания и обработки. Это привело к проблемам потребителей и средств массовой информации, а также к последнему отказу от метанольных смесей. Однако по-прежнему существует большой интерес к использованию метанола в качестве чистого (несмешанного) топлива.Автомобили с гибким топливом, которые в настоящее время производятся General Motors, Ford и Chrysler, могут работать на любой комбинации этанола, метанола и / или бензина. Чистое спиртовое топливо получит более широкое распространение по мере того, как будут производиться автомобили с более гибким топливом.
Это привело к проблемам потребителей и средств массовой информации, а также к последнему отказу от метанольных смесей. Однако по-прежнему существует большой интерес к использованию метанола в качестве чистого (несмешанного) топлива.Автомобили с гибким топливом, которые в настоящее время производятся General Motors, Ford и Chrysler, могут работать на любой комбинации этанола, метанола и / или бензина. Чистое спиртовое топливо получит более широкое распространение по мере того, как будут производиться автомобили с более гибким топливом.
В 2006 году астрономы с помощью радиотелескопов MERLIN в обсерватории Джодрелл-Бэнк обнаружили в космосе большое облако метанола диаметром 300 миллиардов миль.
Недвижимость
При обычных температуре и давлении метанол представляет собой жидкость с плотностью 0.7918 г / см³. Он имеет температуру плавления –97 ° C, точку кипения 64,7 ° C и температуру вспышки 11 ° C.
Метанол горит на воздухе с образованием диоксида углерода и воды:
- 2 CH 3 OH + 3 O 2 → 2 CO 2 + 4 H 2 O
Пламя метанола почти бесцветное. Следует проявлять осторожность при сжигании метанола, чтобы не обжечься на почти невидимом огне.
Следует проявлять осторожность при сжигании метанола, чтобы не обжечься на почти невидимом огне.
Метанол вызывает коррозию некоторых металлов, включая алюминий.Хотя она и является слабой кислотой, она разрушает оксидное покрытие, которое обычно защищает алюминий от коррозии:
- 6 CH 3 OH + Al 2 O 3 → 2 Al (OCH 3 ) 3 + 3 H 2 O
Полученный метоксид алюминия растворим в метаноле. В результате поверхность алюминия очищается от оксидного покрытия, а затем легко окисляется некоторым количеством растворенного кислорода. Также метанол может действовать как окислитель:
- 6 CH 3 OH + 2 Al → 2 Al (OCH 3 ) 3 + 3 H 2
Этот взаимный процесс эффективно разжигает коррозию до тех пор, пока металл не выветрится или не произойдет концентрация CH 3 OH становится незначительным.
Искусственное производство
Знаете ли вы?
Метанол часто называют древесным спиртом
Метанол часто называют древесным спиртом, потому что когда-то он производился в основном как побочный продукт разрушающей перегонки древесины.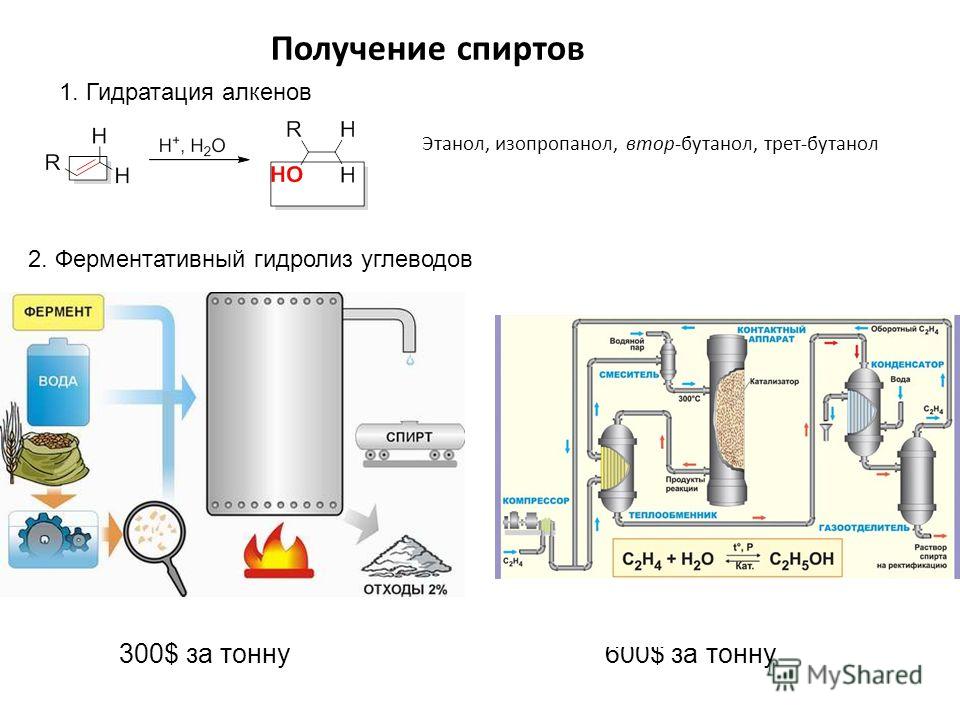 Теперь его производят синтетическим путем, используя многоступенчатый процесс. Короче говоря, природный газ и пар реформируются в печи для получения водорода и окиси углерода. Этот этап эндотермический (он поглощает тепло). Затем газообразные водород и монооксид углерода вступают в реакцию под давлением в присутствии катализатора с образованием метанола.Эта стадия синтеза является экзотермической (выделяется тепло).
Теперь его производят синтетическим путем, используя многоступенчатый процесс. Короче говоря, природный газ и пар реформируются в печи для получения водорода и окиси углерода. Этот этап эндотермический (он поглощает тепло). Затем газообразные водород и монооксид углерода вступают в реакцию под давлением в присутствии катализатора с образованием метанола.Эта стадия синтеза является экзотермической (выделяется тепло).
Сегодня синтез-газ чаще всего производится из метанового компонента природного газа, а не из угля. В коммерческой практике практикуются три процесса. При умеренном давлении от 1 до 2 МПа (10–20 атм) и высоких температурах (около 850 ° C) метан реагирует с паром на никелевом катализаторе с образованием синтез-газа в соответствии с химическим уравнением:
- CH 4 + H 2 O → CO + 3 H 2
Эта реакция, обычно называемая паро-метановым риформингом или SMR, является эндотермической, и ограничения теплопередачи накладывают ограничения на размер каталитического нейтрализатора. реакторы использовались.Метан также может подвергаться частичному окислению молекулярным кислородом с образованием синтез-газа, как показывает следующее уравнение:
реакторы использовались.Метан также может подвергаться частичному окислению молекулярным кислородом с образованием синтез-газа, как показывает следующее уравнение:
- 2 CH 4 + O 2 → 2 CO + 4 H 2
эта реакция является экзотермической, и выделяемое тепло можно использовать in-situ для проведения реакции парового риформинга метана. Объединение двух процессов называется автотермическим риформингом. Соотношение CO и H 2 можно регулировать с помощью реакции конверсии водяного газа,
- CO + H 2 O → CO 2 + H 2 ,
, чтобы обеспечить подходящую стехиометрию для синтеза метанола.
Затем окись углерода и водород реагируют на втором катализаторе с образованием метанола. Сегодня наиболее широко используемым катализатором является смесь меди, оксида цинка и оксида алюминия, впервые использованная ICI в 1966 году. При 5–10 МПа (50–100 атм) и 250 ° C он может катализировать производство метанола из углерода.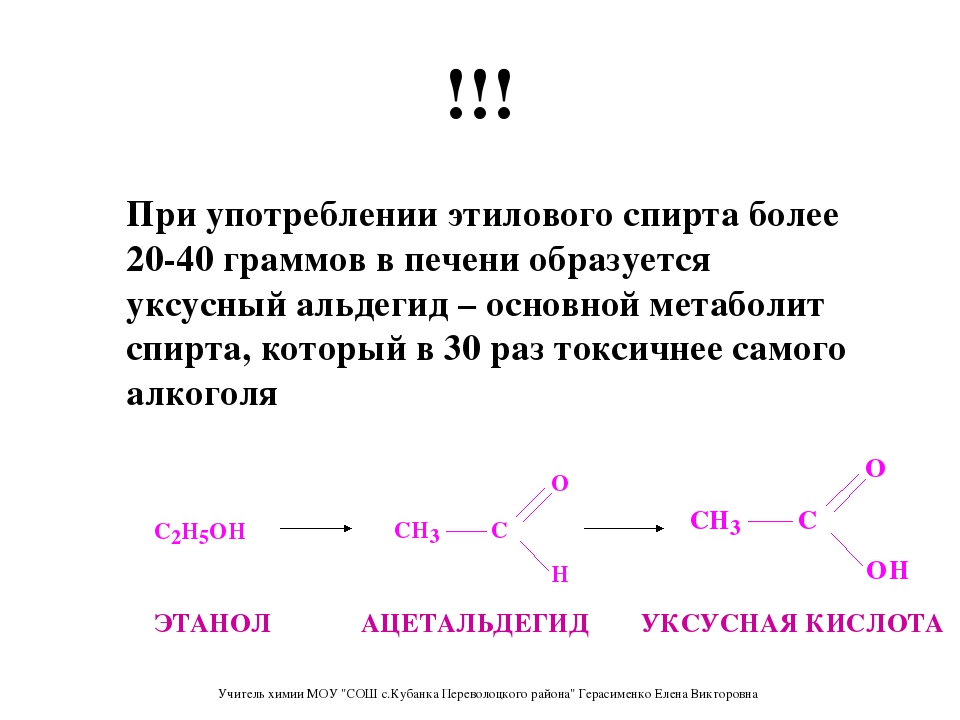 монооксид и водород с высокой селективностью
монооксид и водород с высокой селективностью
- CO + 2 H 2 → CH 3 OH
Стоит отметить, что производство синтез-газа из метана дает 3 моля водорода на каждый моль монооксида углерода, в то время как синтез метанола расходует только 2 моля. водорода на каждый моль окиси углерода.Один из способов справиться с избытком водорода — это ввести диоксид углерода в реактор синтеза метанола, где он также реагирует с образованием метанола в соответствии с химическим уравнением
- CO 2 + 3 H 2 → CH 3 OH + H 2 O
Хотя природный газ является наиболее экономичным и широко используемым сырьем для производства метанола, можно использовать и другое сырье. Там, где нет природного газа, вместо него можно использовать светлые нефтепродукты.Южноафриканская компания Sasol производит метанол, используя синтез-газ из угля.
использует
- Наибольшее количество метанола на сегодняшний день используется для производства других химикатов.
 Около 40 процентов метанола превращается в формальдегид, а из него в такие разнообразные продукты, как пластмассы, фанера, краски, взрывчатые вещества и ткани для прочного прессования.
Около 40 процентов метанола превращается в формальдегид, а из него в такие разнообразные продукты, как пластмассы, фанера, краски, взрывчатые вещества и ткани для прочного прессования.
- Метанол также используется в качестве растворителя и антифриза в трубопроводах и жидкости для омывателя лобового стекла.
- Метанол используется в качестве топлива для двигателей внутреннего сгорания в ограниченных количествах, в основном из-за того, что он не так легко воспламеняется, как бензин.Смеси метанола являются предпочтительным топливом для гоночных трасс с открытыми колесами, таких как Champcars, а также для радиоуправляемых авиамоделей (требуемых в двигателях со свечами накаливания, которые в основном питают их), легковых и грузовых автомобилях. Гоночные автомобили с треком по кругу грязи, такие как автомобили Sprint, поздние модели и модификации, используют метанол в качестве топлива для своих двигателей. Дрэг-рейсеры и гонщики по грязи также используют метанол в качестве основного источника топлива.
 Метанол требуется для двигателя с наддувом в Top Alcohol Dragster, и до конца сезона 2005 года все автомобили Indianapolis 500 должны были работать на метаноле.Грязевые гонщики смешали метанол с бензином и закисью азота, чтобы получить больше энергии, чем только бензин и закись азота. Одним из недостатков метанола как топлива является его коррозионная активность по отношению к некоторым металлам, в том числе к алюминию, о чем говорилось ранее.
Метанол требуется для двигателя с наддувом в Top Alcohol Dragster, и до конца сезона 2005 года все автомобили Indianapolis 500 должны были работать на метаноле.Грязевые гонщики смешали метанол с бензином и закисью азота, чтобы получить больше энергии, чем только бензин и закись азота. Одним из недостатков метанола как топлива является его коррозионная активность по отношению к некоторым металлам, в том числе к алюминию, о чем говорилось ранее.
- Помимо непосредственного использования в качестве топлива, метанол (или, реже, этанол) используется в качестве компонента в химическом образовании биодизельного топлива.
- Полученный из древесины или других органических материалов органический метанол (биоспирт) был предложен в качестве возобновляемой альтернативы углеводородам на нефтяной основе.Однако нельзя использовать BA100 (100-процентный биоспирт) в современных бензиновых автомобилях без модификации.
- Метанол — традиционный ингредиент метилированного спирта или денатурированного спирта.

- Во время Второй мировой войны метанол использовался в качестве топлива в нескольких конструкциях немецких военных ракет под названием M-Stoff и в смеси под названием C-Stoff .
- На некоторых очистных сооружениях небольшое количество метанола добавляется в сточные воды, чтобы обеспечить пищевой источник углерода для бактерий денитрификации, которые превращают нитраты в азот.
- В начале 1970-х годов процесс превращения метанола в бензин был разработан компанией Mobil, которая производит бензин, готовый для использования в транспортных средствах. Один промышленный объект был построен в Новой Зеландии в 1980-х годах.
- В 1990-х годах большие количества метанола использовались в Соединенных Штатах для производства метил-трет-бутилового эфира, присадки к бензину (МТБЭ). Закон о чистом воздухе 1990 г. потребовал от некоторых крупных городов использовать МТБЭ в бензине для уменьшения фотохимического смога.
 Однако к концу 1990-х годов было обнаружено, что МТБЭ просочился из резервуаров для хранения бензина в грунтовые воды в количестве, достаточном для того, чтобы повлиять на вкус питьевой воды из городских источников во многих районах.Более того, исследования на животных показали, что МТБЭ является канцерогеном. В результате негативной реакции несколько штатов запретили использование МТБЭ, и его будущее производство остается неопределенным.
Однако к концу 1990-х годов было обнаружено, что МТБЭ просочился из резервуаров для хранения бензина в грунтовые воды в количестве, достаточном для того, чтобы повлиять на вкус питьевой воды из городских источников во многих районах.Более того, исследования на животных показали, что МТБЭ является канцерогеном. В результате негативной реакции несколько штатов запретили использование МТБЭ, и его будущее производство остается неопределенным.
- Топливные элементы с прямым использованием метанола уникальны тем, что работают при низких температурах и атмосферном давлении, что позволяет их миниатюризировать до беспрецедентной степени. Это, в сочетании с относительно простым и безопасным хранением и обращением с метанолом, может открыть возможность создания бытовой электроники с питанием от топливных элементов.
- Другие химические производные метанола включают диметиловый эфир, который заменил хлорфторуглероды в качестве пропеллента для аэрозольного распыления, и уксусную кислоту.

Здоровье и безопасность
Метанол может попасть в организм при проглатывании, вдыхании или абсорбции через кожу. Он токсичен после того, как метаболизируется в печени ферментом алкогольдегидрогеназой с образованием формальдегида, который, в свою очередь, вызывает слепоту, разрушая зрительный нерв. [2] Проглатывание метанола также может быть фатальным, поскольку оно может угнетать центральную нервную систему так же, как отравление этанолом.Ткани плода не переносят метанол. Опасные дозы будут накапливаться, если человек регулярно подвергается воздействию паров или обращается с жидкостью без защиты кожи.
При проглатывании метанола следует немедленно связаться с врачом. Обычная смертельная доза составляет 100–125 мл (4 жидких унции). Токсические эффекты проявляются через несколько часов, а эффективные антидоты часто могут предотвратить необратимое повреждение. Это лечится этанолом или фомепизолом. [3] Любой из этих препаратов замедляет действие алкогольдегидрогеназы на метанол посредством конкурентного ингибирования, так что он выводится почками, а не превращается в токсичные метаболиты.
Начальными симптомами отравления метанолом являются симптомы угнетения центральной нервной системы: головная боль, головокружение, тошнота, нарушение координации, спутанность сознания, сонливость и, при достаточно больших дозах, потеря сознания и смерть. Начальные симптомы воздействия метанола обычно менее серьезны, чем симптомы, возникающие при приеме такого же количества этилового спирта.
После того, как первые симптомы прошли, через 10–30 часов после первоначального воздействия метанола возникает второй набор симптомов: нечеткость или полная потеря зрения вместе с ацидозом.Эти симптомы возникают в результате накопления токсичных уровней формиата в кровотоке и могут привести к смерти из-за дыхательной недостаточности. Сложноэфирные производные метанола не обладают этой токсичностью.
Этанол иногда денатурируют (фальсифицируют) и, таким образом, делают непригодным для питья путем добавления метанола. Результат известен как метилированный спирт или «метамфетамин» (в Великобритании). (Последний не следует путать с meth , распространенным сокращением для метамфетамина.)
(Последний не следует путать с meth , распространенным сокращением для метамфетамина.)
Чистый метанол используется в гонках на открытых колесах с середины 1960-х годов.В отличие от нефтяных пожаров, метанольные пожары можно потушить простой водой (хотя метанол менее плотен, чем вода, они смешиваются, и добавление воды заставит огонь использовать свое тепло для кипячения воды). Кроме того, огонь на основе метанола горит незаметно, в отличие от бензина, который горит густым черным дымом. В случае возгорания на трассе дым не закрывает обзор быстро приближающимся водителям. Решение навсегда перейти на метанол в американских гонках IndyCar было результатом разрушительной аварии и взрыва на гоночной трассе Indianapolis 500 1964 года, в результате которой погибли водители Эдди Сакс и Дэйв Макдональд.
Одна проблема, связанная с добавлением метанола в автомобильное топливо, выявляется недавним воздействием на грунтовые воды топливной добавки метил-трет-бутилового эфира (МТБЭ). Утечки из подземных резервуаров для хранения бензина привели к образованию шлейфов МТБЭ в грунтовых водах, которые в конечном итоге привели к загрязнению колодезной воды. Высокая растворимость метанола в воде вызывает опасения, что подобное загрязнение колодезной воды могло возникнуть в результате широкого использования метанола в качестве автомобильного топлива.
Утечки из подземных резервуаров для хранения бензина привели к образованию шлейфов МТБЭ в грунтовых водах, которые в конечном итоге привели к загрязнению колодезной воды. Высокая растворимость метанола в воде вызывает опасения, что подобное загрязнение колодезной воды могло возникнуть в результате широкого использования метанола в качестве автомобильного топлива.
См. Также
Банкноты
- ↑ Добавление яда освобождает промышленный этанол от довольно значительных налогов на «спиртные напитки», которые в противном случае взимались бы, поскольку этанол является основой всех питьевых алкогольных напитков.
- ↑ Каляни Корабатина, Токсичность метанола Medscape. Проверено 26 сентября 2016 г.
- ↑ Марсель Дж. Казаван «Фомепизол в лечении отравлений», Педиатрия, 107 (1) (2001). Проверено 26 сентября 2016 года.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Макмерри, Джон.
 Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс / Коул, 2004. ISBN 0534420052.
Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс / Коул, 2004. ISBN 0534420052. - Моррисон, Роберт Т., и Роберт Н. Бойд. Органическая химия . 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1992. ISBN 0136436692.
- Solomons, T.W. Грэхем и Крейг Б. Фрайл. Органическая химия . 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998.
Внешние ссылки
Все ссылки получены 19 сентября 2018 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Уксусная кислота — Энциклопедия Нового Света
| Уксусная кислота | |
|---|---|
| Общие | |
| Систематическое название | уксусная кислота этановая кислота |
| Другие названия | Метанкарбоновая кислота Гидроксид ацетила (AcOH) Ацетат водорода (HAc) |
| Молекулярная формула | CH 3 COOH |
| УЛЫБКИ | CC (= O) O |
| Молярная масса | 60. 05 г / моль 05 г / моль |
| Внешний вид | Бесцветная жидкость или кристаллы |
| Номер CAS | [64-19-7] |
| Недвижимость | |
| Плотность и фаза | 1,049 г см −3 , жидкий 1,266 г см −3 , твердый |
| Растворимость в воде | Полностью смешиваемый |
| В этаноле, ацетоне В толуоле, гексане В сероуглероде | Полностью смешивается Полностью смешивается Практически не растворяется |
| Температура плавления | 16.5 ° C (289,6 ± 0,5 K) (61,6 ° F) [1] |
| Точка кипения | 118,1 ° C (391,2 ± 0,6 K) (244,5 ° F) [1] |
| Кислотность (p K a ) | 4,76 при 25 ° C |
| Вязкость | 1,22 мПа · с в 25 ° C |
| Дипольный момент | 1,74 D (газ) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материала |
| Классификация ЕС | Коррозийный ( C ) |
| NFPA 704 | 2 2 0 |
| Температура вспышки | 43 ° С |
| R-фразы | R10, R35 |
| S-фразы | S1 / 2, S23, S26, S45 |
U. S. Допустимый предел воздействия S. Допустимый предел воздействия (PEL) | 10 частей на миллион |
| Страница дополнительных данных | |
| Структура и свойства | n , ε r и т. Д. |
| Термодинамические данные | Фазовое поведение Твердое, жидкое, газовое |
| Спектральные данные | УФ, ИК, ЯМР, МС |
| Родственные соединения | |
| Родственные карбоновые кислоты | Муравьиная кислота Пропионовая кислота Масляная кислота |
| Родственные соединения | Ацетамид Этилацетат Ацетилхлорид Уксусный ангидрид Ацетонитрил Ацетальдегид Этанол тиоуксусная кислота |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C, 100 кПа) | |
Уксусная кислота , также известная как этановая кислота , представляет собой органическое химическое соединение, наиболее известное благодаря тому, что оно придает уксусу кислый вкус и резкий запах. Это одна из простейших карбоновых кислот (вторая по простоте после муравьиной кислоты) и имеет химическую формулу CH 3 COOH. В чистом, безводном состоянии, называемом ледяной уксусной кислотой , это бесцветная гигроскопичная жидкость, замерзающая при температуре ниже 16,7 ° C (62 ° F) до бесцветного кристаллического твердого вещества. Он вызывает коррозию, и его пары раздражают глаза, вызывают ощущение жжения в носу и могут вызвать боль в горле и заложенность легких. Термин ацетат используется для обозначения карбоксилат-аниона (CH 3 COO —) или любой из солей или сложных эфиров уксусной кислоты.
Это одна из простейших карбоновых кислот (вторая по простоте после муравьиной кислоты) и имеет химическую формулу CH 3 COOH. В чистом, безводном состоянии, называемом ледяной уксусной кислотой , это бесцветная гигроскопичная жидкость, замерзающая при температуре ниже 16,7 ° C (62 ° F) до бесцветного кристаллического твердого вещества. Он вызывает коррозию, и его пары раздражают глаза, вызывают ощущение жжения в носу и могут вызвать боль в горле и заложенность легких. Термин ацетат используется для обозначения карбоксилат-аниона (CH 3 COO —) или любой из солей или сложных эфиров уксусной кислоты.
Эта кислота является важным химическим реагентом и промышленным химическим веществом, используемым для производства различных синтетических волокон и других полимерных материалов. Эти полимеры включают полиэтилентерефталат, используемый в основном в бутылках для безалкогольных напитков; ацетат целлюлозы, используемый в основном для фотопленки; и поливинилацетат для столярного клея. В домашних условиях разбавленная уксусная кислота часто используется в качестве средства для удаления накипи. Пищевая промышленность использует его (под кодом пищевой добавки E260) в качестве регулятора кислотности.
В домашних условиях разбавленная уксусная кислота часто используется в качестве средства для удаления накипи. Пищевая промышленность использует его (под кодом пищевой добавки E260) в качестве регулятора кислотности.
Мировой спрос на уксусную кислоту оценивается примерно в 6,5 миллионов метрических тонн в год (Мт / год). Из этого количества около 1,5 млн тонн в год приходится на переработку; остальное производится из нефтехимического сырья или биологических источников.
Номенклатура
Тривиальное название уксусная кислота — наиболее часто используемое и официально предпочтительное название Международного союза чистой и прикладной химии (IUPAC). Это название происходит от ацетум, латинского слова , обозначающего уксус.Синоним этановая кислота — это систематическое название, которое иногда используется при введении в химическую номенклатуру.
Ледяная уксусная кислота — банальное название безводной уксусной кислоты. Подобно немецкому названию Eisessig (буквально, ледяной уксус), название происходит от ледяных кристаллов, которые образуются при температуре 16,7 ° C (около 62 ° F) при температуре чуть ниже комнатной.
Наиболее распространенное и официальное сокращение для уксусной кислоты — AcOH или HOAc , где Ac обозначает ацетильную группу CH 3 -C (= O) — ;.В контексте кислотно-основных реакций часто используется аббревиатура HAc , где Ac вместо этого обозначает ацетат-анион (CH 3 COO — ), хотя такое использование рассматривается многими как вводящее в заблуждение. В любом случае Ac не следует путать с сокращением химического элемента актиний.
Уксусная кислота имеет эмпирическую формулу CH 2 O и молекулярную формулу C 2 H 4 O 2 .Последний часто записывается как CH 3 -COOH, CH 3 COOH или CH 3 CO 2 H, чтобы лучше отразить его структуру. Ион, образующийся в результате потери H + из уксусной кислоты, представляет собой анион ацетата . Название ацетат может также относиться к соли, содержащей этот анион, или сложному эфиру уксусной кислоты.
История
Уксус стара, как сама цивилизация, а может, и старше. Бактерии, продуцирующие уксусную кислоту, присутствуют во всем мире, и любая культура, практикующая пивоварение или вино, неизбежно обнаружила уксус как естественный результат воздействия этих алкогольных напитков на воздух.
Использование уксусной кислоты в химии уходит в глубь веков. В III веке в г. до н. Э. , греческий философ Теофраст описал, как уксус воздействует на металлы, производя пигменты, полезные в искусстве, в том числе белый свинец, (карбонат свинца) и verdigris, зеленую смесь солей меди, включая ацетат меди (II). Древние римляне варили кислое вино в свинцовых горшках, чтобы получить очень сладкий сироп под названием сапа. Сапа был богат ацетатом свинца, сладким веществом, также называемым сахаром свинца или сахаром Сатурна, который способствовал отравлению свинцом среди римской аристократии.Персидский алхимик VIII века Джабир ибн Хайян (Гебер) сконцентрировал уксусную кислоту из уксуса путем дистилляции.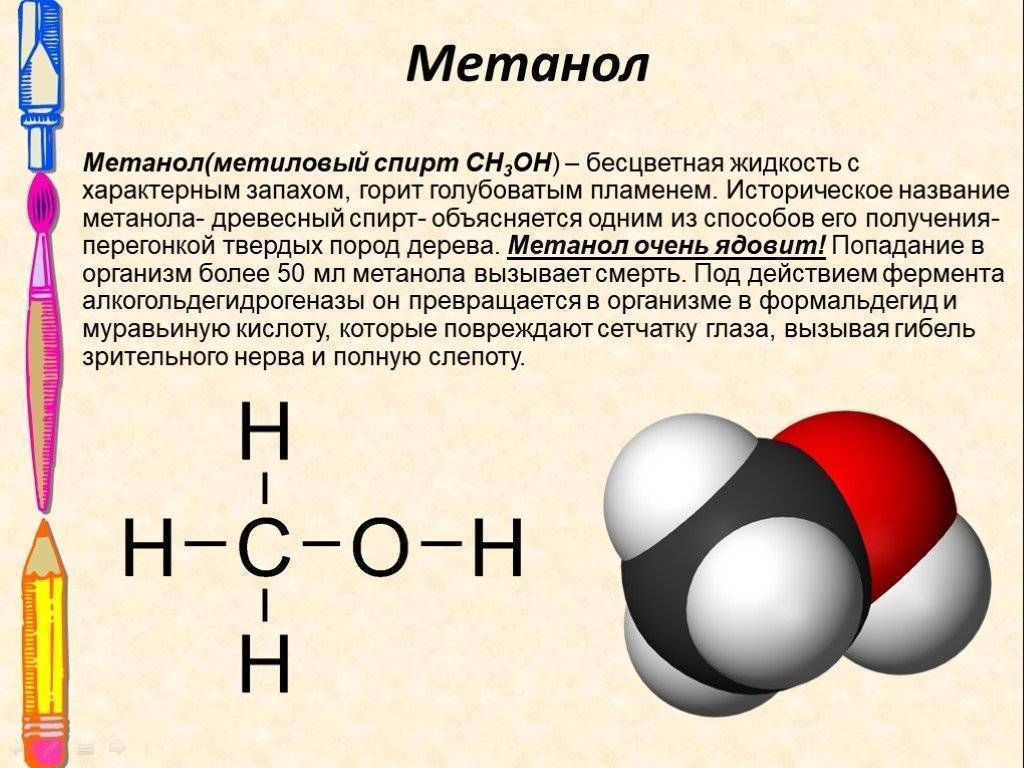
В эпоху Возрождения ледяную уксусную кислоту получали сухой перегонкой ацетатов металлов. Немецкий алхимик шестнадцатого века Андреас Либавиус описал такую процедуру и сравнил полученную таким образом ледяную уксусную кислоту с уксусом. Присутствие воды в уксусе настолько сильно влияет на свойства уксусной кислоты, что на протяжении веков многие химики считали, что ледяная уксусная кислота и кислота, содержащаяся в уксусе, — это два разных вещества.Французский химик Пьер Адэ доказал их идентичность.
В 1847 году немецкий химик Герман Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Эта последовательность реакций состояла из хлорирования сероуглерода до четыреххлористого углерода с последующим пиролизом до тетрахлорэтилена и водным хлорированием до трихлоруксусной кислоты и завершалась электролитическим восстановлением до уксусной кислоты.
Деталь кристаллов уксусной кислоты. К 1910 году большая часть ледяной уксусной кислоты была получена из «пирогенного раствора» перегонки древесины. Уксусную кислоту выделяли из него обработкой известковым молоком, а затем полученный ацетат кальция подкисляли серной кислотой для извлечения уксусной кислоты. В то время Германия производила 10 000 тонн ледяной уксусной кислоты, около 30 процентов которой использовалось для производства красителя индиго. [2] [3]
Уксусную кислоту выделяли из него обработкой известковым молоком, а затем полученный ацетат кальция подкисляли серной кислотой для извлечения уксусной кислоты. В то время Германия производила 10 000 тонн ледяной уксусной кислоты, около 30 процентов которой использовалось для производства красителя индиго. [2] [3]
Химические свойства
- Кислотность
Атом водорода (H) в карбоксильной группе (-COOH) в карбоновых кислотах, таких как уксусная кислота, может быть выделен как ион H + (протон), что придает им кислотный характер.Уксусная кислота представляет собой слабую, эффективно монопротоновую кислоту в водном растворе со значением pK , равным , равным 4,8. Основание его конъюгата — ацетат (CH 3 COO — ). 1,0 М раствор (примерно концентрация домашнего уксуса) имеет pH 2,4, что указывает на то, что диссоциирует только 0,4 процента молекул уксусной кислоты.
- Циклический димер

Кристаллическая структура уксусной кислоты [4] показывает, что молекулы объединяются в димеры, соединенные водородными связями.Димеры также можно обнаружить в паре при 120 ° C. Они также встречаются в жидкой фазе в разбавленных растворах в растворителях, не связывающих водород, и в некоторой степени в чистой уксусной кислоте, [5] , но разрушаются растворителями, связывающими водородные связи. Энтальпия диссоциации димера оценивается в 65,0–66,0 кДж / моль, а энтропия диссоциации — в 154–157 Дж / моль –1 K –1 . [6] Такое поведение димеризации характерно для других низших карбоновых кислот.
- Растворитель
Жидкая уксусная кислота — гидрофильный (полярный) протонный растворитель, подобный этанолу и воде.Обладая умеренной диэлектрической проницаемостью 6,2, он может растворять не только полярные соединения, такие как неорганические соли и сахара, но также неполярные соединения, такие как масла, и такие элементы, как сера и йод.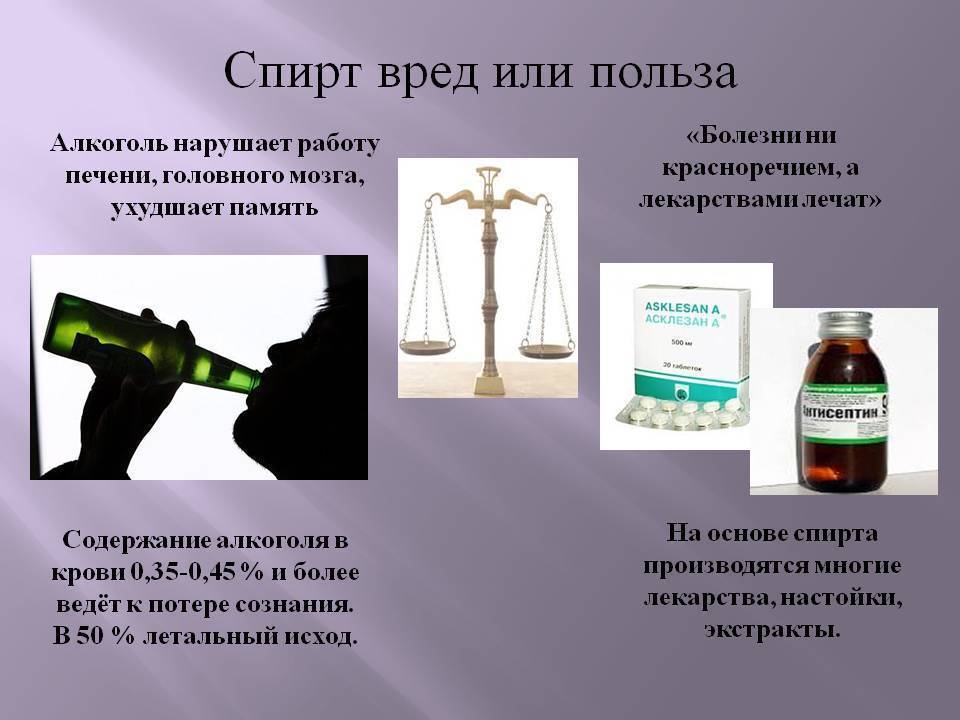 Он легко смешивается со многими другими полярными и неполярными растворителями, такими как вода, хлороформ и гексан. Эта способность растворять и смешиваться с уксусной кислотой делает ее широко используемым промышленным химическим веществом.
Он легко смешивается со многими другими полярными и неполярными растворителями, такими как вода, хлороформ и гексан. Эта способность растворять и смешиваться с уксусной кислотой делает ее широко используемым промышленным химическим веществом.
- Химические реакции
Уксусная кислота вызывает коррозию многих металлов, включая железо, магний и цинк, образуя газообразный водород и соли металлов, называемые ацетатами.Под воздействием кислорода алюминий образует на своей поверхности тонкий слой оксида алюминия, который является относительно устойчивым, поэтому алюминиевые резервуары можно использовать для транспортировки уксусной кислоты. Ацетаты металлов также можно получить из уксусной кислоты и подходящего основания, как в популярной реакции «пищевая сода + уксус». За исключением ацетата хрома (II), почти все ацетаты растворимы в воде.
- Mg (s) + 2 CH 3 COOH (водн.) → (CH 3 COO) 2 Mg (вод.) + H 2 (g)
- NaHCO 3 (s) + CH 3 COOH (водн.
 ) → CH 3 COONa (водн.) + CO 2 (г) + H 2 O (л)
) → CH 3 COONa (водн.) + CO 2 (г) + H 2 O (л)
Уксусная кислота претерпевает типичные химические реакции карбоновой кислоты, такие как образование этановой кислоты при взаимодействии со щелочами, образование этаноата металла при взаимодействии с металлом и образование этаноата металла, воды и диоксида углерода при взаимодействии с карбонатами и гидрокарбонатами.Наиболее примечательной из всех его реакций является образование этанола путем восстановления и образование производных, таких как ацетилхлорид, путем так называемого «нуклеофильного ацильного замещения». Другие замещающие производные включают уксусный ангидрид; этот ангидрид образуется в результате потери воды двумя молекулами уксусной кислоты. Сложные эфиры уксусной кислоты также могут быть образованы этерификацией Фишера, а также могут быть образованы амиды. При нагревании выше 440 ° C уксусная кислота разлагается с образованием диоксида углерода и метана или кетена и воды.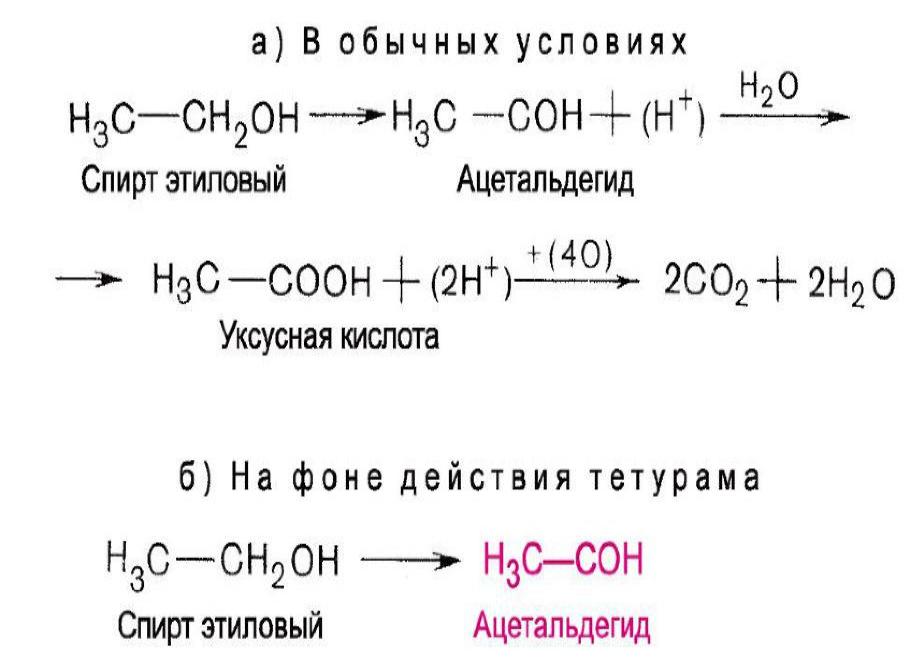
- Обнаружение
Уксусную кислоту можно определить по ее характерному запаху. Цветная реакция для солей уксусной кислоты — это раствор хлорида железа (III), который дает темно-красный цвет, который исчезает после подкисления. Ацетаты при нагревании с триоксидом мышьяка образуют оксид какодила, который можно обнаружить по его парам с неприятным запахом.
Биохимия
Ацетильная группа, производная уксусной кислоты, играет фундаментальную роль в биохимии практически всех форм жизни.Связанный с коферментом А, он играет центральную роль в метаболизме углеводов и жиров. Однако концентрация свободной уксусной кислоты в клетках поддерживается на низком уровне, чтобы избежать нарушения контроля pH содержимого клетки. В отличие от некоторых карбоновых кислот с более длинной цепью (жирных кислот), уксусная кислота не встречается в природных триглицеридах. Однако искусственный триглицерид триацетин (триацетат глицерина) является обычной пищевой добавкой и содержится в косметике и лекарствах местного действия.
Уксусная кислота вырабатывается и выделяется некоторыми бактериями, в частности, из рода Acetobacter и Clostridium acetobutylicum. Эти бактерии повсеместно встречаются в продуктах питания, воде и почве, а уксусная кислота вырабатывается естественным путем при порче фруктов и некоторых других пищевых продуктов. Уксусная кислота также входит в состав вагинальной смазки людей и других приматов, где она, по-видимому, служит мягким антибактериальным средством. [7]
Производство
Завод очистки и обогащения уксусной кислоты 1884 г. Уксусная кислота производится как синтетическим путем, так и путем бактериальной ферментации. Сегодня на биологический путь приходится лишь около 10 процентов мирового производства, но он остается важным для производства уксуса, поскольку многие мировые законы о чистоте пищевых продуктов предусматривают, что уксус, используемый в пищевых продуктах, должен быть биологического происхождения.Около 75 процентов уксусной кислоты, используемой в химической промышленности, получают карбонилированием метанола, как описано ниже. Остальное учитывают альтернативные методы. [8]
Остальное учитывают альтернативные методы. [8]
Общее мировое производство первичной уксусной кислоты оценивается в 5 Мт / год (миллион метрических тонн в год), примерно половина из которых производится в Соединенных Штатах. Производство в Европе составляет примерно 1 млн т / год и сокращается, а 0,7 млн т / год производится в Японии. Еще 1,5 млн т перерабатываются ежегодно, в результате чего общий мировой рынок достигает 6.5 млн т / год. [9] Двумя крупнейшими производителями первичной уксусной кислоты являются компании Celanese и BP Chemicals. Другие крупные производители включают Millennium Chemicals, Sterling Chemicals, Samsung, Eastman и Svensk Etanolkemi.
Карбонилирование метанола
Большая часть первичной уксусной кислоты производится карбонилированием метанола. В этом процессе метанол и окись углерода реагируют с образованием уксусной кислоты в соответствии с химическим уравнением:
- CH 3 OH + CO → CH 3 COOH
В процессе используется йодметан в качестве промежуточного продукта, и он проходит в три этапа. Катализатор, обычно комплекс металла, необходим для карбонилирования (стадия 2).
Катализатор, обычно комплекс металла, необходим для карбонилирования (стадия 2).
- (1) CH 3 OH + HI → CH 3 I + H 2 O
- (2) CH 3 I + CO → CH 3 COI
- (3 ) CH 3 COI + H 2 O → CH 3 COOH + HI
Изменяя условия процесса, на той же установке можно производить уксусный ангидрид. Поскольку и метанол, и окись углерода являются товарным сырьем, карбонилирование метанола долгое время казалось привлекательным методом для производства уксусной кислоты.Генри Дрефюс из британской компании Celanese еще в 1925 году разработал пилотную установку карбонилирования метанола. маршруты на некоторое время. Первый коммерческий процесс карбонилирования метанола, в котором использовался кобальтовый катализатор, был разработан немецкой химической компанией BASF в 1963 году. В 1968 году катализатор на основе родия ( цис — [Rh (CO) 2 I 2 ] — ), который может эффективно работать при более низком давлении практически без побочных продуктов. Первый завод, использующий этот катализатор, был построен американской химической компанией.
Monsanto в 1970 г. и катализируемое родием карбонилирование метанола стало доминирующим методом производства уксусной кислоты (см. Процесс Monsanto). В конце 1990-х годов химическая компания BP Chemicals начала коммерциализацию катализатора Cativa ([Ir (CO) 2 I 2 ] — ), который промотируется рутением. Этот процесс с иридиевым катализатором является более экологичным и более эффективным [11] и в значительной степени вытеснил процесс Monsanto, часто на тех же производственных предприятиях.
Первый завод, использующий этот катализатор, был построен американской химической компанией.
Monsanto в 1970 г. и катализируемое родием карбонилирование метанола стало доминирующим методом производства уксусной кислоты (см. Процесс Monsanto). В конце 1990-х годов химическая компания BP Chemicals начала коммерциализацию катализатора Cativa ([Ir (CO) 2 I 2 ] — ), который промотируется рутением. Этот процесс с иридиевым катализатором является более экологичным и более эффективным [11] и в значительной степени вытеснил процесс Monsanto, часто на тех же производственных предприятиях.
Окисление ацетальдегида
До коммерциализации процесса Monsanto большая часть уксусной кислоты производилась путем окисления ацетальдегида. Это остается вторым по важности методом производства, хотя он неконкурентоспособен с карбонилированием метанола. Ацетальдегид может быть получен путем окисления бутана или легкой нафты или путем гидратации этилена.
Когда бутан или легкая нафта нагревают воздухом в присутствии различных ионов металлов, в том числе ионов марганца, кобальта и хрома, пероксиды образуются, а затем разлагаются с образованием уксусной кислоты в соответствии с химическим уравнением
- 2 C 4 H 10 + 5 O 2 → 4 CH 3 COOH + 2 H 2 O
Обычно реакция протекает при комбинации температуры и давления, предназначенной для как можно более горячим, сохраняя при этом бутан в жидком состоянии.Типичные условия реакции — 150 ° C и 55 атм. Также могут образовываться несколько побочных продуктов, включая бутанон, этилацетат, муравьиную кислоту и пропионовую кислоту. Эти побочные продукты также имеют коммерческую ценность, и условия реакции могут быть изменены для получения большего количества из них, если это экономически целесообразно. Однако отделение уксусной кислоты от этих побочных продуктов увеличивает стоимость процесса.
В аналогичных условиях и с использованием катализаторов, аналогичных используемым для окисления бутана, ацетальдегид может окисляться кислородом воздуха с образованием уксусной кислоты.
- 2 CH 3 CHO + O 2 → 2 CH 3 COOH
При использовании современных катализаторов эта реакция может иметь выход уксусной кислоты более 95%.Основными побочными продуктами являются этилацетат, муравьиная кислота и формальдегид, все из которых имеют более низкие температуры кипения, чем уксусная кислота, и легко отделяются отгонкой.
Окисление этилена
Ферментация
- Окислительное брожение
На протяжении большей части истории человечества уксусная кислота в форме уксуса вырабатывалась бактериями рода Acetobacter. При наличии достаточного количества кислорода эти бактерии могут производить уксус из различных пищевых продуктов, содержащих алкоголь.Обычно используемые корма включают яблочный сидр, вино и ферментированное зерно, солод, рис или картофельное пюре. Общая химическая реакция, которой способствуют эти бактерии,
- C 2 H 5 OH + O 2 → CH 3 COOH + H 2 O
Разбавленный спиртовой раствор, инокулированный Acetobacter и хранящийся в теплом, проветриваемом месте, станет уксус в течение нескольких месяцев. Промышленные методы производства уксуса ускоряют этот процесс, улучшая снабжение бактерий кислородом.
Промышленные методы производства уксуса ускоряют этот процесс, улучшая снабжение бактерий кислородом.
Первые партии уксуса, произведенные путем ферментации, вероятно, были связаны с ошибками в процессе виноделия. Если сусло ферментируется при слишком высокой температуре, acetobacter подавляет естественные дрожжи, встречающиеся в винограде. По мере роста спроса на уксус для кулинарных, медицинских и санитарных целей виноделы быстро научились использовать другие органические материалы для производства уксуса в жаркие летние месяцы, прежде чем виноград созрел и был готов для переработки в вино. Однако этот метод был медленным и не всегда успешным, поскольку виноделы не понимали его.
Одним из первых современных коммерческих процессов был «быстрый метод» или «немецкий метод», впервые примененный в Германии в 1823 году. В этом процессе ферментация происходит в башне, заполненной древесной стружкой или древесным углем. Спиртосодержащий корм поступает в верхнюю часть градирни, а свежий воздух подается снизу за счет естественной или принудительной конвекции. Улучшенная подача воздуха в этом процессе сократила время на приготовление уксуса с месяцев до недель.
Улучшенная подача воздуха в этом процессе сократила время на приготовление уксуса с месяцев до недель.
В настоящее время большая часть уксуса производится в погруженных резервуарах, впервые описанных в 1949 году Отто Хроматкой и Генрихом Эбнером.В этом методе спирт ферментируется до уксуса в резервуаре с непрерывным перемешиванием, а кислород подается путем барботирования воздуха через раствор. Используя этот метод, можно приготовить 15-процентный уксус уксусной кислоты всего за два-три дня.
- Анаэробная ферментация
Некоторые виды анаэробных бактерий, в том числе несколько представителей рода Clostridium, , могут преобразовывать сахара в уксусную кислоту напрямую, без использования этанола в качестве промежуточного продукта. Общая химическая реакция, проводимая этими бактериями, может быть представлена как:
- C 6 H 12 O 6 → 3 CH 3 COOH
Что более интересно с точки зрения промышленного химика, многие из этих ацетогенных бактерий могут производить уксусную кислоту из одноуглеродных соединений. , включая метанол, оксид углерода или смесь диоксида углерода и водорода:
, включая метанол, оксид углерода или смесь диоксида углерода и водорода:
- 2 CO 2 + 4 H 2 → CH 3 COOH + 2 H 2 O
Эта способность Clostridium напрямую использовать сахара или производить уксусную кислоту из менее дорогостоящих ресурсов, означает, что эти бактерии потенциально могут производить уксусную кислоту более эффективно, чем окислители этанола, такие как Acetobacter. Однако бактерии Clostridium менее устойчивы к кислотам, чем бактерии Acetobacter. Даже самые кислотоустойчивые штаммы Clostridium могут производить уксус с содержанием уксусной кислоты всего несколько процентов по сравнению с некоторыми штаммами Acetobacter , которые могут производить уксус с содержанием уксусной кислоты до 20 процентов. В настоящее время остается более рентабельным производить уксус с использованием Acetobacter , чем производить его с использованием Clostridium с последующим его концентрированием. В результате, хотя ацетогенные бактерии известны с 1940 года, их промышленное использование по-прежнему ограничено несколькими нишевыми приложениями.
В результате, хотя ацетогенные бактерии известны с 1940 года, их промышленное использование по-прежнему ограничено несколькими нишевыми приложениями.
Приложения
2,5-литровая бутылка уксусной кислоты в лаборатории.Уксусная кислота — химический реагент для производства многих химических соединений. Наибольшее разовое использование уксусной кислоты — это производство мономера винилацетата, за которым следует производство уксусного ангидрида и сложного эфира. Объем уксусной кислоты, используемой в уксусе, сравнительно невелик.
Мономер винилацетата
В основном уксусная кислота используется для производства мономера винилацетата (ВАМ). Это приложение потребляет от 40 до 45 процентов мирового производства уксусной кислоты. Реакция протекает с этиленом и уксусной кислотой с кислородом над палладиевым катализатором.
- 2 H 3 C-COOH + 2 C 2 H 4 + O 2 → 2 H 3 C-CO-O-CH = CH 2 + 2 H 2 O
Винилацетат можно полимеризовать до поливинилацетата или других полимеров, которые используются в красках и клеях.
Ангидрид уксусной кислоты
Продукт конденсации двух молекул уксусной кислоты — уксусный ангидрид. Мировое производство уксусного ангидрида является одним из основных приложений, и на него уходит от 25 до 30 процентов мирового производства уксусной кислоты. Уксусный ангидрид может быть получен непосредственно карбонилированием метанола в обход кислоты, а растения Cativa могут быть адаптированы для производства ангидрида.
Уксусный ангидрид — сильный агент ацетилирования. Таким образом, его основное применение — ацетат целлюлозы, синтетический текстиль, также используемый для фотопленки.Уксусный ангидрид также является реагентом для производства аспирина, героина и других соединений.
Уксус
В виде уксуса растворы уксусной кислоты (обычно от 5 до 18 процентов уксусной кислоты, процентное содержание обычно рассчитывается по массе) используются непосредственно в качестве приправы, а также при мариновании овощей и других пищевых продуктов.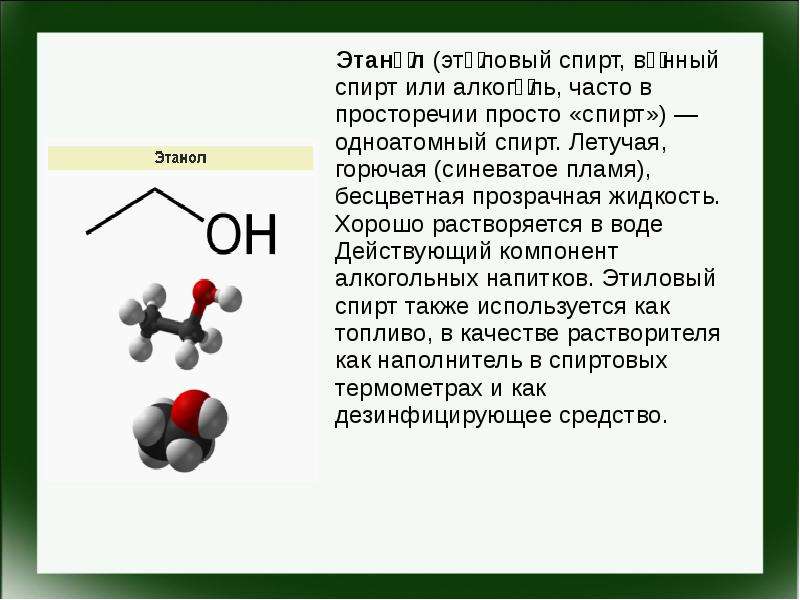 Столовый уксус, как правило, более разбавлен (от 5 до 8 процентов уксусной кислоты), в то время как для промышленного маринования пищевых продуктов обычно используются более концентрированные растворы.Количество уксусной кислоты, используемой в качестве уксуса в мировом масштабе, невелико, но исторически это, безусловно, самое древнее и наиболее известное применение.
Столовый уксус, как правило, более разбавлен (от 5 до 8 процентов уксусной кислоты), в то время как для промышленного маринования пищевых продуктов обычно используются более концентрированные растворы.Количество уксусной кислоты, используемой в качестве уксуса в мировом масштабе, невелико, но исторически это, безусловно, самое древнее и наиболее известное применение.
Использовать как растворитель
Ледяная уксусная кислота — отличный полярный протонный растворитель, как отмечалось выше. Его часто используют в качестве растворителя при перекристаллизации для очистки органических соединений. Чистая расплавленная уксусная кислота используется в качестве растворителя при производстве терефталевой кислоты (ТРА), сырья для полиэтилентерефталата (ПЭТ).Хотя в настоящее время на долю уксусной кислоты во всем мире приходится 5–10 процентов, ожидается, что в следующем десятилетии эта конкретная область применения значительно вырастет по мере роста производства ПЭТ.
Уксусная кислота часто используется в качестве растворителя для реакций с участием карбокатионов, таких как алкилирование Фриделя-Крафтса. Например, одна стадия промышленного производства синтетической камфоры включает перегруппировку камфена по методу Вагнера-Меервейна в изоборнилацетат; здесь уксусная кислота действует как растворитель и как нуклеофил, улавливая перегруппированный карбокатион.Уксусная кислота является предпочтительным растворителем при восстановлении арилнитрогруппы до анилина с использованием палладия на угле.
Например, одна стадия промышленного производства синтетической камфоры включает перегруппировку камфена по методу Вагнера-Меервейна в изоборнилацетат; здесь уксусная кислота действует как растворитель и как нуклеофил, улавливая перегруппированный карбокатион.Уксусная кислота является предпочтительным растворителем при восстановлении арилнитрогруппы до анилина с использованием палладия на угле.
Ледяная уксусная кислота используется в аналитической химии для определения слабощелочных веществ, таких как органические амиды. Ледяная уксусная кислота является гораздо более слабым основанием, чем вода, поэтому амид в этой среде ведет себя как сильное основание. Затем его можно титровать, используя раствор в ледяной уксусной кислоте очень сильной кислоты, такой как хлорная кислота.
Другие приложения
Разбавленные растворы уксусной кислоты также используются из-за их слабой кислотности.Примеры использования в домашних условиях включают использование стопорной ванны во время проявления фотопленок и средств для удаления накипи для удаления накипи с кранов и чайников. Кислотность также используется для лечения укуса коробчатой медузы путем отключения жалящих клеток медузы, предотвращения серьезных травм или смерти при немедленном применении, а также для лечения инфекций наружного уха у людей с помощью таких препаратов, как Восол. Аналогичным образом, уксусная кислота используется в качестве консерванта для спрея для силоса домашнего скота, чтобы препятствовать росту бактерий и грибков.
Кислотность также используется для лечения укуса коробчатой медузы путем отключения жалящих клеток медузы, предотвращения серьезных травм или смерти при немедленном применении, а также для лечения инфекций наружного уха у людей с помощью таких препаратов, как Восол. Аналогичным образом, уксусная кислота используется в качестве консерванта для спрея для силоса домашнего скота, чтобы препятствовать росту бактерий и грибков.
Ледяная уксусная кислота также используется в качестве средства для удаления бородавок и бородавок. Для предотвращения распространения на кожу вокруг бородавки наносят кольцо вазелина, а на бородавку или бородавку наносят одну-две капли ледяной уксусной кислоты. Лечение повторяют ежедневно. Этот метод безболезненен и имеет высокий уровень успеха, в отличие от многих других методов лечения. Поглощение ледяной уксусной кислоты в небольших количествах безопасно.
Несколько органических или неорганических солей производятся из уксусной кислоты, в том числе:
- Ацетат натрия — используется в текстильной промышленности и как пищевой консервант (E262).

- Ацетат меди (II) — используется как пигмент и фунгицид.
- Ацетат алюминия и ацетат железа (II) — используются в качестве протравы для красителей.
- Ацетат палладия (II) — используется в качестве катализатора реакций органического сочетания, таких как реакция Хека.
Производимые замещенные уксусные кислоты включают:
- Монохлоруксусная кислота (MCA), дихлоруксусная кислота (считается побочным продуктом) и трихлоруксусная кислота. MCA используется при производстве красителя индиго.
- Бромуксусная кислота, которая этерифицируется с образованием реагента этилбромацетата.
- Трифторуксусная кислота — обычный реагент в органическом синтезе.
Количество уксусной кислоты, используемой в этих других применениях вместе (кроме TPA), составляет еще 5–10 процентов от общего использования уксусной кислоты во всем мире. Однако не ожидается, что эти приложения будут расти так же быстро, как производство ТФК.
Безопасность
Концентрированная уксусная кислота вызывает коррозию, поэтому с ней необходимо обращаться с осторожностью, поскольку она может вызвать ожоги кожи, необратимое повреждение глаз и раздражение слизистых оболочек. Эти ожоги или волдыри могут появиться только через несколько часов после воздействия. Латексные перчатки не обеспечивают защиты, поэтому при работе с компаундом следует надевать особо прочные перчатки, например, из нитрилового каучука. Концентрированная уксусная кислота с некоторыми трудностями может быть воспламенена в лаборатории. Он становится легковоспламеняющимся, если температура окружающей среды превышает 39 ° C (102 ° F), и может образовывать взрывоопасные смеси с воздухом при температуре выше этой (пределы взрываемости: 5,4–16 процентов).
Эти ожоги или волдыри могут появиться только через несколько часов после воздействия. Латексные перчатки не обеспечивают защиты, поэтому при работе с компаундом следует надевать особо прочные перчатки, например, из нитрилового каучука. Концентрированная уксусная кислота с некоторыми трудностями может быть воспламенена в лаборатории. Он становится легковоспламеняющимся, если температура окружающей среды превышает 39 ° C (102 ° F), и может образовывать взрывоопасные смеси с воздухом при температуре выше этой (пределы взрываемости: 5,4–16 процентов).
Опасности растворов уксусной кислоты зависят от концентрации.В следующей таблице приведена классификация растворов уксусной кислоты ЕС:
| Концентрация по весу | Молярность | Классификация | R-фраз |
|---|---|---|---|
| 10% –25% | 1,67–4,16 моль / л | Раздражающий ( Xi ) | R36 / 38 |
| 25% –90% | 4,16–14,99 моль / л | Коррозийный ( C ) | R34 |
| > 90% | > 14. 99 моль / л 99 моль / л | Коррозийный ( C ) | R10, R35 |
Растворы с более чем 25% уксусной кислоты хранятся в вытяжном шкафу из-за резкого едкого едкого пара. Разбавленная уксусная кислота в виде уксуса безвредна. Однако прием более сильных растворов опасен для жизни людей и животных. Это может вызвать серьезное повреждение пищеварительной системы и потенциально смертельное изменение кислотности крови.
См. Также
Банкноты
- ↑ 1.0 1,1 Уксусная кислота. NIST . Проверено 3 апреля 2018 года.
- ↑ Джеффри Мартин, Industrial and Manufacturing Chemistry, Part 1, Organic (Лондон: Кросби Локвуд, 1917), 330–331.
- ↑ Гельмут Швеппе, «Идентификация красителей на старых тканях», J. Am. Inst. Conservation 19 (1) (1979): 14–23. Проверено 3 апреля 2018 года.
- ↑ Р. Э. Джонс и Д. Х. Темплтон, «Кристаллическая структура уксусной кислоты».
 Acta Crystallogr. 11 (7) (1958): 484–487.
Acta Crystallogr. 11 (7) (1958): 484–487. - ↑ Джеймс М. Бриггс, Тоан Б. Нгуен и Уильям Л. Йоргенсен, «Моделирование жидкой уксусной кислоты и метилацетата методом Монте-Карло с потенциальными функциями OPLS», J. Phys. Chem. 95 (1991): 3315-3322.
- ↑ Джеймс Б. Тогеас, «Пар уксусной кислоты: 2. Статистическая механическая критика экспериментов по плотности пара», J. Phys. Chem. А 109 (2005): 5438-5444. Идентификатор цифрового объекта (DOI): 10.1021 / jp058004j
- ↑ Джон Бэкингем и Фиона Макдональд (ред.), Словарь органических соединений, 6-е изд. Т. 1. (Лондон: Чепмен и Холл, 1995, ISBN 978-0849300073).
- ↑ Норийки Йонеда, Сатору Кусано, Макото Ясуи, Питер Пуджадо и Стив Уилчер, Прил. Катал. A: Gen. 221 (2001): 253–265.
- ↑ «Производственный отчет». Chem. Англ. Новости (11 июля 2005 г.), 67–76.
- ↑ Франк С. Вагнер, «Уксусная кислота». Энциклопедия химической технологии Кирка-Отмера, 3-е издание, под редакцией Мартина Грейсона (Нью-Йорк: John Wiley & Sons, 1978).

- ↑ Майк Ланкастер, Зеленая химия, вводный текст. (Кембридж: Королевское химическое общество, 2002, ISBN 0854046208), 262–266.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Агреда, Виктор Х. и Джозеф Р. Зеллер (ред.). Уксусная кислота и ее производные. CRC Press, 1992. ISBN 0824787927.
- Блох, Д. Демистификация органической химии. Нью-Йорк: Макгроу-Хилл, 2006.ISBN 0071459200.
- Букингем, Джон и Фиона Макдональд (ред.). Словарь органических соединений, 6-е изд. Лондон: Чепмен и Холл, 1995. ISBN 978-0849300073.
- Грейсон, Мартин (ред.). Энциклопедия химической технологии Кирка-Отмера , 3-е издание. Нью-Йорк: John Wiley & Sons, 1978. .
- Ланкастер, Майк. Зеленая химия, вводный текст . Кембридж: Королевское химическое общество, 2002. ISBN 0854046208.
- Мартин, Джеффри. Промышленная и производственная химия, часть 1, органическая .
 Лондон: Кросби Локвуд, 1917.
Лондон: Кросби Локвуд, 1917. - Макмерри, Джон. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс / Коул, 2004. ISBN 0534420052.
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия, 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1992. ISBN 0136436692.
- Solomons, T.W. Грэхем и Крейг Б. Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: Джон Вили, 2004.ISBN 0471417998.
Внешние ссылки
Все ссылки получены 9 апреля 2021 г.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников Энциклопедии Нового Света, участников, так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в Энциклопедия Нового Света :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Что такое алкоголь? — Образовательное партнерство по фармакологии алкоголя
Исторически алкоголь использовался в связи с общественной деятельностью, включая религиозные и нерелигиозные ритуалы, в качестве диетического компонента и лечебного средства.Употребление алкоголя в различных культурах предшествовало письменной истории. Хотя когда-то он использовался в терапевтических целях, он больше не рекомендуется в качестве терапевтического из-за его способности вызывать интоксикацию. Способность принятого внутрь алкоголя попадать из кишечника в кровоток и в мозг, где он вызывает опьяняющий эффект, обусловлена его химической структурой и растворимостью в воде.
Химическая структура спирта
Спирты — это органических молекул, состоящих из атомов углерода (C), кислорода (O) и водорода (H).Когда присутствует 2 атома углерода, спирт называется этанолом (также известным как этиловый спирт). Этанол — это форма алкоголя, содержащаяся в напитках, включая пиво, вино и ликеры.
Узнайте больше об образовании алкоголя в напитках.
Химический состав этанола можно представить в виде 1) молекулярной формулы или 2) структурной формулы. Молекулярная формула этанола — C2H6O, что указывает на то, что этанол содержит два атома углерода и кислород. Однако структурная формула этанола, C2H5OH, дает немного больше деталей и указывает на наличие гидроксильной группы (-OH) на конце 2-углеродной цепи (Рисунок 1.1). Группа -ОН характерна для всех спиртов.
Рис. 1.1 Показаны два распространенных способа представления структуры этанола. Слева — атомная палочка, представляющая структурную формулу, а справа — модель шара и клюшки.
Алкоголь в алкогольных напитках — этанол. Этанол представляет собой двухуглеродный спирт с концевой гидроксильной группой (-ОН).
Этанол растворим в воде
Этанол — интересная молекула.Он полярный или гидрофильный (водолюбивый) из-за наличия концевой гидроксильной группы, поэтому он растворяется в воде. Тем не менее, из-за 2-х углеродной цепи он имеет немного неполярный характер. Между атомами углерода нет разделения электрических зарядов, что сводит к минимуму межмолекулярные взаимодействия в водных растворах. Обычно углеродные цепи (насыщенные атомами водорода) придают молекуле гидрофобный (водобоязненный) характер, что делает ее менее растворимой в воде. Однако в случае этанола углеродная цепь достаточно короткая, так что преобладает более полярная группа -ОН, что придает этанолу его полярный характер.В спиртах с относительно длинными углеродными цепями (4 или более) полярные эффекты группы -ОН недостаточны для преодоления гидрофобной природы углеродной цепи, в результате чего спирты становятся все менее растворимыми в воде.
Характеристики растворимости этанола становятся важными с точки зрения его способности перемещаться через биологические мембраны и по всему телу. Поскольку это небольшая молекула (молекулярная масса = 46 г / моль), она проходит через поры (отверстия) в биологической мембране.Фактически, он распределяется в любой области тела, в которой находится вода. Однако 2-углеродная цепь в этаноле делает его слегка липофильным (любящим липиды), поэтому он также может проникать через липидные бислои биологических мембран.
Рис. 1.2 Растворимость спирта зависит от присутствия концевой гидроксильной (ОН) группы и длины его углеродной цепи.
Способность этанола распределяться по организму обусловлена его небольшим размером и полярной гидроксильной (ОН) группой.
Что такое этанол? — Формула, структура и использование — Видео и стенограмма урока
Использование этанола
Этанол — такое простое химическое соединение, но у него так много применений. Его используют в антисептических средствах, бытовых чистящих средствах и даже в лаках. В этом разделе мы рассмотрим некоторые из множества вариантов использования этанола.
Его используют в антисептических средствах, бытовых чистящих средствах и даже в лаках. В этом разделе мы рассмотрим некоторые из множества вариантов использования этанола.
Алкогольные напитки
На общественных собраниях и вечеринках взрослых весьма вероятно, что будут присутствовать алкогольные напитки.Этанол — это алкоголь, который содержится в наших алкогольных напитках, таких как пиво, виски и бренди. В алкогольных напитках этанол получают в процессе ферментации , которая представляет собой химическое расщепление сахара дрожжами.
Бывают случаи, когда нам подают «горячие напитки», как на иллюстрации ниже. Это связано с тем, что этанол, присутствующий в напитке, легко воспламеняется.
Дезинфицирующие средства для рук и медицинские салфетки
Мы часто видим дозаторы дезинфицирующего средства для рук в общественных туалетах. Во время сезона гриппа мы также обычно носим в сумке небольшую бутылочку дезинфицирующего средства для рук. Этанол эффективен в уничтожении таких организмов, как бактерии, грибки и вирусы, поэтому неудивительно, что еще одним распространенным применением этанола является то, что он входит в состав дезинфицирующих гелей для рук. Он также используется в медицинских салфетках, в клиниках и больницах.
Во время сезона гриппа мы также обычно носим в сумке небольшую бутылочку дезинфицирующего средства для рук. Этанол эффективен в уничтожении таких организмов, как бактерии, грибки и вирусы, поэтому неудивительно, что еще одним распространенным применением этанола является то, что он входит в состав дезинфицирующих гелей для рук. Он также используется в медицинских салфетках, в клиниках и больницах.
Различные растворители
Вы когда-нибудь задумывались, что такое растворитель для таких продуктов, как духи, лаки и краски? Общее у этих продуктов то, что в качестве растворителя используется этанол.Поскольку этанол легко смешивается с водой и многими другими органическими соединениями, он является идеальным растворителем для этих продуктов. Это обычный растворитель в продуктах личной гигиены, таких как дезодоранты, лаки для волос и вяжущие средства. Он также содержится в пищевых добавках, таких как пищевой краситель и ароматизатор. Краски, лаки и лаки также содержат этанол в качестве одного из компонентов.
Он также содержится в пищевых добавках, таких как пищевой краситель и ароматизатор. Краски, лаки и лаки также содержат этанол в качестве одного из компонентов.
Топливо
Этанол широко используется в качестве топлива для двигателей и добавки к бензину, особенно в Бразилии и США.Большинство автомобилей в США могут работать на бензине, содержащем до 10% этанола. В Бразилии их автомобили могут даже использовать в качестве топлива 100% этанол!
Есть автомобили с двигателями с гибким топливом , которые являются двигателями, которые могут использовать более одного типа топлива. В Бразилии их двигатели с гибким топливом могут работать на 100% этаноле, а в Соединенных Штатах двигатели с гибким топливом могут работать на до 85% этаноле в качестве топлива.
Экологичные камины работают на этаноле, при этом они выделяют только водяной пар и небольшое количество углекислого газа.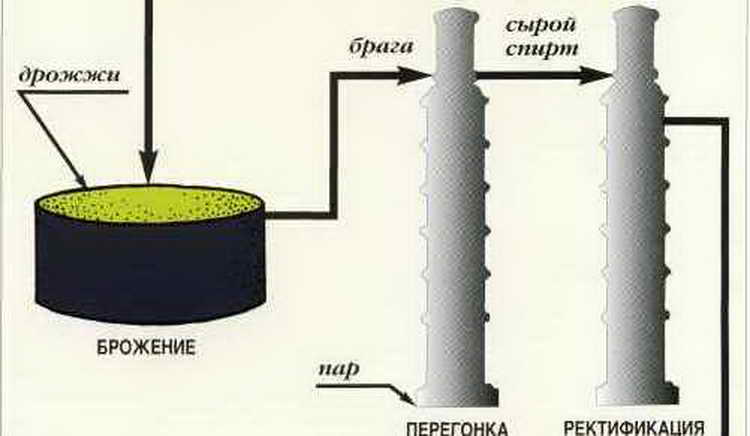 В Европе этанольные камины стали популярными, особенно для людей с небольшими квартирами без очага и дымохода.
В Европе этанольные камины стали популярными, особенно для людей с небольшими квартирами без очага и дымохода.
Краткое содержание урока
Этанол , также известный как этиловый спирт и сокращенно EtOH , представляет собой бесцветную, летучую и легковоспламеняющуюся жидкость, растворимую в воде. Его химическая формула — C2H6O, или может быть записана как C2H5OH или Ch4Ch3OH.Он имеет одну метильную (-Ch4) группу, одну метиленовую (-Ch3-) группу и одну гидроксильную (-OH) группу.
Этанол находит широкое применение, например, в качестве спиртового компонента в алкогольных напитках и в качестве растворителя в продуктах личной гигиены, таких как духи, жидкость для полоскания рта и дезодорант. Он также используется в пищевых красителях и пищевых добавках для ароматизации. Этанол может уничтожать некоторые вирусы, бактерии и грибки, поэтому он также входит в состав дезинфицирующих гелей для рук и медицинских салфеток. Он также используется в качестве топлива для автомобилей и топлива для экологически чистых каминов.
Он также используется в качестве топлива для автомобилей и топлива для экологически чистых каминов.
Обзор этанола
- Этанол — прозрачная летучая водорастворимая жидкость.
- Этанол состоит из двух атомов углерода, шести атомов водорода и одного атома кислорода.
- Этанол также называют этиловым спиртом, чистым спиртом, зерновым спиртом и питьевым спиртом.
- Этанол используется для производства топлива, алкоголя, дезинфицирующих средств, средств личной гигиены и пищевых добавок.
Результаты обучения
Собрав информацию об этаноле с помощью этого урока, проверьте свою способность делать следующее:
- Предоставьте подробную информацию об этаноле, включая названия, под которыми он известен, и его химическую формулу
- Распознать молекулярный состав этанола и указать его свойства
- Обсудить некоторые цели этанола

 Более опасные суррогаты – это бытовые жидкости, такие как растворители, средства для мытья стекол и поверхностей, политура; тормозная жидкость, антифризы; клей БФ. Они могут содержать гидролизный и сульфатный спирты, денатурат, примеси метилового спирта, этиленгликоля, альдегиды, эфирные масла, ацетон, хлороформ, красители, прочие ядовитые вещества.
Более опасные суррогаты – это бытовые жидкости, такие как растворители, средства для мытья стекол и поверхностей, политура; тормозная жидкость, антифризы; клей БФ. Они могут содержать гидролизный и сульфатный спирты, денатурат, примеси метилового спирта, этиленгликоля, альдегиды, эфирные масла, ацетон, хлороформ, красители, прочие ядовитые вещества. рис и очень популярен в Японии. пюре из зерна, такого как рожь, кукуруза или ячмень
рис и очень популярен в Японии. пюре из зерна, такого как рожь, кукуруза или ячмень Около 40 процентов метанола превращается в формальдегид, а из него в такие разнообразные продукты, как пластмассы, фанера, краски, взрывчатые вещества и ткани для прочного прессования.
Около 40 процентов метанола превращается в формальдегид, а из него в такие разнообразные продукты, как пластмассы, фанера, краски, взрывчатые вещества и ткани для прочного прессования. Метанол требуется для двигателя с наддувом в Top Alcohol Dragster, и до конца сезона 2005 года все автомобили Indianapolis 500 должны были работать на метаноле.Грязевые гонщики смешали метанол с бензином и закисью азота, чтобы получить больше энергии, чем только бензин и закись азота. Одним из недостатков метанола как топлива является его коррозионная активность по отношению к некоторым металлам, в том числе к алюминию, о чем говорилось ранее.
Метанол требуется для двигателя с наддувом в Top Alcohol Dragster, и до конца сезона 2005 года все автомобили Indianapolis 500 должны были работать на метаноле.Грязевые гонщики смешали метанол с бензином и закисью азота, чтобы получить больше энергии, чем только бензин и закись азота. Одним из недостатков метанола как топлива является его коррозионная активность по отношению к некоторым металлам, в том числе к алюминию, о чем говорилось ранее.
 Однако к концу 1990-х годов было обнаружено, что МТБЭ просочился из резервуаров для хранения бензина в грунтовые воды в количестве, достаточном для того, чтобы повлиять на вкус питьевой воды из городских источников во многих районах.Более того, исследования на животных показали, что МТБЭ является канцерогеном. В результате негативной реакции несколько штатов запретили использование МТБЭ, и его будущее производство остается неопределенным.
Однако к концу 1990-х годов было обнаружено, что МТБЭ просочился из резервуаров для хранения бензина в грунтовые воды в количестве, достаточном для того, чтобы повлиять на вкус питьевой воды из городских источников во многих районах.Более того, исследования на животных показали, что МТБЭ является канцерогеном. В результате негативной реакции несколько штатов запретили использование МТБЭ, и его будущее производство остается неопределенным. Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс / Коул, 2004. ISBN 0534420052.
Органическая химия . 6-е изд. Бельмонт, Калифорния: Брукс / Коул, 2004. ISBN 0534420052. ) → CH 3 COONa (водн.) + CO 2 (г) + H 2 O (л)
) → CH 3 COONa (водн.) + CO 2 (г) + H 2 O (л)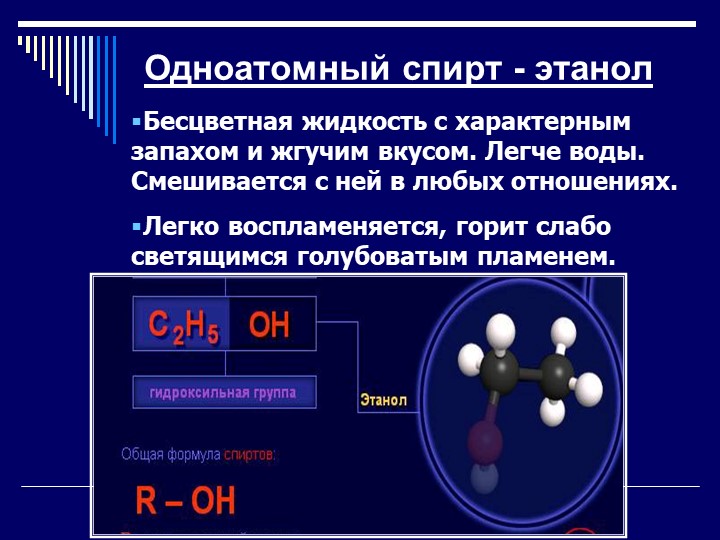
 Acta Crystallogr. 11 (7) (1958): 484–487.
Acta Crystallogr. 11 (7) (1958): 484–487.
 Лондон: Кросби Локвуд, 1917.
Лондон: Кросби Локвуд, 1917.